劳动实践课上同学们用草木灰给农作物施肥。课后同学查阅资料,得知草木灰是一种重要的农家肥,碳酸钾含量高。
【提出问题】
如何测定草木灰中碳酸钾的含量?
【查阅资料】
1.常见草木灰钾含量(以碳酸钾表示)如下表:
2.提取碳酸钾主要过程是:秸秆→草木灰→滤液→固体
(1)表格中钾含量最高的草木灰是_______ ,同学们选用这种秸秆灰提取碳酸钾。
【设计与实验】
实验一:提取碳酸钾
第一步:燃烧秸秆,收集草木灰,称取20.00g。
第二步:用60℃水浸洗草木灰(如图1)并过滤,浸洗滤渣2次,合并滤液。
第三步:蒸发滤液,烘干得到9.90g固体。
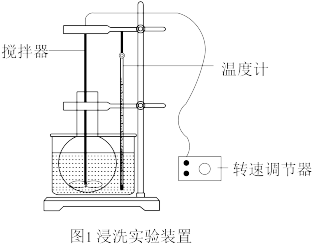
(2)图1实验中,用60℃的温水而不用冷水浸洗的原因是_______ 。
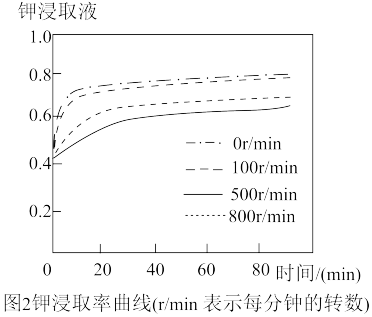
(3)根据图2,搅拌器转速控制在每分钟_______ 转,浸取时间为_______ 分钟,比较适宜。
实验二:测定碳酸钾含量
取实验一中所得固体3.30g进行图3实验。
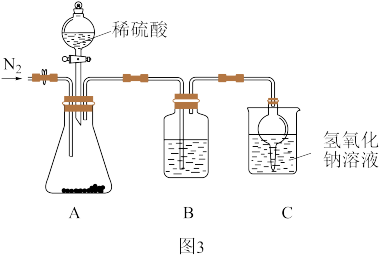
(4)实验中需缓慢滴入稀硫酸,原因是_______ 。
(5)装置B的作用是_______ 。
【数据与解释】
(6)称量图3中反应前后烧杯和其中溶液的总质量,增重0.92g。计算草木灰中碳酸钾的质量分数为_______ %,与表格中数据相比明显偏低,原因可能是_______ (填序号)。
a.烧杯中溶液与空气接触 b.固体含有其它钾盐 c.固体含有氯化钠
【反思与评价】
(7)我国秸秆产量巨大,可作为生物质发电的原料,还可利用其燃烧发电产生的草木灰提取碳酸钾,其优点有_______ (写一条)。
【提出问题】
如何测定草木灰中碳酸钾的含量?
【查阅资料】
1.常见草木灰钾含量(以碳酸钾表示)如下表:
| 草木灰种类 | 小灌木灰 | 稻草灰 | 小麦秆灰 | 棉壳灰 | 棉秆灰 | 向日葵杆灰 |
 (%) (%) | 8.66 | 2.63 | 20.26 | 32.28 | 16.44 | 51.97 |
(1)表格中钾含量最高的草木灰是
【设计与实验】
实验一:提取碳酸钾
第一步:燃烧秸秆,收集草木灰,称取20.00g。
第二步:用60℃水浸洗草木灰(如图1)并过滤,浸洗滤渣2次,合并滤液。
第三步:蒸发滤液,烘干得到9.90g固体。

(2)图1实验中,用60℃的温水而不用冷水浸洗的原因是
(3)根据图2,搅拌器转速控制在每分钟

实验二:测定碳酸钾含量
取实验一中所得固体3.30g进行图3实验。

(4)实验中需缓慢滴入稀硫酸,原因是
(5)装置B的作用是
【数据与解释】
(6)称量图3中反应前后烧杯和其中溶液的总质量,增重0.92g。计算草木灰中碳酸钾的质量分数为
a.烧杯中溶液与空气接触 b.固体含有其它钾盐 c.固体含有氯化钠
【反思与评价】
(7)我国秸秆产量巨大,可作为生物质发电的原料,还可利用其燃烧发电产生的草木灰提取碳酸钾,其优点有
更新时间:2022-09-01 09:35:53
|
相似题推荐
解答题-实验探究题
|
较易
(0.85)
名校
【推荐1】长期存放的亚硫酸钠可能会被空气中的氧气氧化。某化学兴趣小组通过实验来测定亚硫酸钠试剂的被氧化的程度,设计了如下图实验。请回答下面的问题:

(1)若将虚线框内的分液漏斗换成长颈漏斗,则应该怎样检查虚线框内装置的气密性?_____ 。
(2) D装置中反应的化学方程式为________ ,B装置中反应的离子方程为_______ 。为保证实验测定的准确性,则C装置中反应的离子方程式为:______ 。
(3)称量ag Na2SO3样品放入锥形瓶中,向B装置反应后的溶液中加入足量的BaCl2溶液充分反应、过滤、洗涤、干燥,得白色沉淀bg,原样品中Na2SO3的质量分为数为:____________ 。
(4)现有以下试剂:①蒸馏水、②稀盐酸、③稀硝酸、④BaCl2溶液、⑤Ba(NO3)2溶液,请从中选择合适试剂__________ ,设计一种不同的实验方法测定试样中无水亚硫酸钠被氧化的程度_________ 。

(1)若将虚线框内的分液漏斗换成长颈漏斗,则应该怎样检查虚线框内装置的气密性?
(2) D装置中反应的化学方程式为
(3)称量ag Na2SO3样品放入锥形瓶中,向B装置反应后的溶液中加入足量的BaCl2溶液充分反应、过滤、洗涤、干燥,得白色沉淀bg,原样品中Na2SO3的质量分为数为:
(4)现有以下试剂:①蒸馏水、②稀盐酸、③稀硝酸、④BaCl2溶液、⑤Ba(NO3)2溶液,请从中选择合适试剂
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐2】工业上测量SO2、N2、O2混合气体中SO2含量的装置如下图;反应管中装有碘的淀粉溶液。SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O→H2SO4+2HI
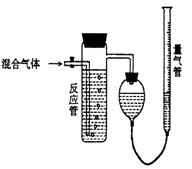
(1)混合气体进入反应管后,量气管内增加的水的体积等于___________ 的体积(填写气体的分子式)。
(2)反应管内溶液蓝色消失后,没有及时停止通气, 则测得的SO2含量___________ (选填:偏高,偏低,不受影响)。
(3)反应管内的碘的淀粉溶液也可以用___________ 代替(填写物质名称)。
(4)若碘溶液体积为VamL。,浓度为Cmol·L-1,N2与O2的体积为VbmL(已折算为标准状况下的体积)。用C、Va、Vb表示SO2的体积百分含量为:___________ 。
(5)将上述装置改为简易实验装置,除导管外,还需选用的仪器为_______ (选下列仪器的编号)。
a.烧杯 b.试管 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞

(1)混合气体进入反应管后,量气管内增加的水的体积等于
(2)反应管内溶液蓝色消失后,没有及时停止通气, 则测得的SO2含量
(3)反应管内的碘的淀粉溶液也可以用
(4)若碘溶液体积为VamL。,浓度为Cmol·L-1,N2与O2的体积为VbmL(已折算为标准状况下的体积)。用C、Va、Vb表示SO2的体积百分含量为:
(5)将上述装置改为简易实验装置,除导管外,还需选用的仪器为
a.烧杯 b.试管 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
【推荐3】硫化钠是重要的化工原料,大多采用无水芒硝(Na2SO4)—炭粉还原法制备,原理为Na2SO4+2C Na2S+2CO2↑。其主要流程如下:
Na2S+2CO2↑。其主要流程如下:
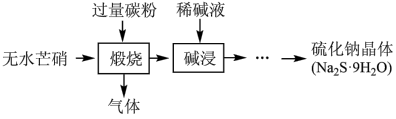
(1) Na2S溶液显碱性,写出相关反应的方程式(主要)______ ,上述流程中采用稀碱液比用热水更好,理由是______ 。
(2)已知:I2+2 =2I-+
=2I-+ 。上述所制得的Na2S·9H2O晶体中含有Na2S2O3·5H2O等杂质。为测定产品的成分,进行下列实验,步骤如下:
。上述所制得的Na2S·9H2O晶体中含有Na2S2O3·5H2O等杂质。为测定产品的成分,进行下列实验,步骤如下:
a. 取试样10.00 g配成500.00 mL溶液。
b. 取所配溶液25.00 mL于碘量瓶中,加入过量ZnCO3悬浊液除去Na2S后,过滤,向滤液中滴入2~3滴淀粉溶液,用0.050 00 mol·L-1I2溶液滴定至终点,用去5.00mL I2溶液。
c. 再取所配溶液25.00 mL于碘量瓶中,加入50.00 mL 0.050 00 mol·L-1的I2溶液,并滴入2~3滴淀粉溶液,振荡。用标准Na2S2O3溶液滴定多余的I2,用去20.00 mL 0.100 0 mol·L-1 Na2S2O3溶液。
①步骤b中用ZnCO3除去Na2S的离子方程式为______ 。
②判断步骤c中滴定终点的方法为______ 。
③计算试样中Na2S·9H2O的质量分数______ (写出计算过程)。
 Na2S+2CO2↑。其主要流程如下:
Na2S+2CO2↑。其主要流程如下:
(1) Na2S溶液显碱性,写出相关反应的方程式(主要)
(2)已知:I2+2
 =2I-+
=2I-+ 。上述所制得的Na2S·9H2O晶体中含有Na2S2O3·5H2O等杂质。为测定产品的成分,进行下列实验,步骤如下:
。上述所制得的Na2S·9H2O晶体中含有Na2S2O3·5H2O等杂质。为测定产品的成分,进行下列实验,步骤如下:a. 取试样10.00 g配成500.00 mL溶液。
b. 取所配溶液25.00 mL于碘量瓶中,加入过量ZnCO3悬浊液除去Na2S后,过滤,向滤液中滴入2~3滴淀粉溶液,用0.050 00 mol·L-1I2溶液滴定至终点,用去5.00mL I2溶液。
c. 再取所配溶液25.00 mL于碘量瓶中,加入50.00 mL 0.050 00 mol·L-1的I2溶液,并滴入2~3滴淀粉溶液,振荡。用标准Na2S2O3溶液滴定多余的I2,用去20.00 mL 0.100 0 mol·L-1 Na2S2O3溶液。
①步骤b中用ZnCO3除去Na2S的离子方程式为
②判断步骤c中滴定终点的方法为
③计算试样中Na2S·9H2O的质量分数
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
名校
解题方法
【推荐1】一种用软锰矿(主要成分MnO2)和黄铁矿(主要成分FeS2)制取MnSO4∙H2O并回收单质硫的工艺流程如下:

已知:本实验条件下,高锰酸钾溶液与硫酸锰溶液混合产生二氧化锰。
回答下列问题:
(1)步骤①混合研磨成细粉的主要目的是_______ ;步骤②浸取时若生成S、MnSO4及Fe2(SO4)3的化学方程式为_______ 。
(2)步骤③所得酸性滤液可能含有Fe2+,为了除去Fe2+可先加入_______ ;步骤④需将溶液加热至沸然后在不断搅拌下加入碱调节pH为4-5,再继续煮沸一段时间,“继续煮沸”的目的是______ 。步骤⑤所得滤渣为_______ (填化学式)。
(3)步骤⑦需在90-100℃下进行,该反应的化学方程式________ 。
(4)测定产品MnSO4∙H2O的方法之一是:准确称取ag产品于锥形瓶中,加入适量ZnO及H2O煮沸,然后用cmol∙L-1KMnO4标准溶液滴定,确定达到滴定终点的标志是_______ 。若消耗标准溶液VmL,则产品中Mn2+的质量分数为ω(Mn2+)=________ 。

已知:本实验条件下,高锰酸钾溶液与硫酸锰溶液混合产生二氧化锰。
回答下列问题:
(1)步骤①混合研磨成细粉的主要目的是
(2)步骤③所得酸性滤液可能含有Fe2+,为了除去Fe2+可先加入
(3)步骤⑦需在90-100℃下进行,该反应的化学方程式
(4)测定产品MnSO4∙H2O的方法之一是:准确称取ag产品于锥形瓶中,加入适量ZnO及H2O煮沸,然后用cmol∙L-1KMnO4标准溶液滴定,确定达到滴定终点的标志是
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐2】粗盐提纯实验的科学探究。
I.粗盐中含有较多的杂质,化学兴趣小组同学按照课本“活动与探究”的要求Ⅱ做粗盐提纯实验,并计算产率。
(1)“活动与探究”中,操作步骤有:①计算产率、②过滤、③溶解、④蒸发,正确的操作顺序为___________ (填序号)。
(2)在实验中三个步骤中都须使用的一种仪器是___________ (填序号)

Ⅱ.化学兴趣小组同学欲除去固体氯化钠中混有的氯化钙。设计实验方案如下,请参与实验并回答问题。
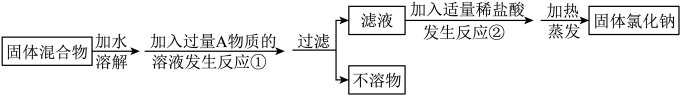
(3)写出A物质的俗称:___________ 。
(4)写出反应②的化学方程式:___________ 。
(5)反应①中加入过量A物质的目的是___________ ;反应②中如果加入盐酸也过量,则对所得到的氯化钠纯度___________ 。(填“有”或“没有”)影响。
(6)分离后所得氯化钠的质量与分离前原混合物中氯化钠的质量相比较,结果___________ (填增大、不变或减少)。
I.粗盐中含有较多的杂质,化学兴趣小组同学按照课本“活动与探究”的要求Ⅱ做粗盐提纯实验,并计算产率。
(1)“活动与探究”中,操作步骤有:①计算产率、②过滤、③溶解、④蒸发,正确的操作顺序为
(2)在实验中三个步骤中都须使用的一种仪器是

Ⅱ.化学兴趣小组同学欲除去固体氯化钠中混有的氯化钙。设计实验方案如下,请参与实验并回答问题。

(3)写出A物质的俗称:
(4)写出反应②的化学方程式:
(5)反应①中加入过量A物质的目的是
(6)分离后所得氯化钠的质量与分离前原混合物中氯化钠的质量相比较,结果
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐3】现有一定量含有Na2O杂质的Na2O2试样,用如图的实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、稀盐酸、稀硫酸和蒸馏水)

回答下列问题:
(1)装置A中液体试剂选用稀盐酸而不选用稀硫酸,理由是___ 。
(2)装置C的作用是___ ,装置E中碱石灰的作用是___ 。
(3)装置D中发生反应的化学方程式是___ 。
(4)若开始时测得样品的质量为2.0g,反应结束后测得气体体积为250mL,该条件下此气体密度为0.00128g/mL。则Na2O2试样的纯度为___ 。

回答下列问题:
(1)装置A中液体试剂选用稀盐酸而不选用稀硫酸,理由是
(2)装置C的作用是
(3)装置D中发生反应的化学方程式是
(4)若开始时测得样品的质量为2.0g,反应结束后测得气体体积为250mL,该条件下此气体密度为0.00128g/mL。则Na2O2试样的纯度为
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
【推荐1】工业上用“碳捕捉”技术将CO和 混合气体中的
混合气体中的 捕捉并回收CO,其基本过程如下图所示(部分条件及物质未标出):
捕捉并回收CO,其基本过程如下图所示(部分条件及物质未标出):
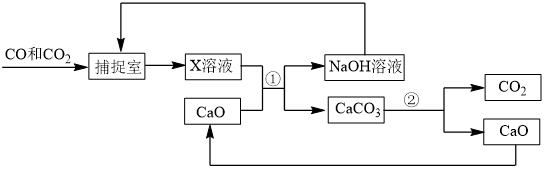
(1)反应②分离出的 可制成干冰,干冰常用于
可制成干冰,干冰常用于___________ 。
(2)反应①在“反应分离室”内进行,涉及到的化学反应方程式为:___________ 、___________ ;将NaOH溶液和 分离,得到纯净的
分离,得到纯净的 的操作是
的操作是___________ 。
(3)下列有关该捕捉过程的叙述正确的有___________;(填序号)
(4) 过量排放对环境影响很大,发展“低碳经济”是全社会的共识。下列说法错误的是___________;(填序号)
过量排放对环境影响很大,发展“低碳经济”是全社会的共识。下列说法错误的是___________;(填序号)
 混合气体中的
混合气体中的 捕捉并回收CO,其基本过程如下图所示(部分条件及物质未标出):
捕捉并回收CO,其基本过程如下图所示(部分条件及物质未标出):
(1)反应②分离出的
 可制成干冰,干冰常用于
可制成干冰,干冰常用于(2)反应①在“反应分离室”内进行,涉及到的化学反应方程式为:
 分离,得到纯净的
分离,得到纯净的 的操作是
的操作是(3)下列有关该捕捉过程的叙述正确的有___________;(填序号)
A.捕捉到的 可用于制备其他化工产品,减少了温室气体的排放 可用于制备其他化工产品,减少了温室气体的排放 |
| B.“反应分离室”中的反应要吸收大量热 |
| C.整个过程中只有一种物质可循环利用 |
| D.能耗大是该捕捉技术的一大缺点 |
 过量排放对环境影响很大,发展“低碳经济”是全社会的共识。下列说法错误的是___________;(填序号)
过量排放对环境影响很大,发展“低碳经济”是全社会的共识。下列说法错误的是___________;(填序号)A. 大量排放导致酸雨 大量排放导致酸雨 |
B.将 转变为稳定的碳酸盐,可实现 转变为稳定的碳酸盐,可实现 的长期封存 的长期封存 |
C.利用 合成聚碳酸酯类可降解塑料,可实现“碳”的循环利用 合成聚碳酸酯类可降解塑料,可实现“碳”的循环利用 |
D.利用化学试剂吸收 可实现“碳捕捉” 可实现“碳捕捉” |
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
名校
【推荐2】海洋是一个巨大的资源宝库。海水资源综合利用的部分途径如下图:
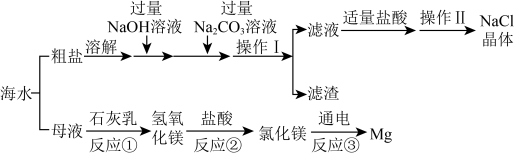
已知:粗盐中的杂质有泥沙、 、
、 ,流程中部分操作及试剂已省略。
,流程中部分操作及试剂已省略。
(1)“操作I”中玻璃棒的作用是_______ 。
(2)滤渣中除泥沙外还有_______ (填化学式)。
(3)反应①和③的化学反应方程式分别为_______ ;_______ 。
(4)海水中本身就有氯化镁,请分析反应①、②转化过程的目的_______ 。
(5)根据图中KNO3、NaCl的溶解度曲线,下列说法不正确的是_______ (填字母)。
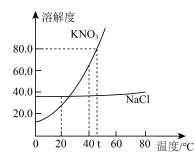
A.t℃时,将45g KNO3固体放入50g水中充分溶解,所得溶液的质量为95g
B.NaCl溶液中含有少量KNO3,可以采用蒸发结晶的方法提纯NaCl
C.40℃时,将KNO3的饱和溶液降温至20℃,溶液的溶质质量分数减小(不考虑水分损失)
(6)同学们查阅NaCl的溶解度曲线后,欲配制20℃时100g溶质质量分数为10%的NaCl溶液。已知配制溶液的步骤有:①溶解 ②计算 ③装瓶存放 ④称量。上述步骤的正确顺序为_______ (填序号)。

已知:粗盐中的杂质有泥沙、
 、
、 ,流程中部分操作及试剂已省略。
,流程中部分操作及试剂已省略。(1)“操作I”中玻璃棒的作用是
(2)滤渣中除泥沙外还有
(3)反应①和③的化学反应方程式分别为
(4)海水中本身就有氯化镁,请分析反应①、②转化过程的目的
(5)根据图中KNO3、NaCl的溶解度曲线,下列说法不正确的是

A.t℃时,将45g KNO3固体放入50g水中充分溶解,所得溶液的质量为95g
B.NaCl溶液中含有少量KNO3,可以采用蒸发结晶的方法提纯NaCl
C.40℃时,将KNO3的饱和溶液降温至20℃,溶液的溶质质量分数减小(不考虑水分损失)
(6)同学们查阅NaCl的溶解度曲线后,欲配制20℃时100g溶质质量分数为10%的NaCl溶液。已知配制溶液的步骤有:①溶解 ②计算 ③装瓶存放 ④称量。上述步骤的正确顺序为
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐1】请结合图回答问题:

(1)仪器②的名称是___ 。
(2)实验室选用A装置制取O2的化学方程式是___ 。
(3)实验室制取CO2,若将发生装置由B改为F,其优点是___ 。
①为了得到纯净、干燥的CO2,除杂装置(如图:饱和碳酸氢钠溶液可以吸收HCl气体)的导管按气流方向连接顺序是___ (选填字母)。

a.1→2→4→3 b.2→1→3→4
c.4→3→1→2 d.3→4→2→1
②写出检验CO2的化学方程式___ 。

(1)仪器②的名称是
(2)实验室选用A装置制取O2的化学方程式是
(3)实验室制取CO2,若将发生装置由B改为F,其优点是
①为了得到纯净、干燥的CO2,除杂装置(如图:饱和碳酸氢钠溶液可以吸收HCl气体)的导管按气流方向连接顺序是

a.1→2→4→3 b.2→1→3→4
c.4→3→1→2 d.3→4→2→1
②写出检验CO2的化学方程式
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐2】试管是实验室常见的反应容器,在不同的化学实验中试管口的朝向不同,见下图。

(1)向试管中加入块状固体时,试管口的朝向应选_______ (填编号)。用胶头滴管向试管中滴加液体时,试管口的朝向应选_______ (填编号)。
(2)请在下表两个实验图示中添加合适的试管朝向编号(铁夹和试管夹的位置朝向随试管而变)。
(3)实验结束后,清洗干净的试管应选择_____ (填编号)朝向放在试管架上,备用,整理桌面。

(1)向试管中加入块状固体时,试管口的朝向应选
(2)请在下表两个实验图示中添加合适的试管朝向编号(铁夹和试管夹的位置朝向随试管而变)。
| 实验名称 | 加热液体 | 加热固体 |
| 实验图示 |  |  |
| 试管口朝向(填编号) | ||
| 选择该朝向的原因 | 防止液体流出 |
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐3】根据下图回答有关问题。

(1)仪器E的名称为___________ 。
(2)图A~C是常见实验基本操作。其中正确的是___________ (填序号);请选择一个有错误的操作写出改正方法:_________________________________________________________________________ 。
(3)选择仪器D~I完成下列实验操作:
①用KMnO4制备O2,应选仪器________ (填序号),其化学反应方程式为_________________________________ ;
②用大理石与稀盐酸反应制备CO2并使反应随时发生或停止,应选仪器___________ ,其反应方程式为______________________ 。
(4)如图是以锌粒和稀硫酸反应制备H2,并用排水法收集。请把图补画完整____________ 。


(1)仪器E的名称为
(2)图A~C是常见实验基本操作。其中正确的是
(3)选择仪器D~I完成下列实验操作:
①用KMnO4制备O2,应选仪器
②用大理石与稀盐酸反应制备CO2并使反应随时发生或停止,应选仪器
(4)如图是以锌粒和稀硫酸反应制备H2,并用排水法收集。请把图补画完整

您最近一年使用:0次

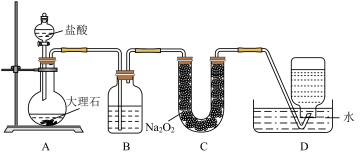
 与
与

