高钴酸钠是钴元素目前发现的最高价化合物,实验室可通过电解硫酸钠与氯化钴的混合溶液获得氧化亚钴(CoO),并通过一系列反应来制备高钴酸钠,相关化学方程式如下:
CoCl2+H2O CoO↓+H2↑+Cl2↑;
CoO↓+H2↑+Cl2↑;
CoO+O2 → Co3O4 (未配平)
Co3O4+Na2O+O2→Na3CoO4 (未配平)
请计算:
(1)以氯化钴为原料制备1.920 g的高钴酸钠,消耗标准状况下氧气的体积为______ mL。
(2)若电解过程转移电子共0.100 mol,两极收集到气体标准状况下总体积2.016 L (不考虑气体的溶解),则可制得高钴酸钠的质量为________ (计算结果并写出计算过程)。
CoCl2+H2O
 CoO↓+H2↑+Cl2↑;
CoO↓+H2↑+Cl2↑;CoO+O2 → Co3O4 (未配平)
Co3O4+Na2O+O2→Na3CoO4 (未配平)
请计算:
(1)以氯化钴为原料制备1.920 g的高钴酸钠,消耗标准状况下氧气的体积为
(2)若电解过程转移电子共0.100 mol,两极收集到气体标准状况下总体积2.016 L (不考虑气体的溶解),则可制得高钴酸钠的质量为
更新时间:2022-09-16 21:36:46
|
相似题推荐
填空题
|
适中
(0.64)
【推荐1】已知钙的金属活泼性介于钾和钠之间,其化学性质与钠相似。钙及其化合物的有关反应如下:
①Ca+2H2O Ca(OH)2+H2↑ ②CaO+H2O
Ca(OH)2+H2↑ ②CaO+H2O Ca(OH)2
Ca(OH)2
③CaO2+H2O
__________ ④CaO+CO2 CaCO3
CaCO3
⑤2CaO2+2CO2 2CaCO3+O2
2CaCO3+O2
结合所学知识完成下列问题:
(1)完成上述③的化学方程式: CaO2 + H2O
______________________ ;
(2)用双线桥标出反应①的电子转移方向和数目:Ca+2H2O Ca(OH)2+H2↑
Ca(OH)2+H2↑
(3)写出以钙为原料制取过氧化钙(CaO2)的化学方程式:____________________________ ;
(4)在CaO2的水溶液中,滴入酚酞溶液,预期的实验现象可能是_______________________ ;在该溶液中加入少量的MnO2固体,有气泡生成,写出该反应的化学方程式_____________________ 。
①Ca+2H2O
 Ca(OH)2+H2↑ ②CaO+H2O
Ca(OH)2+H2↑ ②CaO+H2O Ca(OH)2
Ca(OH)2③CaO2+H2O

 CaCO3
CaCO3⑤2CaO2+2CO2
 2CaCO3+O2
2CaCO3+O2结合所学知识完成下列问题:
(1)完成上述③的化学方程式: CaO2 + H2O

(2)用双线桥标出反应①的电子转移方向和数目:Ca+2H2O
 Ca(OH)2+H2↑
Ca(OH)2+H2↑(3)写出以钙为原料制取过氧化钙(CaO2)的化学方程式:
(4)在CaO2的水溶液中,滴入酚酞溶液,预期的实验现象可能是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】如图是铁及其化合物的“价一类”二维图的部分信息。
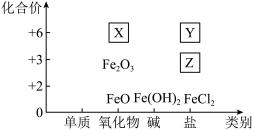
回答下列问题:
(1)Fe2O3是红棕色粉末,常用作___________ (写一种用途)。
(2)K2FeO4位于图中___________ (填“X”“Y”或“Z”),可用作自来水处理剂,它与水作用的化学方程式为 ,每消耗39.6gK2FeO4,生成O2物质的量为
,每消耗39.6gK2FeO4,生成O2物质的量为___________ ,转移电子的数目为___________ 。[M(K2FeO4)=198g·mol-1]
(3)Fe(OH)2容易被空气中的O2氧化,最终变为红褐色,反应的化学方程式为___________ 。
(4)某兴趣小组设计实验检验FeCl2溶液中的Fe2+,实验方案为___________ (可供选用的试剂:0.1mol·L-1FeCl2溶液、新制氯水、酸性KMnO4溶液、KSCN溶液、铁粉)。

回答下列问题:
(1)Fe2O3是红棕色粉末,常用作
(2)K2FeO4位于图中
 ,每消耗39.6gK2FeO4,生成O2物质的量为
,每消耗39.6gK2FeO4,生成O2物质的量为(3)Fe(OH)2容易被空气中的O2氧化,最终变为红褐色,反应的化学方程式为
(4)某兴趣小组设计实验检验FeCl2溶液中的Fe2+,实验方案为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】SO2和NOx都是大气污染物,工业上可以用多种方法去除这些污染物。
(1)利用氨水可以将SO2和NO2吸收,原理如下图所示:

NO2被吸收的离子方程式是_______ 。
(2)湿法吸收工业尾气中的NO2,常选用纯碱溶液,将NO2转化为两种氮元素的常见含氧酸盐,其反应的离子方程式是(已知酸性HNO2>H2CO3)_______ 。
(3)NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。NSR(NOx储存还原)工作原理:NOx的储存和还原在不同时段交替进行,如下图所示。
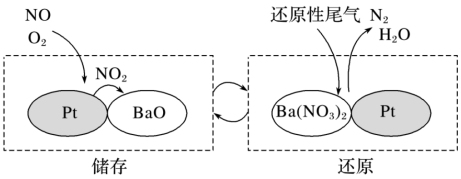
①通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。储存NOx的物质是_______ ,NO2和O2生成Ba(NO3)2的化学方程式是_______ 。
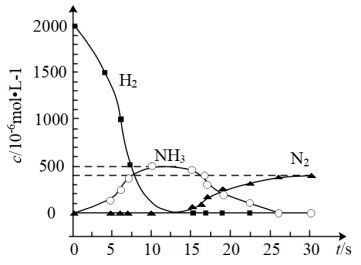
②用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,下图表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的H2与Ba(NO3)2的物质的量之比是_______ 。
(1)利用氨水可以将SO2和NO2吸收,原理如下图所示:

NO2被吸收的离子方程式是
(2)湿法吸收工业尾气中的NO2,常选用纯碱溶液,将NO2转化为两种氮元素的常见含氧酸盐,其反应的离子方程式是(已知酸性HNO2>H2CO3)
(3)NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。NSR(NOx储存还原)工作原理:NOx的储存和还原在不同时段交替进行,如下图所示。

①通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。储存NOx的物质是
②用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,下图表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的H2与Ba(NO3)2的物质的量之比是

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】电解原理在化学工业中有广泛的应用。如图所示为一电解池装置,U形管内装有电解液c,A、B是两块电极板,通过导线与直流电源相连。
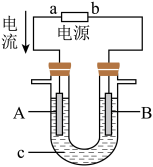
(1)若A、B都是惰性电极,电解质溶液c是饱和NaCl溶液,实验开始时,同时在U形管两边各滴入几滴酚酞试剂,试判断:
①a电极是_______ 极(填“正”或“负”),B电极是_______ 极(填“阴”或“阳”);
②A电极产生的气体为____ ,B电极周围的现象____ ,B电极的电极反应式为____ ;
③检验A电极上产物的试剂是:_______ ,发生的反应是_______ 。
(2)若图示装置为用惰性电极电解CuSO4溶液的装置,其中阴极上析出Cu的质量为3.2g,常温下,若将电解后的溶液稀释至1L,则溶液中H2SO4的浓度约为_______ 。

(1)若A、B都是惰性电极,电解质溶液c是饱和NaCl溶液,实验开始时,同时在U形管两边各滴入几滴酚酞试剂,试判断:
①a电极是
②A电极产生的气体为
③检验A电极上产物的试剂是:
(2)若图示装置为用惰性电极电解CuSO4溶液的装置,其中阴极上析出Cu的质量为3.2g,常温下,若将电解后的溶液稀释至1L,则溶液中H2SO4的浓度约为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】电化学在化学工业中有着广泛应用。
(1)根据图示电化学装置,回答下列问题:
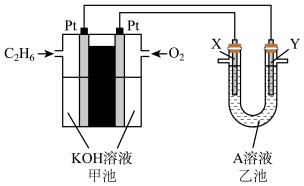
①甲池通入乙烷(C2H6)一极的电极反应式为____ 。
②乙池中,若X、Y都是石墨,A是Na2SO4溶液,实验开始时,同时在两极附近溶液中各滴入几滴紫色石蕊溶液,Y极的电极反应式为____ ;一段时间后,在Y极附近观察到的现象是_____ 。
③乙池中,若X、Y都是石墨,A是足量AgNO3溶液,体积为0.2L,则Y极的电极反应式_____ ;电解一段时间后,甲池消耗11.2mLO2(标准状况下),则乙池溶液的pH为____ (忽略溶液体积的变化)。
(2)若要用该装置在铁质钥匙表面镀一层金属铜,CuSO4溶液作电解液,则乙池中:
①Y极的材料是____ ,电极反应式为____ 。
②X极的材料是____ ,电极反应式为____ 。
(3)工业上通过电解浓NaOH溶液制备Na2FeO4,其工作原理如图所示,则阴极反应式为_____ ,阳极的电极反应式为____ 。

(1)根据图示电化学装置,回答下列问题:

①甲池通入乙烷(C2H6)一极的电极反应式为
②乙池中,若X、Y都是石墨,A是Na2SO4溶液,实验开始时,同时在两极附近溶液中各滴入几滴紫色石蕊溶液,Y极的电极反应式为
③乙池中,若X、Y都是石墨,A是足量AgNO3溶液,体积为0.2L,则Y极的电极反应式
(2)若要用该装置在铁质钥匙表面镀一层金属铜,CuSO4溶液作电解液,则乙池中:
①Y极的材料是
②X极的材料是
(3)工业上通过电解浓NaOH溶液制备Na2FeO4,其工作原理如图所示,则阴极反应式为

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】用惰性电极电解400mL含CuSO40.02mol的硫酸铜溶液。
(1)当外电路通过0.04mol电子时,溶液中c(H+)=__________ mol/L(假设溶液体积不变),阴极产物为________ ,其质量为______ g,阳极产物为__________ ,其在标准状况的体积为________ L,为使溶液恢复原状可向电解后的溶液中加入( )
A. CuO 1.60g B. CuCO3 2.48g C. Cu(OH)2 1.96g D. Cu2(OH)2CO3 4.44g
(2)继续通电电解,当阴阳两极产生的气体体积相等时,外电路共通过了____ mol电子,两极共产生了____ L气体(标况下),溶液中氢离子的物质的量为_____ mol,为使电解液恢复原状,可向电解液中加入( )
A. 0.02molCuO 0.02molH2O B. 0.02molCu(OH)2
C. 0.02molCu2(OH)2CO3 D.0.02molCuCO3、0.02molH2O
(3)若外电路只通过了0.06mol电子,则阴极产生气体在标准状况下的体积为______ L,假设溶液体积不变,则电解液的pH为______ ,为使电解液恢复原状可加入( )
A.CuO1.60g H2O 0.18g B.Cu(OH)2 1.96g
C.Cu2(OH)2CO3 2.22g D.CuCO3 2.48g
(1)当外电路通过0.04mol电子时,溶液中c(H+)=
A. CuO 1.60g B. CuCO3 2.48g C. Cu(OH)2 1.96g D. Cu2(OH)2CO3 4.44g
(2)继续通电电解,当阴阳两极产生的气体体积相等时,外电路共通过了
A. 0.02molCuO 0.02molH2O B. 0.02molCu(OH)2
C. 0.02molCu2(OH)2CO3 D.0.02molCuCO3、0.02molH2O
(3)若外电路只通过了0.06mol电子,则阴极产生气体在标准状况下的体积为
A.CuO1.60g H2O 0.18g B.Cu(OH)2 1.96g
C.Cu2(OH)2CO3 2.22g D.CuCO3 2.48g
您最近一年使用:0次



