用中和滴定法测定某烧碱的纯度,试根据实验回答:
(1)称取4.1g烧碱样品。将样品配成 待测液,需要的主要玻璃仪器除烧杯、玻璃棒、胶头滴管外还需
待测液,需要的主要玻璃仪器除烧杯、玻璃棒、胶头滴管外还需_______ 。
(2)用_______ 量取10.00mL烧碱溶液。
(3)用0.2010mol/L标准盐酸滴定待测烧碱溶液,以酚酞为指示剂,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶中溶液颜色的变化,直到看到_______ 即可判断达到滴定终点。
(4)根据表中数据,计算样品烧碱的质量分数为_______ (结果保留四位有效数字。假设烧碱中不含有与酸反应的杂质)
(5)滴定过程,下列情况会使测定结果偏高的是_______ (填序号)。
①记录起始体积时,仰视读数,终点时俯视;
②碱式滴定管水洗后,就用来量取待测液;
③滴定前,酸式滴定管有气泡,滴定后消失;
④锥形瓶水洗后,又用待测液润洗。
(1)称取4.1g烧碱样品。将样品配成
 待测液,需要的主要玻璃仪器除烧杯、玻璃棒、胶头滴管外还需
待测液,需要的主要玻璃仪器除烧杯、玻璃棒、胶头滴管外还需(2)用
(3)用0.2010mol/L标准盐酸滴定待测烧碱溶液,以酚酞为指示剂,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶中溶液颜色的变化,直到看到
(4)根据表中数据,计算样品烧碱的质量分数为
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 |  | 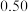 |  |
| 第二次 |  |  |  |
①记录起始体积时,仰视读数,终点时俯视;
②碱式滴定管水洗后,就用来量取待测液;
③滴定前,酸式滴定管有气泡,滴定后消失;
④锥形瓶水洗后,又用待测液润洗。
21-22高二上·天津河东·期末 查看更多[2]
更新时间:2022-09-08 21:29:28
|
【知识点】 酸碱中和滴定的综合考查解读
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】ClO2是一种消毒剂,可以杀死一些病毒。Na2S2O3溶液可用于测定溶液中ClO2的含量,实验方案如下。
步骤1:准确量取ClO2溶液10.00 mL,稀释至100 mL。
步骤2:量取V1 mL稀释后的ClO2溶液于锥形瓶中,调节溶液的pH≤2,加入足量的KI晶体,摇匀,在暗处静置30分钟(已知:ClO2+I-+H+=I2+Cl-+H2O未配平)。
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O =2I-+S4O
=2I-+S4O )。
)。
(1)准确量取10.00 mL ClO2溶液的玻璃仪器是________________ 。
(2)确定滴定终点的现象为_______________________________________________ 。
(3)根据上述步骤计算出原ClO2溶液的物质的量浓度为________________ mol·L-1(用含字母的代数式表示)。
(4)下列操作会导致测定结果偏低的是________________(填字母)。
步骤1:准确量取ClO2溶液10.00 mL,稀释至100 mL。
步骤2:量取V1 mL稀释后的ClO2溶液于锥形瓶中,调节溶液的pH≤2,加入足量的KI晶体,摇匀,在暗处静置30分钟(已知:ClO2+I-+H+=I2+Cl-+H2O未配平)。
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O
 =2I-+S4O
=2I-+S4O )。
)。(1)准确量取10.00 mL ClO2溶液的玻璃仪器是
(2)确定滴定终点的现象为
(3)根据上述步骤计算出原ClO2溶液的物质的量浓度为
(4)下列操作会导致测定结果偏低的是________________(填字母)。
| A.未用标准浓度的Na2S2O3溶液润洗滴定管 |
| B.滴定前锥形瓶中有少量水 |
| C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失 |
| D.读数时,滴定前仰视,滴定后俯视 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。某化学小组根据上述反应原理进行下列实验:
I.测定H2C2O4溶液的物质的量浓度
实验步骤如下:
①取待测H2C2O4溶液25.00mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1mol/L KMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00mL。
请回答:
(1)滴定时,将KMnO4溶液装在_____ (填“酸式”或“碱式”)滴定管中。
(2)若在步骤①操作之前,先用待测H2C2O4溶液润洗锥形瓶,则测得H2C2O4溶液的浓度会_____ (填“偏大”“偏小”或“无影响”)。
(3)步骤②中到达滴定终点时的现象为_____ 。
(4)计算H2C2O4溶液的物质的量浓度为_____ mol/L。
II.探究反应物浓度对化学反应速率的影响设计如下实验方案(实验温度均为25℃):
请回答:
(5)表中v1=_____ ,V2=_____ 。
(6)实验中需要测量的数据是_____ 。
(7)实验中_____ (填“能”或“不能”)用0.2mol/L盐酸代替0.1mol/LH2SO4溶液,理由是_____ 。
I.测定H2C2O4溶液的物质的量浓度
实验步骤如下:
①取待测H2C2O4溶液25.00mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1mol/L KMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00mL。
请回答:
(1)滴定时,将KMnO4溶液装在
(2)若在步骤①操作之前,先用待测H2C2O4溶液润洗锥形瓶,则测得H2C2O4溶液的浓度会
(3)步骤②中到达滴定终点时的现象为
(4)计算H2C2O4溶液的物质的量浓度为
II.探究反应物浓度对化学反应速率的影响设计如下实验方案(实验温度均为25℃):
实验序号 | 体积V/mL | |||
0.1mol•L﹣1KMnO4溶液 | 0.11mol•L﹣1H2C2O4溶液 | 0.11mol•L﹣1H2SO4溶液 | H2O | |
① | 2.0 | 5.0 | 6.0 | 7.0 |
② | 2.0 | 8.0 | 6.0 | V1 |
③ | 2.0 | V2 | 6.0 | 2.0 |
(5)表中v1=
(6)实验中需要测量的数据是
(7)实验中
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】 是中学常用的试剂,在化学实验中有广泛应用。
是中学常用的试剂,在化学实验中有广泛应用。
(1)利用 制备无水氯化铁的方法如图。
制备无水氯化铁的方法如图。

①c制备无水 的原理是
的原理是_______ 。
②b中加入足量 ,产生
,产生 的化学方程式为
的化学方程式为_______ 。
(2)探究 催化分解
催化分解 ,设计如下实验方案:
,设计如下实验方案:
实验结果: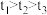 。实验
。实验_______ (填序号)可以探究 对双氧水分解速率的影响。由实验Ⅱ、Ⅲ得出的结论是
对双氧水分解速率的影响。由实验Ⅱ、Ⅲ得出的结论是_______ 。
(3)测定 样品纯度。
样品纯度。
已知: (无色,稳定),
(无色,稳定),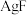 易溶于水且完全电离。
易溶于水且完全电离。
实验步骤如下:
步骤1:取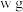 样品配成
样品配成 溶液,准确量取
溶液,准确量取 配制的溶液于锥形瓶中;
配制的溶液于锥形瓶中;
步骤2:向锥形瓶中加入足量的 溶液,用力振荡,再加入
溶液,用力振荡,再加入 溶液(过量)使
溶液(过量)使 完全沉淀;
完全沉淀;
步骤3:向其中加入硝基苯,用力振荡,使沉淀表面被有机物覆盖;
步骤4:加入3滴 溶液,用
溶液,用 溶液滴定过量的
溶液滴定过量的 至终点,消耗
至终点,消耗 溶液的体积为
溶液的体积为 。
。
已知:常温下, ,
, 。
。
①滴定终点的颜色是_______ 。硝基苯的作用是_______ 。
②测得样品中 的质量分数为
的质量分数为_______ 。若滴定前仰视读数,滴定终点俯视读数,则测得的结果_______ (填“偏高”、“偏低”或“无影响”)。
 是中学常用的试剂,在化学实验中有广泛应用。
是中学常用的试剂,在化学实验中有广泛应用。(1)利用
 制备无水氯化铁的方法如图。
制备无水氯化铁的方法如图。
①c制备无水
 的原理是
的原理是②b中加入足量
 ,产生
,产生 的化学方程式为
的化学方程式为(2)探究
 催化分解
催化分解 ,设计如下实验方案:
,设计如下实验方案:| 实验 | 30%双氧水 | 加入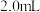 试剂 试剂 | 恒温/℃ | 收集等体积 所用时间/s 所用时间/s |
| Ⅰ | 10.0 | 蒸馏水 | 25 | t1 |
| Ⅱ | 10.0 | 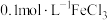 溶液 溶液 | 25 | t2 |
| Ⅲ | 10.0 | 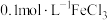 溶液 溶液 | 35 | t3 |
 。实验
。实验 对双氧水分解速率的影响。由实验Ⅱ、Ⅲ得出的结论是
对双氧水分解速率的影响。由实验Ⅱ、Ⅲ得出的结论是(3)测定
 样品纯度。
样品纯度。已知:
 (无色,稳定),
(无色,稳定),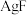 易溶于水且完全电离。
易溶于水且完全电离。实验步骤如下:
步骤1:取
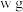 样品配成
样品配成 溶液,准确量取
溶液,准确量取 配制的溶液于锥形瓶中;
配制的溶液于锥形瓶中;步骤2:向锥形瓶中加入足量的
 溶液,用力振荡,再加入
溶液,用力振荡,再加入 溶液(过量)使
溶液(过量)使 完全沉淀;
完全沉淀;步骤3:向其中加入硝基苯,用力振荡,使沉淀表面被有机物覆盖;
步骤4:加入3滴
 溶液,用
溶液,用 溶液滴定过量的
溶液滴定过量的 至终点,消耗
至终点,消耗 溶液的体积为
溶液的体积为 。
。已知:常温下,
 ,
, 。
。①滴定终点的颜色是
②测得样品中
 的质量分数为
的质量分数为
您最近一年使用:0次



