利用盖斯定律书写热化学方程式。
(1)根据已知信息,按要求写出指定反应的热化学方程式:
(1)LiH可作飞船的燃料,已知下列反应:
①2Li(s)+H2(g)=2LiH(s) ΔH=-182kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH=-572kJ·mol-1
③4Li(s)+O2(g)=2Li2O(s) ΔH=-1196kJ·mol-1
试写出LiH在O2中燃烧的热化学方程式_______ 。
(2)CH4—CO2催化重整反应为CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-394kJ·mol-1
C(s)+ O2(g)=CO(g) ΔH=-111kJ·mol-1
O2(g)=CO(g) ΔH=-111kJ·mol-1
该催化重整反应的ΔH=_______ kJ·mol-1。
(3)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(I)和系统(II)制氢的热化学方程式分别为_______ 、_______ ,制得等量H2所需能量较少的是_______ 。
(4)已知下列反应:
SO2(g)+2OH—(aq)= (aq)+H2O(l) ΔH1
(aq)+H2O(l) ΔH1
ClO—(aq)+ (aq)=
(aq)= (aq)+Cl—(aq) ΔH2
(aq)+Cl—(aq) ΔH2
CaSO4(s)=Ca2+(aq)+ (aq) ΔH3
(aq) ΔH3
则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH—(aq)=CaSO4(s)+H2O(l)+Cl—(aq)的ΔH=_______ 。
(1)根据已知信息,按要求写出指定反应的热化学方程式:
(1)LiH可作飞船的燃料,已知下列反应:
①2Li(s)+H2(g)=2LiH(s) ΔH=-182kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH=-572kJ·mol-1
③4Li(s)+O2(g)=2Li2O(s) ΔH=-1196kJ·mol-1
试写出LiH在O2中燃烧的热化学方程式
(2)CH4—CO2催化重整反应为CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-394kJ·mol-1
C(s)+
 O2(g)=CO(g) ΔH=-111kJ·mol-1
O2(g)=CO(g) ΔH=-111kJ·mol-1该催化重整反应的ΔH=
(3)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(I)和系统(II)制氢的热化学方程式分别为
(4)已知下列反应:
SO2(g)+2OH—(aq)=
 (aq)+H2O(l) ΔH1
(aq)+H2O(l) ΔH1ClO—(aq)+
 (aq)=
(aq)= (aq)+Cl—(aq) ΔH2
(aq)+Cl—(aq) ΔH2CaSO4(s)=Ca2+(aq)+
 (aq) ΔH3
(aq) ΔH3则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH—(aq)=CaSO4(s)+H2O(l)+Cl—(aq)的ΔH=
更新时间:2022-09-10 10:43:54
|
【知识点】 盖斯定律及其有关计算
相似题推荐
计算题
|
适中
(0.65)
名校
【推荐1】化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。
(1)键能也可以用于估算化学反应的反应热(ΔH)下表是部分化学键的键能数据:
已知白磷的燃烧热为2378.0 kJ/mol,白磷完全燃烧的产物结构如图所示,则上表中X=________ 。

(2)1840年,俄国化学家盖斯在分析了许多化学反应热效应的基础上,总结出一条规律:“一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的.”这个规律被称为盖斯定律.有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。
①已知:
C(石墨)+O2(g)===CO2(g) ΔH1=-393.5 kJ/mol①
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6 kJ/mol②
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2599.2 kJ/mol③
则由C(石墨)和H2(g)反应生成1 mol C2H2(g)的焓变为__________________ 。
②已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出x kJ热量。已知单质碳的燃烧热为y kJ/mol,则1 mol C与O2反应生成CO的反应热ΔH为______________ 。
(1)键能也可以用于估算化学反应的反应热(ΔH)下表是部分化学键的键能数据:
| 化学键 | P—P | P—O | O=O | P=O |
| 键能/(kJ·mol-1) | 172 | 335 | 498 | X |
已知白磷的燃烧热为2378.0 kJ/mol,白磷完全燃烧的产物结构如图所示,则上表中X=

(2)1840年,俄国化学家盖斯在分析了许多化学反应热效应的基础上,总结出一条规律:“一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的.”这个规律被称为盖斯定律.有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。
①已知:
C(石墨)+O2(g)===CO2(g) ΔH1=-393.5 kJ/mol①
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6 kJ/mol②
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2599.2 kJ/mol③
则由C(石墨)和H2(g)反应生成1 mol C2H2(g)的焓变为
②已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出x kJ热量。已知单质碳的燃烧热为y kJ/mol,则1 mol C与O2反应生成CO的反应热ΔH为
您最近半年使用:0次
【推荐2】化学反应过程伴随有热量的变化。
(1)在尿素合成塔中的主要反应可表示如下:
反应I:
反应Ⅱ: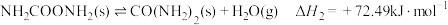
总反应: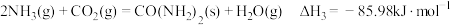
则反应I的
___________  。
。
(2)利用CH4可制备乙烯及合成气(CO、H2)。
①有关化学键键能(E)的数据如下表:
则

___________ 。(用a、b、c、d表示)
②制备合成气反应历程分两步(步骤I、步骤Ⅱ,反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:
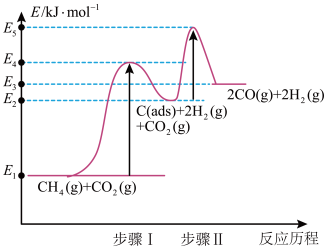
步骤1反应的焓变 为
为___________ kJ/mol(选用E1~E5的关系式表示)。
③反应 的焓变为
的焓变为 ,与步骤1焓变
,与步骤1焓变 相比,
相比,
___________  (填“>”或“<)。
(填“>”或“<)。
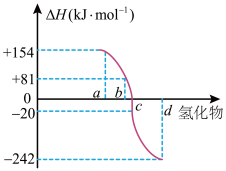
(3)一定条件下,由稳定单质反应生成1mol化合物的反应热叫该化合物的生成热( )。下图为VIA族元素(O、S、Se、Te)氢化物a、b、c、d的生成热数据示意图。已知非金属元素气态氢化物的稳定性越强,其氢化物的生成热
)。下图为VIA族元素(O、S、Se、Te)氢化物a、b、c、d的生成热数据示意图。已知非金属元素气态氢化物的稳定性越强,其氢化物的生成热 越小。硫化氢发生分解反应的热化学方程式为
越小。硫化氢发生分解反应的热化学方程式为___________ 。
(1)在尿素合成塔中的主要反应可表示如下:
反应I:

反应Ⅱ:
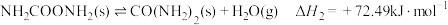
总反应:
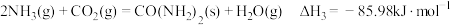
则反应I的

 。
。(2)利用CH4可制备乙烯及合成气(CO、H2)。
①有关化学键键能(E)的数据如下表:
| 化学键 | H—H | C=C | C—C | C—H |
| E(kJ/mol) | a | b | c | d |


②制备合成气反应历程分两步(步骤I、步骤Ⅱ,反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:

步骤1反应的焓变
 为
为③反应
 的焓变为
的焓变为 ,与步骤1焓变
,与步骤1焓变 相比,
相比,
 (填“>”或“<)。
(填“>”或“<)。(3)一定条件下,由稳定单质反应生成1mol化合物的反应热叫该化合物的生成热(
 )。下图为VIA族元素(O、S、Se、Te)氢化物a、b、c、d的生成热数据示意图。已知非金属元素气态氢化物的稳定性越强,其氢化物的生成热
)。下图为VIA族元素(O、S、Se、Te)氢化物a、b、c、d的生成热数据示意图。已知非金属元素气态氢化物的稳定性越强,其氢化物的生成热 越小。硫化氢发生分解反应的热化学方程式为
越小。硫化氢发生分解反应的热化学方程式为
您最近半年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐3】氮是地球上含量丰富的一种元素,氨及其化合物在工农业生产、生活中有着重要作用。
(1)如图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量的变化示意图,正反应的活化能为_______ kJ/mol。
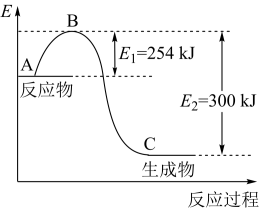
(2)请写出N2和H2反应的热化学方程式:_______ 。
(3)试根据表中及图中数据计算N-H的键能:_______ kJ/mol。
(4)用NH3催化还原NOx还可以消除氮氧化物的污染。已知:
4NH3(g)+3O2(g)=2N2+6H2O(g)∆H=-a kJ/mol ①
N2(g)+O2(g)=2NO(g) ∆H=b kJ/mol②
求:若1molNH3还原NO至N2,则该反应过程中的反应热∆H=_______ kJ/mol(用含a、b的式子表示)。
(1)如图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量的变化示意图,正反应的活化能为

(2)请写出N2和H2反应的热化学方程式:
(3)试根据表中及图中数据计算N-H的键能:
| 化学键 | H-H | N≡N |
| 键能(kJ/mol) | 435 | 943 |
(4)用NH3催化还原NOx还可以消除氮氧化物的污染。已知:
4NH3(g)+3O2(g)=2N2+6H2O(g)∆H=-a kJ/mol ①
N2(g)+O2(g)=2NO(g) ∆H=b kJ/mol②
求:若1molNH3还原NO至N2,则该反应过程中的反应热∆H=
您最近半年使用:0次



