(1)金刚石晶体

①在一个晶胞中,碳原子位于立方体的8个顶点、6个面心以及晶胞内部,由“均摊法”可求出该晶胞中实际含有的碳原子数为
②晶体中C-C-C夹角为
(2)二氧化硅晶体(如图):
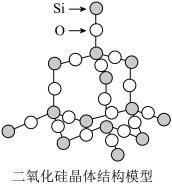
晶体中Si原子与O原子个数比为
(3)Si原子与H原子结合时,Si呈正化合价,则电负性:Si
A.是一种活泼的金属元素
B.其电负性大于硫
C.其单质可作为半导体材料
D.其气态氢化物的稳定性低于硅的气态氢化物
(4)A、B、C、D为四种晶体,依据下列晶体性质推断属于离子晶体的是_______。
| A.固态时能导电,能溶于盐酸 |
| B.固态时不导电,液态时能导电,可溶于水 |
| C.能溶于苯,不溶于水 |
| D.固态、液态时均不导电,熔点为3500℃ |
相似题推荐
(1)LiAlH4的焰色反应为紫红色,这与Li原子核外电子发生跃迁
(2)离子半径:r(Li+)
(3)LiAlH4中各元素电负性由大到小的顺序是
(4)Li与Al各级的电离能如表:
| 电离能/(kJ·mol-1) 元素 | I1 | I2 | I3 |
| Li | 520 | 7298 | 11815 |
| Al | 578 | 1817 | 2745 |
【推荐2】根据信息回答下列问题:
(1)如图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
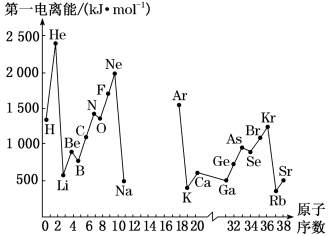
①认真分析图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小范围为
②图中Ge元素中未成对电子有
(2)已知元素的电负性和元素的化合价一样,也是元素的一种基本性质。下面给出部分元素的电负性:
元素 | Al | B | Be | C | Cl | F | Li |
电负性 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 | |
元素 | Mg | N | Na | O | P | S | Si |
电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
已知:两成键元素间电负性差值大于1.7时,形成离子键,两成键元素间电负性差值小于1.7时,形成共价键。
①根据表中给出的数据,可推知元素的电负性具有的变化规律
②通过分析电负性值变化规律,确定Al元素电负性值的最小范围
③判断下列物质是离子化合物还是共价化合物:
A Li3N B PCl3 C MgCl2 D SiC
Ⅰ.属于离子化合物的是
Ⅱ.属于共价化合物的是
请设计一个实验方案证明上述所得到的结论
已知:①CuCl可以由CuCl2用适当的还原剂如SO2,SnCl2等还原制得:
2Cu2++2Cl-+SO2+2H2O
 2CuCl↓+4H++SO42-
2CuCl↓+4H++SO42-2CuCl2+SnCl2=2CuCl↓+SnCl4
②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子:

请回答下列问题:
(1)基态Cu原子的核外电子排布式为
(2)SO2分子的空间构型为
(3)乙二胺分子中氮原子轨道的杂化类型为
(4)②中所形成的配离子中含有的化学键类型有
A.配位键 B.极性键 C.离子键 D.非极性键
(1)属于原子晶体的是
(2)既含有离子键又含有共价键的是
(3)熔化时需要克服离子键的是
①CH3CH2OH和CH3OCH3 ②D和T ③H2O和H2O2 ④干冰和CO2 ⑤白磷和红磷
(2)有下列六种晶体:A.金刚石 B.冰 C.氧化钠 D.氯化铵 E.铁 F.二氧化硅
①属于原子晶体的化合物是
②由分子构成的晶体是
(2)指出下列物质的晶体类型;冰
(3)有下列各组物质:
①
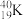 与
与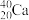 ; ②
; ② 与
与 ;③
;③ 与
与 ;
;④
 与
与 ;⑤
;⑤ 与
与 。
。互为同位素的是
(4)下列过程通过化学变化不能实现的是
①一种核素变成另一种核素; ②一种离子变成另—种离子;
③一种分子变成另一种分子; ④一种单质变成另一种单质;
⑤混合物变成纯净物; ⑥有毒、有污染的物质转化成无毒、无污染的物质;
⑦共价化合物转化成离子化合物。
(5)在下列变化中:
①
 升华;②烧碱熔化;③NaCl溶于水;④
升华;②烧碱熔化;③NaCl溶于水;④ 分解;⑤
分解;⑤ 溶于水;⑥
溶于水;⑥ 与水反应。
与水反应。未破坏化学键的是
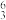 Li ②石墨 ③C60 ④
Li ②石墨 ③C60 ④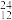 Mg ⑤ CH3CH2OH ⑥
Mg ⑤ CH3CH2OH ⑥ C ⑦
C ⑦ Li ⑧ CH3OCH3 中:
Li ⑧ CH3OCH3 中:(2)现有①CaCl2 ②金刚石 ③NH4Cl ④Na2SO4 ⑤冰 等五种物质,按下列要求回答:
①熔化时不需要破坏化学键的是
②只含有离子键的物质是
(3)写出下列物质的电子式
①H2O
②NaOH
③NH3
(1)四种晶体的熔点数据如表:
| 物质 | CF4 | SiF4 | BF3 | AlF3 |
| 熔点/℃ | -183 | -90 | -127 | >1000 |
(2)实验证明,金刚石、硅、锗的熔点和硬度依次下降,主要原因是
(3)实验证明,接近水的沸点的水蒸气的相对分子质量测定值比按化学式H2O计算出来的相对分子质量大一些,主要原因是
(1)两种有机物的相关数据如表:
| 物质 | HCON(CH3)2 | HCONH2 |
| 相对分子质量 | 73 | 45 |
| 沸点/℃ | 153 | 220 |
HCON(CH3)2的相对分子质量比HCONH2的大,但其沸点反而比HCONH2的低,主要原因是
(2)四种晶体的熔点数据如表:
| 物质 | CF4 | SiF4 | BF3 | AlF3 |
| 熔点/℃ | -183 | -90 | -127 | >1000 |
CF4和SiF4熔点相差较小,BF3和AlF3熔点相差较大,原因是
(3)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是
(4)气态三氧化硫以单分子形式存在,其分子的空间结构为

| 金刚石 | 碳化硅 | 晶体硅 | |
| 熔点/℃ | >3550 | 2600 | 1415 |
(2)提纯含有少量氯化钠的甘氨酸样品:将样品溶于水,调节溶液的pH使甘氨酸结晶析出,可实现甘氨酸的提纯。其理由是
(1)氮的常见氢化物有NH3和N2H4,纯净的N2H4为无色油状液体,除相对分子质量的影响外,其熔沸点明显高于氨气的原因为
(2)硼氢化钠(NaBH4)各原子均满足稳定结构,其电子式为
(3)有科学家在实验室条件下将干冰制成了原子晶体。则同是原子晶体的CO2和SiO2硬度大小关系:CO2



