根据以下9种元素在元素周期表中的位置,回答下列问题:
(1)①的原子轨道形状是_______ ;②③④的第一电离能由大到小的顺序是_______ (填编号)。
(2)下列可以判断⑤和⑥金属性强弱的是_______ (填序号)。
a.单质的熔点:⑤<⑥ b.化合价:⑤<⑥
c.单质与水反应的剧烈程度:⑤>⑥ d.最高价氧化物对应水化物的碱性:⑤>⑥
(3)③与⑦形成的化合物是一种性能优异的无机非金属材料,据元素周期律知识,写出其化学式_______ ,它的熔点高,硬度大,电绝缘性好,化学性质稳定。它的晶体类型是_______ ,试推测其可能有哪些用途_______ (填序号)。
a.制作坩埚 b.制作切削刀具 c.制作耐高温轴承
(4)⑧与⑨可形成原子个数比为1:1的共价化合物,分子中各原子最外层均达到8电子稳定结构,试写出其结构式_______ 。
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(2)下列可以判断⑤和⑥金属性强弱的是
a.单质的熔点:⑤<⑥ b.化合价:⑤<⑥
c.单质与水反应的剧烈程度:⑤>⑥ d.最高价氧化物对应水化物的碱性:⑤>⑥
(3)③与⑦形成的化合物是一种性能优异的无机非金属材料,据元素周期律知识,写出其化学式
a.制作坩埚 b.制作切削刀具 c.制作耐高温轴承
(4)⑧与⑨可形成原子个数比为1:1的共价化合物,分子中各原子最外层均达到8电子稳定结构,试写出其结构式
更新时间:2022-10-29 16:52:06
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最多的金属元素;D原子核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E原子的核外电子排布式为______ ,A、B、C、D的第一电离能最小的是______
(2)B的氧化物的熔点远高于D的氧化物的熔点,理由是______
(3)A的最高价含氧酸根离子中,其中心原子是______ 杂化,D的低价氧化物的空间构型为______
(4)A、C形成某种化合物的晶胞结构如图所示,则其化学式为______

(5)E单质的晶体的晶胞结构如图。若E原子的半径是r cm,则E单质的密度的计算公式是______ (用NA表示阿伏加德罗常数)

(1)E原子的核外电子排布式为
(2)B的氧化物的熔点远高于D的氧化物的熔点,理由是
(3)A的最高价含氧酸根离子中,其中心原子是
(4)A、C形成某种化合物的晶胞结构如图所示,则其化学式为

(5)E单质的晶体的晶胞结构如图。若E原子的半径是r cm,则E单质的密度的计算公式是

您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】回答下列问题
(1)四种元素的原子半径如下表:
由此可推理:决定原子半径大小的因素有_______
(2) 和
和 都是化工生产中的重要物质。
都是化工生产中的重要物质。
① 的沸点(-33.5℃)高于
的沸点(-33.5℃)高于 的沸点(-129℃)的主要原因是
的沸点(-129℃)的主要原因是_______
② 的一种下游产品三聚氟氰(分子式为:
的一种下游产品三聚氟氰(分子式为: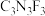 ),分子结构中显示有环状结构,请从价键理论和物质的相对稳定性角度写出三聚氟氰的结构式
),分子结构中显示有环状结构,请从价键理论和物质的相对稳定性角度写出三聚氟氰的结构式_______ 。
(1)四种元素的原子半径如下表:
| 元素符号 | Li | Be | Na | S | Cl |
| 原子半径/pm | 152 | 89 | 186 | 102 | 99 |
由此可推理:决定原子半径大小的因素有
(2)
 和
和 都是化工生产中的重要物质。
都是化工生产中的重要物质。①
 的沸点(-33.5℃)高于
的沸点(-33.5℃)高于 的沸点(-129℃)的主要原因是
的沸点(-129℃)的主要原因是②
 的一种下游产品三聚氟氰(分子式为:
的一种下游产品三聚氟氰(分子式为: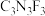 ),分子结构中显示有环状结构,请从价键理论和物质的相对稳定性角度写出三聚氟氰的结构式
),分子结构中显示有环状结构,请从价键理论和物质的相对稳定性角度写出三聚氟氰的结构式
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】砷化镓(GaAs)是优良的半导体材料或用于制作微型激光器或太阳能电池的材料等。部分元素在周期表中位置如下:
回答下列问题:
(1)六种元素中,非金属性最强的元素是:________ .写出As原子的最外层的电子排布式_________ ,As原子核外有_____ 个未成对电子。
(2)根据元素周期律,可判断原子半径Ga_____ As。(选填“>”、 “<”或“=”)。写出铝的最高价氧化物对应水化物的电离方程式:________________
(3)NH3 的分子构型是_______ 。GaF3的熔点高于1000°C,GaCl3的熔点为77.9°C,可能的原因是_______ .写出C2H2的电子式为:_________
(4)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因___________
| A1 | Si | P |
| Ga | Ge | As |
回答下列问题:
(1)六种元素中,非金属性最强的元素是:
(2)根据元素周期律,可判断原子半径Ga
(3)NH3 的分子构型是
(4)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/°C | -49.5 | 26 | 146 |
| 沸点/°C | 83.1 | 186 | 约400 |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】下表是元素周期表的一部分,根据表中的①~⑩种元素,按要求填写下列空白:
(1)在这些元素中,化学性质最不活泼元素的原子结构示意图为___________ 。
(2)①用于考古的一种核素符号为___________ 。①和⑦简单氢化物稳定性较差的是___________ (填化学式)。
(3)元素②和⑥对应的离子半径较小的是___________ (填离子符号)。⑤和⑧最高价氧化物对应水化物酸性较强的是___________ (填化学式)。④和⑥最高价氧化物对应水化物碱性较弱的是___________ (填化学式)。
(4)写出②与④形成原子个数为1:2的化合物的电子式___________ 。
(5)下列关于⑩元素硒(Se)说法推断正确的是___________(填标号)。
(6)④和⑥最高价氧化物对应水化物相互反应的离子方程式为___________ 。
| 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ① | ② | ||||||
| 3 | ④ | ⑥ | ⑦ | ⑤ | ⑧ | ⑨ | ||
| 4 | ③ | ⑩ |
(2)①用于考古的一种核素符号为
(3)元素②和⑥对应的离子半径较小的是
(4)写出②与④形成原子个数为1:2的化合物的电子式
(5)下列关于⑩元素硒(Se)说法推断正确的是___________(填标号)。
A. 属于共价化合物,只具有还原性 属于共价化合物,只具有还原性 |
B.Se的最低负化合价是负2价;但 中Se化合价为+4 中Se化合价为+4 |
| C.Se元素非金属性比⑤强 |
| D.Se元素原子半径小于③ |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】元素周期表反映元素之间的内在联系,是研究物质性质的重要工具。如表是元素周期表的一部分,请回答下列问题:
(1)元素②、③、⑥的简单离子半径由大到小的排序为___________ (填离子符号)。
(2)②和④组成的物质中含有___________ 键,可以证明该化合物含有此类型化学键的实验事实为___________ 。
(3)⑤的氧化物和⑥的最高价氧化物对应的水化物反应的离子方程式为___________ 。
(4)已知④的单质与①的最高价氧化物A在点燃条件下能反应生成黑色单质,推测③的单质___________ (填“能”或“不能”)与A反应,说明推测的理由___________ 。
| 周期 | IA | 0 | |||||||
| 1 | IIA | … | IIIA | IVA | VA | VIA | VIIA | ||
| 2 | ① | ② | |||||||
| 3 | ③ | ④ | ⑤ | ⑥ | |||||
(2)②和④组成的物质中含有
(3)⑤的氧化物和⑥的最高价氧化物对应的水化物反应的离子方程式为
(4)已知④的单质与①的最高价氧化物A在点燃条件下能反应生成黑色单质,推测③的单质
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】下表列出了①~⑩10种元素在周期表中的位置。
(1)上述元素中,最不活泼的是(填元素符号,下同)________ ,金属性最强的是________ ,③④⑤三种元素的原子半径由大到小的顺序是________ 。
(2)上述元素的最高价氧化物对应的水化物中酸性最强的是________ (填化学式,下同),呈两性的氢氧化物是________ 。
(3)元素⑥的氢化物的电子式为________ ,该氢化物与元素⑥的最高价氧化物对应的水化物反应的化学方程式为___________ 。
(4)比较⑥和⑦氢化物的稳定性由强到弱的顺序是_______ (填化学式)。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ⑩ | |||||
| 3 | ① | ③ | ④ | ⑦ | ⑧ | |||
| 4 | ② | ⑨ |
(1)上述元素中,最不活泼的是(填元素符号,下同)
(2)上述元素的最高价氧化物对应的水化物中酸性最强的是
(3)元素⑥的氢化物的电子式为
(4)比较⑥和⑦氢化物的稳定性由强到弱的顺序是
您最近一年使用:0次



