Ⅰ.已知在氨水中存在下平衡:NH3+H2O NH3·H2O
NH3·H2O NH
NH +OH-。
+OH-。
(1)向氨水中加入 固体时,平衡向
固体时,平衡向_______ (填“左”或“右”)移动,OH-的浓度_______ (填“增大”或“减小”,下同), 的浓度
的浓度_______ 。
(2)向氨水中加入浓盐酸,平衡向_______ (填“左”或“右”)移动,此时溶液中浓度减小的微粒有_______ 。
(3)向氨水中加入少量的NaOH固体,平衡向_______ (填“左”或“右”)移动。
Ⅱ.地下水中的氮污染主要是由 引起的,人们对
引起的,人们对 的转化进行了长时间的研究,目前主要有物理方法、化学方法和生物方法,其中化学方法主要包含活泼金属还原法和催化反硝化法。催化反硝化法是一种经济可行的脱氮方法,其原理是在Pd/Cu双金属催化剂作用下,
的转化进行了长时间的研究,目前主要有物理方法、化学方法和生物方法,其中化学方法主要包含活泼金属还原法和催化反硝化法。催化反硝化法是一种经济可行的脱氮方法,其原理是在Pd/Cu双金属催化剂作用下, 将硝酸盐还原成氮气:2NO
将硝酸盐还原成氮气:2NO +5H2
+5H2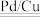 N2↑+2OH-+4H2O。
N2↑+2OH-+4H2O。
(4)下列说法错误的是_______ (填序号)。
A.氮肥 溶于水的过程中熵值增大
溶于水的过程中熵值增大
B.在酸性条件下,活泼金属与 反应属于自发反应
反应属于自发反应
C.Pd/Cu双金属催化剂是该反应是否能自发发生的决定因素
(5)已知:2NO +5H2
+5H2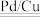 N2↑+2OH-+4H2O的
N2↑+2OH-+4H2O的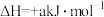 ,
,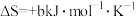 (a、b均为正值),该反应
(a、b均为正值),该反应_______ (填“能”“不能”或“无法判断是否能”)自发进行。
 NH3·H2O
NH3·H2O NH
NH +OH-。
+OH-。(1)向氨水中加入
 固体时,平衡向
固体时,平衡向 的浓度
的浓度(2)向氨水中加入浓盐酸,平衡向
(3)向氨水中加入少量的NaOH固体,平衡向
Ⅱ.地下水中的氮污染主要是由
 引起的,人们对
引起的,人们对 的转化进行了长时间的研究,目前主要有物理方法、化学方法和生物方法,其中化学方法主要包含活泼金属还原法和催化反硝化法。催化反硝化法是一种经济可行的脱氮方法,其原理是在Pd/Cu双金属催化剂作用下,
的转化进行了长时间的研究,目前主要有物理方法、化学方法和生物方法,其中化学方法主要包含活泼金属还原法和催化反硝化法。催化反硝化法是一种经济可行的脱氮方法,其原理是在Pd/Cu双金属催化剂作用下, 将硝酸盐还原成氮气:2NO
将硝酸盐还原成氮气:2NO +5H2
+5H2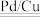 N2↑+2OH-+4H2O。
N2↑+2OH-+4H2O。(4)下列说法错误的是
A.氮肥
 溶于水的过程中熵值增大
溶于水的过程中熵值增大B.在酸性条件下,活泼金属与
 反应属于自发反应
反应属于自发反应C.Pd/Cu双金属催化剂是该反应是否能自发发生的决定因素
(5)已知:2NO
 +5H2
+5H2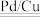 N2↑+2OH-+4H2O的
N2↑+2OH-+4H2O的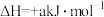 ,
,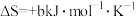 (a、b均为正值),该反应
(a、b均为正值),该反应
更新时间:2022-11-07 23:22:01
|
相似题推荐
【推荐1】以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.3 kJ·mol-1。 该反应在常温下
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1。 该反应在常温下________ (填“能”或“不能”)自发进行。
(2)将不同量的CO(g)和H2O(g)分别通入体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
该反应的正反应为________ (填“吸”或“放”)热反应,实验2条件下平衡常数K=________ 。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,达到平衡后下列措施中能使c(CH3OH)增大的是
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,达到平衡后下列措施中能使c(CH3OH)增大的是________ 。

a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1 mol CO2和3 mol H2
(1)将水蒸气通过红热的炭即可产生水煤气。反应为C(s)+H2O(g)
 CO(g)+H2(g) ΔH=+131.3 kJ·mol-1。 该反应在常温下
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1。 该反应在常温下(2)将不同量的CO(g)和H2O(g)分别通入体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)
 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,达到平衡后下列措施中能使c(CH3OH)增大的是
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,达到平衡后下列措施中能使c(CH3OH)增大的是
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1 mol CO2和3 mol H2
您最近一年使用:0次
【推荐2】将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g),实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g),实验测得不同温度下的平衡数据列于下表:
(1)可以判断该分解反应已经达到化学平衡的是____________ (填字母序号)。
A. (NH3)=2
(NH3)=2 (CO2) B.密闭容器中总压强不变
(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变D.密闭容器气体的平均摩尔质量不变
(2)根据表中数据,列式计算25.0℃时的分解平衡常数____________ 。
(3)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡。若在恒温下压缩容器体积,平衡时氨气的浓度____________ (填“增加”、“减小”或“不变”)。
(4)氨基甲酸铵分解反应的焓变△H____________ 0,熵变△S____________ 0(填“>”、“=”或“<”)该反应在____________ 条件下有利于其自发进行。
 2NH3(g)+CO2(g),实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g),实验测得不同温度下的平衡数据列于下表:| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
(1)可以判断该分解反应已经达到化学平衡的是
A.
 (NH3)=2
(NH3)=2 (CO2) B.密闭容器中总压强不变
(CO2) B.密闭容器中总压强不变C.密闭容器中混合气体的密度不变D.密闭容器气体的平均摩尔质量不变
(2)根据表中数据,列式计算25.0℃时的分解平衡常数
(3)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡。若在恒温下压缩容器体积,平衡时氨气的浓度
(4)氨基甲酸铵分解反应的焓变△H
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】尿素(NH2CONH2)又称碳酰胺,是含氮量最高的氮肥。工业上利用二氧化碳和氨气在一定条件下合成尿素,涉及的反应如下:
反应I:2NH3(g)+ CO2(g) H2NCOONH4(s)(氨基甲酸铵) ΔH1 = -272kJ·mol-1
H2NCOONH4(s)(氨基甲酸铵) ΔH1 = -272kJ·mol-1
反应II:H2NCOONH4(s) NH2CONH2(s)+ H2O(g) ΔH2 = +138kJ·mol-1
NH2CONH2(s)+ H2O(g) ΔH2 = +138kJ·mol-1
请回答:
(1)写出二氧化碳和氨气合成尿素的总热化学方程式_______ ,该反应自发进行的条件是_______ (填“低温”、“高温”或“任意条件”)。
(2)尿素(NH2CONH2)是一种重要的化工产品,有很多用途。化工生产中利用尿素溶液可吸收尾气中的氯气,生成两种无污染气体,其中一种气体是空气的主要成分,且溶液pH明显降低,该反应的化学方程式_______ 。
(3)合成氨工业先驱哈伯(P·Haber)利用N2和H2在Fe催化作用下最早人工合成氨气,该反应为: N2(g)+ 3H2(g) 2NH3(g) ΔH = -92.4 kJ·mol-1
2NH3(g) ΔH = -92.4 kJ·mol-1
①写出该反应的平衡常数表达式K =_______ 。
②关于合成氨工艺的下列理解,正确的是_______ 。
A.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
B.降低温度能使平衡向正反应方向进行且平衡常数不变
C.合成氨反应在不同温度下的ΔH和ΔS都小于零
D.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发生
反应I:2NH3(g)+ CO2(g)
 H2NCOONH4(s)(氨基甲酸铵) ΔH1 = -272kJ·mol-1
H2NCOONH4(s)(氨基甲酸铵) ΔH1 = -272kJ·mol-1反应II:H2NCOONH4(s)
 NH2CONH2(s)+ H2O(g) ΔH2 = +138kJ·mol-1
NH2CONH2(s)+ H2O(g) ΔH2 = +138kJ·mol-1请回答:
(1)写出二氧化碳和氨气合成尿素的总热化学方程式
(2)尿素(NH2CONH2)是一种重要的化工产品,有很多用途。化工生产中利用尿素溶液可吸收尾气中的氯气,生成两种无污染气体,其中一种气体是空气的主要成分,且溶液pH明显降低,该反应的化学方程式
(3)合成氨工业先驱哈伯(P·Haber)利用N2和H2在Fe催化作用下最早人工合成氨气,该反应为: N2(g)+ 3H2(g)
 2NH3(g) ΔH = -92.4 kJ·mol-1
2NH3(g) ΔH = -92.4 kJ·mol-1①写出该反应的平衡常数表达式K =
②关于合成氨工艺的下列理解,正确的是
A.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
B.降低温度能使平衡向正反应方向进行且平衡常数不变
C.合成氨反应在不同温度下的ΔH和ΔS都小于零
D.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发生
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】I、 (1)25℃时,有浓度均为0.1 mol·L-1的6种溶液:①HCl, ②CH3OOH, ③Ba(OH)2,④Na 2CO3,⑤KCl,⑥NH4Cl溶液pH由小到大的顺序为__________________ (填写编号)。
(2)25℃时,pH=5的CH3COOH溶液中,由水电离出的C(H+)=_____ mol/L;往溶液中加入少量NaOH固体(不考虑温度变化),则溶液中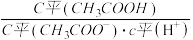
________ (填“增大”、“减小”或“不变”)。
II、某实验小组拟用pH试纸验证醋酸是弱酸。甲、乙两同学的方案分别是
甲:①准确配制0.1mol·L-1的醋酸钠溶液100mL;
②用pH试纸测出该溶液的pH,即可证明醋酸是弱酸。
乙:①量取一定量的冰醋酸准确配制pH=1的醋酸溶液100mL;
②取醋酸溶液1mL,加水稀释为10 mL;
③用pH试纸测出②中溶液的pH,即可证明醋酸是弱酸。
(1)甲方案中,说明醋酸是弱酸的理由是测得醋酸钠溶液的pH________ 7(选填“<”“>”或“=”,下同),乙方案中,说明醋酸是弱酸的理由是测得醋酸溶液的pH________ 2。
(2)请你结合所学知识再列举一种方法证明醋酸是弱酸:_______________________________________________________
(2)25℃时,pH=5的CH3COOH溶液中,由水电离出的C(H+)=
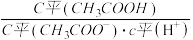
II、某实验小组拟用pH试纸验证醋酸是弱酸。甲、乙两同学的方案分别是
甲:①准确配制0.1mol·L-1的醋酸钠溶液100mL;
②用pH试纸测出该溶液的pH,即可证明醋酸是弱酸。
乙:①量取一定量的冰醋酸准确配制pH=1的醋酸溶液100mL;
②取醋酸溶液1mL,加水稀释为10 mL;
③用pH试纸测出②中溶液的pH,即可证明醋酸是弱酸。
(1)甲方案中,说明醋酸是弱酸的理由是测得醋酸钠溶液的pH
(2)请你结合所学知识再列举一种方法证明醋酸是弱酸:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】①在25 ℃条件下将pH=12的氨水稀释过程中,下列关系式正确的是________ 。
A.能使溶液中c(NH4+)·c(OH-)增大
B.溶液中c(H+)·c(OH-)不变
C.能使溶液中 比值增大
比值增大
D.此过程中Kw增大
②在25℃条件下将pH=12的氨水稀释100倍后溶液的pH为________ (填序号)。
A.10 B.11 C.10~12 D.11~13
(2)25℃时,向0.1mol·L-1的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是________ (填序号)。
①氨水与氯化铵发生化学反应
②氯化铵溶液水解显酸性,增加了c(H+)
③氯化铵溶于水,电离出大量铵离子,抑制了一水合氨的电离,使c(OH-)减小
(3)室温下,如果将0.2mol NH4Cl和0.1mol NaOH全部溶于水,形成混合溶液(假设无损失)。
①________ 和________ 两种粒子的物质的量之和等于0.2mol。
②________ 和________ 两种粒子的物质的量之和比OH-多0.1mol。
A.能使溶液中c(NH4+)·c(OH-)增大
B.溶液中c(H+)·c(OH-)不变
C.能使溶液中
 比值增大
比值增大D.此过程中Kw增大
②在25℃条件下将pH=12的氨水稀释100倍后溶液的pH为
A.10 B.11 C.10~12 D.11~13
(2)25℃时,向0.1mol·L-1的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是
①氨水与氯化铵发生化学反应
②氯化铵溶液水解显酸性,增加了c(H+)
③氯化铵溶于水,电离出大量铵离子,抑制了一水合氨的电离,使c(OH-)减小
(3)室温下,如果将0.2mol NH4Cl和0.1mol NaOH全部溶于水,形成混合溶液(假设无损失)。
①
②
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】常压下,取不同浓度、不同温度的氨水测定,得到下表实验数据。
提示:
(1)温度升高,NH3·H2O的电离平衡向________ (填“左”或“右”)移动,能支持该结论的表中数据是________ (填字母)。
a.电离常数 b.电离度 c.c(OH-) d.c(NH3·H2O)
(2)表中c(OH-)基本不变的原因是__________________________________ 。
(3)常温下,在氨水中加入一定量的氯化铵晶体,下列说法错误的是_______ (填字母,下同)。
A.溶液的pH增大 B.氨水的电离度减小 C.c(OH-)减小 D.c(NH4+)减小
(4)氨水溶液中,下列做法能使c(NH4+)与c(OH-)比值变大的是________ 。
A.加入固体氯化铵 B.通入少量氯化氢
C.降低溶液温度 D.加入少量固体氢氧化钠
| 温度/℃ | c(NH3·H2O) /(mol·L-1) | 电离常数 | 电离度/% | c(OH-) /(mol·L-1) |
| 0 | 16.56 | 1.37×10-5 | 9.098 | 1.507×10-2 |
| 10 | 15.16 | 1.57×10-5 | 10.18 | 1.543×10-2 |
| 20 | 13.63 | 1.71×10-5 | 11.2 | 1.527×10-2 |
提示:

(1)温度升高,NH3·H2O的电离平衡向
a.电离常数 b.电离度 c.c(OH-) d.c(NH3·H2O)
(2)表中c(OH-)基本不变的原因是
(3)常温下,在氨水中加入一定量的氯化铵晶体,下列说法错误的是
A.溶液的pH增大 B.氨水的电离度减小 C.c(OH-)减小 D.c(NH4+)减小
(4)氨水溶液中,下列做法能使c(NH4+)与c(OH-)比值变大的是
A.加入固体氯化铵 B.通入少量氯化氢
C.降低溶液温度 D.加入少量固体氢氧化钠
您最近一年使用:0次



