我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。
I.某探究活动小组在实验室模拟侯氏制碱法。试回答下列有关问题:
【方案一】一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出)。
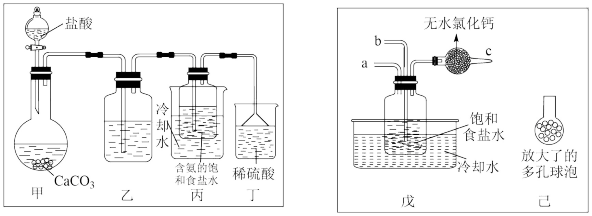
(1)已知乙装置中的除杂试剂是____________ ,反应的离子方程式为__________________ 。
(2)丙中发生反应的化学方程式为:__________________ 。实验结束后,分离出 的操作是
的操作是______ (填分离操作的名称)。
【方案二】另一位同学用图中戊装置(其它装置未画出)进行实验。
(3)实验时,须先从a管通入______ 气体,再从b管中通入其他气体;
(4)有同学建议在戊装置的b管下端连接己装置,理由是________________________ 。
(5)制得 后获得纯碱的化学方程式为
后获得纯碱的化学方程式为______ ,实验室进行此操作的装置可以是图中的______ 。
A. B.
B. C.
C. D.
D.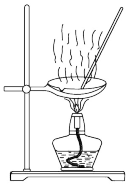
II.工业纯碱中可能混有少量NaCl,同学们探究纯碱样品中是否含有NaCl
(6)根据实验结论补充实验操作和现象
I.某探究活动小组在实验室模拟侯氏制碱法。试回答下列有关问题:
【方案一】一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出)。

(1)已知乙装置中的除杂试剂是
(2)丙中发生反应的化学方程式为:
 的操作是
的操作是【方案二】另一位同学用图中戊装置(其它装置未画出)进行实验。
(3)实验时,须先从a管通入
(4)有同学建议在戊装置的b管下端连接己装置,理由是
(5)制得
 后获得纯碱的化学方程式为
后获得纯碱的化学方程式为A.
 B.
B. C.
C. D.
D.
II.工业纯碱中可能混有少量NaCl,同学们探究纯碱样品中是否含有NaCl
(6)根据实验结论补充实验操作和现象
实验操作 | 现象 | 结论 |
| ①取样品加水溶解,加入 | ② | 样品中有NaCl |
| ③向上述溶液中 | ④ |
更新时间:2022-11-18 16:19:33
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
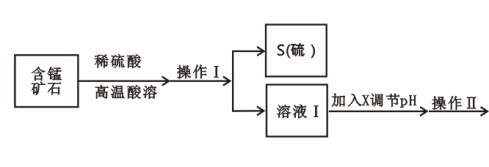
【推荐1】某含锰矿石的主要成分是MnO2,还含CaO、Al2O3、FeS杂质,由此矿石生产MnCO3的工艺流程如图所示:

已知:①相关金属离子生成氢氧化物沉淀的pH如表所示:
②常温下,Ksp(CaF2)=3.95×10-11
回答下列问题:
(1)酸溶时,是否能将稀硫酸换成浓盐酸______ (填“是”或“否”);操作I的名称为______________ 。
(2)取溶液Ⅰ加入KSCN溶液,溶液呈血红色,试写出酸溶过程中MnO2与FeS发生反应的离子方程式:______ 。
(3)调节溶液Ⅰ的pH时,pH的范围为_________ ;所用的物质X最好是________ (填字母)。
A.盐酸 B.NaOH溶液 C.氨水 D.MnCO3固体
(4)滤渣Ⅰ为___________________ ,滤渣Ⅱ为_____________ 。(填化学式)
(5)沉锰的化学方程式为_________________________________________ 。
(6)沉锰后过滤得到固体MnCO3,设计实验方案验证MnCO3固体是否洗涤干净:__________ 。


已知:①相关金属离子生成氢氧化物沉淀的pH如表所示:
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.8 | 4.7 |
| Mn(OH)2 | 8.8 | 10.4 |
| Ca(OH)2 | 12 | ─ |
②常温下,Ksp(CaF2)=3.95×10-11
回答下列问题:
(1)酸溶时,是否能将稀硫酸换成浓盐酸
(2)取溶液Ⅰ加入KSCN溶液,溶液呈血红色,试写出酸溶过程中MnO2与FeS发生反应的离子方程式:
(3)调节溶液Ⅰ的pH时,pH的范围为
A.盐酸 B.NaOH溶液 C.氨水 D.MnCO3固体
(4)滤渣Ⅰ为
(5)沉锰的化学方程式为
(6)沉锰后过滤得到固体MnCO3,设计实验方案验证MnCO3固体是否洗涤干净:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】I.过氧化氢的性质:过氧化氢(H2O2)俗名双氧水,医疗上可作外科消毒剂,是一种二元弱酸且具有氧化性和还原性。
(1)请写出H2O2与Ba(OH)2溶液反应生成的酸式盐的电子式___________ 。
(2)水电离生成H3O+和OH-叫做水的自偶电离。同水一样,H2O2也有极弱的自偶电离,其自偶电离的方程式为___________ 。
(3)过氧化铬(CrO5,分子结构为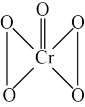 )中Cr的化合价为
)中Cr的化合价为___________ ;过氧化铬可通过酸性K2Cr2O7溶液与过氧化氢反应制得,写出该反应的离子方程式___________ 。
II.用过氧化氢制取过氧化钙:过氧化钙(CaO2)在室温下稳定,加热至350℃左右,迅速分解。微溶于水,不溶于乙醇,可溶于稀酸生成过氧化氢。实验室用如下方法制备CaO2并测定其纯度。过氧化钙的制备实验装置和步骤如下:

将盛有H2O2溶液和氨水混合液的三颈烧瓶置于冷水浴中,在搅拌下滴入CaCl2溶液,析出固体CaO2·8H2O。对所得固体过滤,用5mL无水乙醇洗涤2~3次,转移至坩埚于烘箱内105℃下脱水干燥,冷却后称重,得产品CaO2。回答下列问题:
(4)仪器 a的名称为___________ 。
(5)三颈烧瓶中发生反应的化学方程式为___________ 。
(6)判断脱水干燥是否完全,至少需要冷却后称重___________ 次。
(7)过氧化钙纯度的测定,装置如图所示。检查装置气密性后,精确称取m g过氧化钙样品加入试管中,调整甲管内液面读数在0~1 mL之间,并与乙管的液面相平,记下甲管内液面的初读数V1 mL。加热,过氧化钙逐渐分解放出氧气,完全分解,停止加热冷却至室温后,使甲乙两管的液面相平,记下甲管内液面的终读数V2 mL,设在此温度和压强下气体摩尔体积为Vm L·mol-1,则样品中CaO2的质量分数为___________ %。若甲管初始读数时俯视刻度,则测定结果___________ (填“偏高”、“偏低”或“无影响”)。

(1)请写出H2O2与Ba(OH)2溶液反应生成的酸式盐的电子式
(2)水电离生成H3O+和OH-叫做水的自偶电离。同水一样,H2O2也有极弱的自偶电离,其自偶电离的方程式为
(3)过氧化铬(CrO5,分子结构为
 )中Cr的化合价为
)中Cr的化合价为II.用过氧化氢制取过氧化钙:过氧化钙(CaO2)在室温下稳定,加热至350℃左右,迅速分解。微溶于水,不溶于乙醇,可溶于稀酸生成过氧化氢。实验室用如下方法制备CaO2并测定其纯度。过氧化钙的制备实验装置和步骤如下:

将盛有H2O2溶液和氨水混合液的三颈烧瓶置于冷水浴中,在搅拌下滴入CaCl2溶液,析出固体CaO2·8H2O。对所得固体过滤,用5mL无水乙醇洗涤2~3次,转移至坩埚于烘箱内105℃下脱水干燥,冷却后称重,得产品CaO2。回答下列问题:
(4)仪器 a的名称为
(5)三颈烧瓶中发生反应的化学方程式为
(6)判断脱水干燥是否完全,至少需要冷却后称重
(7)过氧化钙纯度的测定,装置如图所示。检查装置气密性后,精确称取m g过氧化钙样品加入试管中,调整甲管内液面读数在0~1 mL之间,并与乙管的液面相平,记下甲管内液面的初读数V1 mL。加热,过氧化钙逐渐分解放出氧气,完全分解,停止加热冷却至室温后,使甲乙两管的液面相平,记下甲管内液面的终读数V2 mL,设在此温度和压强下气体摩尔体积为Vm L·mol-1,则样品中CaO2的质量分数为

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】【化学一选修2:化学与技术】纳米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂。
(1)工业上二氧化钛的制备是:
Ⅰ.将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2,制得混有SiCl4杂质的TiCl4。
Ⅱ.将混有SiCl4杂质的TiCl4分离,得到纯净的TiCl4。
Ⅲ.在TiCl4中加水、加热,水解得到沉淀TiO2•xH2O。
Ⅳ.TiO2•xH2O高温分解得到TiO2。
①TiCl4与SiCl4在常温下的状态是_______ 。Ⅱ中所采取的操作名称_______ 。
②如实验IV中,应将TiO2•xH2O放在_______ (填仪器编号)中加热。

(2)据报道“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2,其过程大致如下:
 .O2→ 2O
.O2→ 2O
 .O + H2O → 2OH(羟基)
.O + H2O → 2OH(羟基)
 .OH + OH → H2O2
.OH + OH → H2O2
① b中破坏的是_______ (填“极性共价键”或“非极性共价键”)。
② H2O2能清除路面空气中的CxHy、CO等,其主要是利用了H2O2的_______ (填“氧化性”或“还原性”)。
(3)过氧化氢是重要的化学试剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量。请填写下列空白:
①取10.00mL密度为 g/mL的过氧化氢溶液稀释至250mL。取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请配平化学方程式。
g/mL的过氧化氢溶液稀释至250mL。取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请配平化学方程式。
MnO4-+H2O2+H+=Mn2++H2O +
_______
②滴定时,将高锰酸钾标准溶液注入_______ (填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是_______ 。
③重复滴定三次,平均耗用cmol/L KMnO4标准溶液VmL,则原过氧化氢溶液中过氧化氢的质量分数为_______ 。
④若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_______ 填“偏高”或“偏低”或“不变”)。
(1)工业上二氧化钛的制备是:
Ⅰ.将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2,制得混有SiCl4杂质的TiCl4。
Ⅱ.将混有SiCl4杂质的TiCl4分离,得到纯净的TiCl4。
Ⅲ.在TiCl4中加水、加热,水解得到沉淀TiO2•xH2O。
Ⅳ.TiO2•xH2O高温分解得到TiO2。
①TiCl4与SiCl4在常温下的状态是
②如实验IV中,应将TiO2•xH2O放在
资料卡片 | ||
| 物质 | 熔点 | 沸点 |
| SiCl4 | -70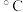 | 57.6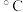 |
| TiCl4 | -25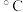 | 136.5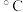 |

(2)据报道“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2,其过程大致如下:
 .O2→ 2O
.O2→ 2O .O + H2O → 2OH(羟基)
.O + H2O → 2OH(羟基) .OH + OH → H2O2
.OH + OH → H2O2① b中破坏的是
② H2O2能清除路面空气中的CxHy、CO等,其主要是利用了H2O2的
(3)过氧化氢是重要的化学试剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量。请填写下列空白:
①取10.00mL密度为
 g/mL的过氧化氢溶液稀释至250mL。取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请配平化学方程式。
g/mL的过氧化氢溶液稀释至250mL。取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请配平化学方程式。MnO4-+H2O2+H+=Mn2++H2O +

②滴定时,将高锰酸钾标准溶液注入
③重复滴定三次,平均耗用cmol/L KMnO4标准溶液VmL,则原过氧化氢溶液中过氧化氢的质量分数为
④若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果
您最近一年使用:0次



