为探究 的性质,某学习小组进行了如下探究。
的性质,某学习小组进行了如下探究。
(1)向制得的 溶液中加入铁粉,其目的是
溶液中加入铁粉,其目的是_______ 。
(2)预测 既有氧化性又有还原性。你认为预测的依据是
既有氧化性又有还原性。你认为预测的依据是_______ 。
(3)进行实验探究。实验室提供了下列试剂: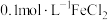 溶液、
溶液、 溶液、新制氯水、KSCN溶液、锌片、铜片。
溶液、新制氯水、KSCN溶液、锌片、铜片。
①向 溶液中滴入新制氯水,探究的是
溶液中滴入新制氯水,探究的是 的
的_______ 性(填“氧化”或“还原”),所发生反应的离子方程式为_______ 。
②在实验中,甲同学发现现象不太明显,老师分析可能是反应产物的含量太低,建议通过检验 反应产物的存在以获取证据。可选
反应产物的存在以获取证据。可选_______ 滴入甲同学所得的混合溶液中,并通过溶液出现_______ 的现象证明 具有还原性,能被氯水氧化。
具有还原性,能被氯水氧化。
③设计实验证明 具有氧化性:
具有氧化性:_______ 。
 的性质,某学习小组进行了如下探究。
的性质,某学习小组进行了如下探究。(1)向制得的
 溶液中加入铁粉,其目的是
溶液中加入铁粉,其目的是(2)预测
 既有氧化性又有还原性。你认为预测的依据是
既有氧化性又有还原性。你认为预测的依据是(3)进行实验探究。实验室提供了下列试剂:
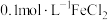 溶液、
溶液、 溶液、新制氯水、KSCN溶液、锌片、铜片。
溶液、新制氯水、KSCN溶液、锌片、铜片。①向
 溶液中滴入新制氯水,探究的是
溶液中滴入新制氯水,探究的是 的
的②在实验中,甲同学发现现象不太明显,老师分析可能是反应产物的含量太低,建议通过检验
 反应产物的存在以获取证据。可选
反应产物的存在以获取证据。可选 具有还原性,能被氯水氧化。
具有还原性,能被氯水氧化。③设计实验证明
 具有氧化性:
具有氧化性:
更新时间:2022-11-25 21:16:46
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】高铁酸钾(K2FeO4)是一种高效多功能的新型非氯绿色消毒剂。实验小组欲制备高铁酸钾并探究其性质。
已知:K2FeO4为紫色固体,具有强氧化性;在碱性溶液中较稳定,微溶于KOH溶液;在酸性或中性溶液中快速产生O2,
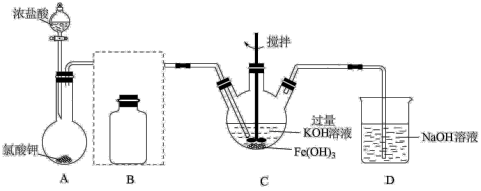
(1)除了用二氧化锰和浓盐酸反应外,实验室可以用氯酸钾和浓盐酸反应制取氯气,反应方程式如下:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
①浓盐酸在反应中显示出来的性质是_______ 性和_______ 性,该反应中转移的电子数目为_______ 。
②若产生标况下6.72LCl2,则被氧化的HCl的物质的量为_______ mol。
③如果要将装置B补充完整,除需用导管外,试剂瓶中还应装的除杂试剂为_______ 。
(2)C中得到紫色固体和溶液。C中Cl2发生的反应有3C12+2Fe(OH)3+10KOH=2K2FeO4+6KC1+8H2O。另外还有_______ (用离子方程式表示)。
(3)探究K2FeO4的性质
取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否是K2FeO4氧化了Cl-而产生Cl2,设计如下方案:
方案一:取少量a,滴加KSCN溶液至过量,溶液呈血红色
方案二:用KOH溶液充分洗涤C中所得固体,除去固体表面附着的ClO-,防止其氧化Cl-,再用KOH溶液将K2FeO4溶出,得到紫色溶液b,取少量b,滴加盐酸,有Cl2产生。
①由方案一中溶液变红可知a中含有_______ (填离子符号),但该离子的产生不能判断一定是K2FeO4将Cl-氧化所得,还可能由_______ (文字描述)。
②根据K2FeO4的制备实验得出:氧化性Cl2_______ FeO (填“>”或“<”),而方案二实验中Cl2和FeO
(填“>”或“<”),而方案二实验中Cl2和FeO 的氧化性强弱关系与之相反,原因是
的氧化性强弱关系与之相反,原因是_______ 。
已知:K2FeO4为紫色固体,具有强氧化性;在碱性溶液中较稳定,微溶于KOH溶液;在酸性或中性溶液中快速产生O2,

(1)除了用二氧化锰和浓盐酸反应外,实验室可以用氯酸钾和浓盐酸反应制取氯气,反应方程式如下:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
①浓盐酸在反应中显示出来的性质是
②若产生标况下6.72LCl2,则被氧化的HCl的物质的量为
③如果要将装置B补充完整,除需用导管外,试剂瓶中还应装的除杂试剂为
(2)C中得到紫色固体和溶液。C中Cl2发生的反应有3C12+2Fe(OH)3+10KOH=2K2FeO4+6KC1+8H2O。另外还有
(3)探究K2FeO4的性质
取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否是K2FeO4氧化了Cl-而产生Cl2,设计如下方案:
方案一:取少量a,滴加KSCN溶液至过量,溶液呈血红色
方案二:用KOH溶液充分洗涤C中所得固体,除去固体表面附着的ClO-,防止其氧化Cl-,再用KOH溶液将K2FeO4溶出,得到紫色溶液b,取少量b,滴加盐酸,有Cl2产生。
①由方案一中溶液变红可知a中含有
②根据K2FeO4的制备实验得出:氧化性Cl2
 (填“>”或“<”),而方案二实验中Cl2和FeO
(填“>”或“<”),而方案二实验中Cl2和FeO 的氧化性强弱关系与之相反,原因是
的氧化性强弱关系与之相反,原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】碘是动植物和人体必需的微量元素,I-的氧化和单质I2的分离是海带中碘元素分离的关键步骤。某学习小组在实验室对海带中碘元素进行分离和含量测定,并进行实验改进。
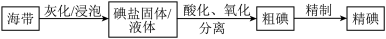
(1)海带中的碘元素以碘化物的形式存在,在酸化、氧化操作中,该小组首先选用氯水作为氧化剂,当氯水过量时碘单质被继续氧化成IO ,与该过程相关的离子方程式为
,与该过程相关的离子方程式为______ 、_____ 。
(2)针对以上出现的问题,该小组对实验进行改进,采用双氧水做氧化剂,逐滴滴加到过量I-溶液中,溶液颜色逐渐由黄色变为棕色。其反应原理为:①2I-+2H++H2O2=I2+2H2O②I-+I2=I (低浓度为黄色,高浓度为棕色)。过氧化氢过量时:③I2+5H2O2=HIO3(无色溶液)+4H2O。如果双氧水滴加过量,造成的影响为
(低浓度为黄色,高浓度为棕色)。过氧化氢过量时:③I2+5H2O2=HIO3(无色溶液)+4H2O。如果双氧水滴加过量,造成的影响为_____ 。而且该反应过程放出大量热,会对I2的提取造成的影响是_____ 。
(3)该小组针对问题又提出新的解决办法,采用溶液反加法,将I-溶液缓慢滴加到足量酸酸化的H2O2中,其反应如下:①2I-+2H++H2O2=I2+2H2O②I2+5H2O2=2HIO3+4H2O③4HI+2HIO3=3I2+6H2O。缓慢滴加过程中至反应结束,可观察到混合液颜色变化和现象为_____ 。
A.黄色逐渐加深,直到紫色沉淀析出
B.紫色逐渐加深,直到紫色沉淀析出
C.黄色逐渐变为棕色,直到紫色沉淀析出
D.黄色变无色,再变为黄色,搅拌后变为无色……,直到紫色沉淀析出
该实验改进措施最大的优点为_____ 。

(1)海带中的碘元素以碘化物的形式存在,在酸化、氧化操作中,该小组首先选用氯水作为氧化剂,当氯水过量时碘单质被继续氧化成IO
 ,与该过程相关的离子方程式为
,与该过程相关的离子方程式为(2)针对以上出现的问题,该小组对实验进行改进,采用双氧水做氧化剂,逐滴滴加到过量I-溶液中,溶液颜色逐渐由黄色变为棕色。其反应原理为:①2I-+2H++H2O2=I2+2H2O②I-+I2=I
 (低浓度为黄色,高浓度为棕色)。过氧化氢过量时:③I2+5H2O2=HIO3(无色溶液)+4H2O。如果双氧水滴加过量,造成的影响为
(低浓度为黄色,高浓度为棕色)。过氧化氢过量时:③I2+5H2O2=HIO3(无色溶液)+4H2O。如果双氧水滴加过量,造成的影响为(3)该小组针对问题又提出新的解决办法,采用溶液反加法,将I-溶液缓慢滴加到足量酸酸化的H2O2中,其反应如下:①2I-+2H++H2O2=I2+2H2O②I2+5H2O2=2HIO3+4H2O③4HI+2HIO3=3I2+6H2O。缓慢滴加过程中至反应结束,可观察到混合液颜色变化和现象为
A.黄色逐渐加深,直到紫色沉淀析出
B.紫色逐渐加深,直到紫色沉淀析出
C.黄色逐渐变为棕色,直到紫色沉淀析出
D.黄色变无色,再变为黄色,搅拌后变为无色……,直到紫色沉淀析出
该实验改进措施最大的优点为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]在工业上常用作分析试剂,它可用含SiO2、CeO2和Fe2O3的工业废料作原料来获得,同时可回收CeO2,工艺流程设计如下:
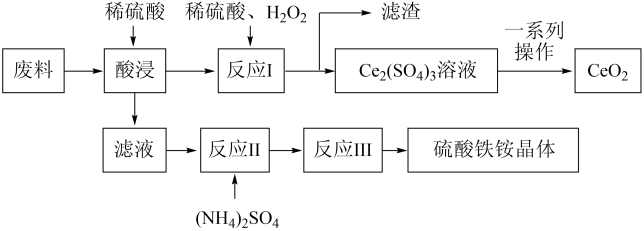
已知:①SiO2、CeO2不溶于稀硫酸;
②酸性条件下,CeO2可与H2O2反应;
③“反应I”所得溶液中含有Ce3+;
④碱性条件下, 与OH-结合生成NH3·H2O。
与OH-结合生成NH3·H2O。
请回答下列问题:
(1)“酸浸”时发生反应的离子方程式为______ 未发生反应的物质是_______ (填化学式)。
(2)“滤液”中含有的阳离子有______ (填离子符号)。
(3)写出“反应I”的化学方程式:____ ;“反应I”后进行固液分离时用到的玻璃仪器有______ 。
(4)在酸性条件下,H2O2、CeO2两种物质中,氧化性较弱的是_______ (填化学式)。
(5)若往硫酸铁铵溶液中加入过量的NaOH,写出该反应的离子方程式:______ 。

已知:①SiO2、CeO2不溶于稀硫酸;
②酸性条件下,CeO2可与H2O2反应;
③“反应I”所得溶液中含有Ce3+;
④碱性条件下,
 与OH-结合生成NH3·H2O。
与OH-结合生成NH3·H2O。请回答下列问题:
(1)“酸浸”时发生反应的离子方程式为
(2)“滤液”中含有的阳离子有
(3)写出“反应I”的化学方程式:
(4)在酸性条件下,H2O2、CeO2两种物质中,氧化性较弱的是
(5)若往硫酸铁铵溶液中加入过量的NaOH,写出该反应的离子方程式:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】铁是人类较早使用的金属之一,运用所学知识,回答下列问题。电子工业常用 30%的 FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中存在Fe3+的试剂是_______ (填化学式)溶液,证明 Fe3+存在的现象是_______ 。
(2)写出 FeCl3溶液与金属铜发生反应的离子方程式_______ 。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤:
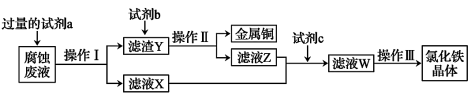
回答下列问题:
①试剂a是_______ ,操作I用到的玻璃仪器有烧杯、玻璃棒和_______ 。
②滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为_______ 。
③上述流程中操作III包括_______ 、过滤、洗涤。
(1)检验溶液中存在Fe3+的试剂是
(2)写出 FeCl3溶液与金属铜发生反应的离子方程式
(3)某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤:

回答下列问题:
①试剂a是
②滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为
③上述流程中操作III包括
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】兴趣小组以一种工业废渣(主要成分为MgCO3和少量FeO、Fe2O3、Al2O3)为原料制备MgCO3·3H2O。实验过程如下:

(1)“酸溶”过程中加入的H2SO4不宜过量太多,原因是________ 。
(2)加入H2O2 “氧化”时反应的离子方程式为________ 。反应温度一般控制在40℃~50℃,目的是________ 。
(3)用下图所示的实验装置以除去氧化后溶液中的Fe3+。
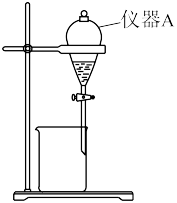
①实验装置图中仪器A的名称为________ 。
②常用________ 来检验水溶液中的Fe3+是否除净。
(4)请补充完整由(3)中得到的水溶液来制备MgCO3·3H2O的实验方案:边搅拌边________ ,在50℃下干燥,得到MgCO3·3H2O。
[可供选用的试剂:氨水、Na2CO3溶液、蒸馏水;已知该溶液中pH=5.0时Al(OH)3沉淀完全;pH=8.5时Mg(OH)2开始沉淀。]

(1)“酸溶”过程中加入的H2SO4不宜过量太多,原因是
(2)加入H2O2 “氧化”时反应的离子方程式为
(3)用下图所示的实验装置以除去氧化后溶液中的Fe3+。

①实验装置图中仪器A的名称为
②常用
(4)请补充完整由(3)中得到的水溶液来制备MgCO3·3H2O的实验方案:边搅拌边
[可供选用的试剂:氨水、Na2CO3溶液、蒸馏水;已知该溶液中pH=5.0时Al(OH)3沉淀完全;pH=8.5时Mg(OH)2开始沉淀。]
您最近一年使用:0次
【推荐3】为探索工业废料的再利用,某化学兴趣小组用含有铝、铁和铜等合金废料制取纯碱、氧化铝和绿矾(FeSO4·7H2O),其工艺流程如下图。
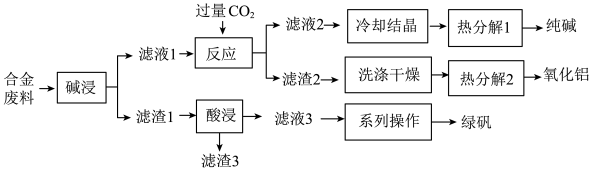
请回答下列问题:
(1)写出“碱浸”中发生反应的化学方程式_______ ,滤渣2的主要成分是_______ (填化学式)。
(2)写出“酸浸”中发生反应的离子方程式_______ ,滤渣3的主要成分是_______ (填化学式)。
(3)写出“热分解1”的化学方程式为_______ ,纯碱在生产生活中的一种用途是_______ 。
(4)该工艺流程中,可循环的物质是_______ (填化学式)。
(5)绿矾可用作补铁剂,长期放置易被氧化而变质。为了探究某绿矾样品是否已变质和变质的程度,该小组同学将样品溶于水,制成待测液,进行如下实验。

请回答下列问题:
(1)写出“碱浸”中发生反应的化学方程式
(2)写出“酸浸”中发生反应的离子方程式
(3)写出“热分解1”的化学方程式为
(4)该工艺流程中,可循环的物质是
(5)绿矾可用作补铁剂,长期放置易被氧化而变质。为了探究某绿矾样品是否已变质和变质的程度,该小组同学将样品溶于水,制成待测液,进行如下实验。
| 实验步骤 | 实验现象 | 结论或方程式 |
| 步骤一:取待测液于试管中,向其中滴加KSCN溶液 | ① | 待测液含有Fe3+。 |
| 步骤二:另取待测液于试管中,向其中滴加② | ③ | 待测液含有Fe2+。 |
| 实验结论:该绿矾样品是部分变质的。 | ||
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】FeCl3溶液可用于蚀刻电路板上的铜,为回收蚀刻废液中的Cu和再生FeCl3溶液,实验小组采用了如下图所示的流程:

已知FeCl3溶液蚀刻电路板上的铜时所发生的反应为2FeCl3+Cu=2FeCl2+CuCl2
(1)检验蚀刻废液中是否存在Fe3+的方法是_______ 。
(2)从滤渣中回收铜的方法是_______ 。
(3)反应2的目的是再生FeCl3溶液,该反应的化学方程式为_______ 。

已知FeCl3溶液蚀刻电路板上的铜时所发生的反应为2FeCl3+Cu=2FeCl2+CuCl2
(1)检验蚀刻废液中是否存在Fe3+的方法是
(2)从滤渣中回收铜的方法是
(3)反应2的目的是再生FeCl3溶液,该反应的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】高铁酸钾(K2FeO4)是新型高效净水剂,某实验小组制备K2FeO4并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4 (夹持装置略)

①A为氯气发生装置。A中反应的离子方程式为_______ 。
②请在B方框内将除杂装置补充完整,并标明所用试剂_______ 。
③C中得到紫色固体和溶液。C中主要反应的化学方程式为_______ 。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
由方案Ⅰ中溶液变红可知a中含有的离子为_______ ,但该离子的产生不能判断一定是由Cl-还原K2FeO4得到的,该离子还可能由_______ 产生(用离子方程式表示)。
②根据K2FeO4的制备实验得出:氧化性Cl2_______  (填“>”或“<”),由方案Ⅱ实验表明,Cl2和
(填“>”或“<”),由方案Ⅱ实验表明,Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是_______ 。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4 (夹持装置略)

①A为氯气发生装置。A中反应的离子方程式为
②请在B方框内将除杂装置补充完整,并标明所用试剂
③C中得到紫色固体和溶液。C中主要反应的化学方程式为
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
②根据K2FeO4的制备实验得出:氧化性Cl2
 (填“>”或“<”),由方案Ⅱ实验表明,Cl2和
(填“>”或“<”),由方案Ⅱ实验表明,Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】某学习小组利用下图所示的实验装置进行铁跟水蒸气反应的实验,并验证其产物的部分性质。

请回答下列问题:
(1)圆底烧瓶中加入少许碎瓷片的作用是___________ , 无水硫酸铜粉末变蓝色,说明铁跟水蒸气反应生成的气体为___________ (填化学式)。
(2)欲确定反应后硬质玻璃管A中固体物质的成分,设计了如下实验方案:

①根据现象,写出固体产物加入稀盐酸后反应的离子方程式:______ (假设铁和水蒸气已完全反应)。
②加入新制氯水后溶液红色加深的原因:______ (用化学方程式表示)。
(3)若在上述实验方案中加入过量的氯水,放置一段时间后 ,发现深红色褪去,现对褪色的原因进行探究:
I.提出假设:假设1:溶液中的SCN-被氧化;
假设2:___________ 。
II.设计方案对假设1进行验证,写出实验方案:______ 。

请回答下列问题:
(1)圆底烧瓶中加入少许碎瓷片的作用是
(2)欲确定反应后硬质玻璃管A中固体物质的成分,设计了如下实验方案:

①根据现象,写出固体产物加入稀盐酸后反应的离子方程式:
②加入新制氯水后溶液红色加深的原因:
(3)若在上述实验方案中加入过量的氯水,放置一段时间后 ,发现深红色褪去,现对褪色的原因进行探究:
I.提出假设:假设1:溶液中的SCN-被氧化;
假设2:
II.设计方案对假设1进行验证,写出实验方案:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】氨气是一种重要化合物,在工农业生产、生活中有着重要应用。

(1)实验室常用NH4Cl 与Ca(OH)2反应制取氨气,该反应的化学方程式为_______ 。
(2)用装置B收集氨气时,应选择氨气的进气口是_______ (填“a”或“b”)。
(3)打开装置B中的止水夹c,若观察到烧瓶内产生了蓝色喷泉,则说明氨气具有的性质是_______ 。
(4)为得到干燥的氨气,可选用的干燥剂是_______ (填序号)。
①固体氢氧化钠 ②五氧化二磷 ③碱石灰 ④无水CaCl2
(5)氨的催化氧化是工业生产硝酸的重要步骤。某化学课外活动小组设计了如图装置模拟该实验过程,并用水吸收制取硝酸(部分固定装置略去):

①装置A的分液漏斗中盛放浓氨水,则烧瓶中盛放的药品应该是_______ (填化学式)。
②装置C中反应的方程式为_______ 。
③反应后,装置E中除存在较多的H+外,还可能存在的一种阳离子是_______ 。

(1)实验室常用NH4Cl 与Ca(OH)2反应制取氨气,该反应的化学方程式为
(2)用装置B收集氨气时,应选择氨气的进气口是
(3)打开装置B中的止水夹c,若观察到烧瓶内产生了蓝色喷泉,则说明氨气具有的性质是
(4)为得到干燥的氨气,可选用的干燥剂是
①固体氢氧化钠 ②五氧化二磷 ③碱石灰 ④无水CaCl2
(5)氨的催化氧化是工业生产硝酸的重要步骤。某化学课外活动小组设计了如图装置模拟该实验过程,并用水吸收制取硝酸(部分固定装置略去):

①装置A的分液漏斗中盛放浓氨水,则烧瓶中盛放的药品应该是
②装置C中反应的方程式为
③反应后,装置E中除存在较多的H+外,还可能存在的一种阳离子是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】工业和居民生活向大气排放污染物使大气酸化,造成大气酸化的主要气体之一是SO2.某化学学习小组同学对SO2性质进行了探究。
(1)学习小组用图1装置制备SO2气体。_______ 。
②写出仪器A中发生反应的化学方程式_______ 。
③反应结束后,排除A瓶中残留的SO2气体,其具体操作是_______ 。
(2)学习小组用图2装置来检验SO2的性质,回答有关问题。
①甲同学欲检验SO2的漂白性,则B中应加入的试剂是_______ 。
②乙同学欲检验SO2的氧化性和还原性,分别在B、C中盛放Na2S溶液、FeCl3溶液,请描述在通入SO2气体过程中观察到的现象_______ 。
③丙同学欲检验H2SO3与HClO酸性强弱,应分别在B、C中盛放_______ (填标号)。
A.足量Ca (ClO)2溶液、Ba (OH)2溶液 B.足量NaClO、澄清石灰水
C.足量NaHCO3、NaClO溶液 D.足量NaHCO3、Ca (ClO)2溶液
(3)学习小组对Na2SO3固体的纯度进行了测定,取15. 0g Na2SO3固体样品配置成100 mL溶液,取25. 00mL放入锥形瓶中,加水稀释到50 mL,然后用1. 000 mol·L-1酸性KMnO4标准溶液进行滴定,消耗酸性KMnO4标准溶液10. 00mL。
①滴定终点的判断依据是_______ 。
②Na2SO3固体的纯度为_______ 。
(1)学习小组用图1装置制备SO2气体。

②写出仪器A中发生反应的化学方程式
③反应结束后,排除A瓶中残留的SO2气体,其具体操作是
(2)学习小组用图2装置来检验SO2的性质,回答有关问题。
①甲同学欲检验SO2的漂白性,则B中应加入的试剂是
②乙同学欲检验SO2的氧化性和还原性,分别在B、C中盛放Na2S溶液、FeCl3溶液,请描述在通入SO2气体过程中观察到的现象
③丙同学欲检验H2SO3与HClO酸性强弱,应分别在B、C中盛放
A.足量Ca (ClO)2溶液、Ba (OH)2溶液 B.足量NaClO、澄清石灰水
C.足量NaHCO3、NaClO溶液 D.足量NaHCO3、Ca (ClO)2溶液
(3)学习小组对Na2SO3固体的纯度进行了测定,取15. 0g Na2SO3固体样品配置成100 mL溶液,取25. 00mL放入锥形瓶中,加水稀释到50 mL,然后用1. 000 mol·L-1酸性KMnO4标准溶液进行滴定,消耗酸性KMnO4标准溶液10. 00mL。
①滴定终点的判断依据是
②Na2SO3固体的纯度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】配合物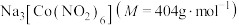 在分析化学中用于
在分析化学中用于 的鉴定,其制备装置示意图(夹持装置等略)及步骤如下:
的鉴定,其制备装置示意图(夹持装置等略)及步骤如下: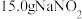 和
和 热蒸馏水,搅拌溶解。
热蒸馏水,搅拌溶解。
②磁力搅拌下加入 ,从仪器a加入50%醋酸
,从仪器a加入50%醋酸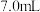 。冷却至室温后,再从仪器b缓慢滴入30%双氧水
。冷却至室温后,再从仪器b缓慢滴入30%双氧水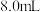 。待反应结束,滤去固体。
。待反应结束,滤去固体。
③在滤液中加入95%乙醇,静置40分钟。固液分离后,依次用乙醇、乙醚洗涤固体产品,称重。
已知:i.乙醇、乙醚的沸点分别是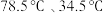 ;
;
ii. 的溶解度数据如下表。
的溶解度数据如下表。
回答下列问题:
(1)仪器a的名称是_______ ,使用前应_______ 。
(2)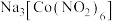 中钴的化合价是
中钴的化合价是_______ ,制备该配合物的化学方程式为_______ 。
(3)步骤①中,用热蒸馏水的目的是_______ 。
(4)步骤③中,用乙醚洗涤固体产品的作用是_______ 。
(5)已知: (亮黄色)足量
(亮黄色)足量 与
与 产品反应生成
产品反应生成 亮黄色沉淀,产品纯度为
亮黄色沉淀,产品纯度为_______ %。
(6)实验室检验样品中钾元素的常用方法是:将铂丝用盐酸洗净后,在外焰上灼烧至与原来的火焰颜色相同时,用铂丝蘸取样品在外焰上灼烧,_______ 。
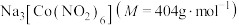 在分析化学中用于
在分析化学中用于 的鉴定,其制备装置示意图(夹持装置等略)及步骤如下:
的鉴定,其制备装置示意图(夹持装置等略)及步骤如下:
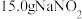 和
和 热蒸馏水,搅拌溶解。
热蒸馏水,搅拌溶解。②磁力搅拌下加入
 ,从仪器a加入50%醋酸
,从仪器a加入50%醋酸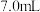 。冷却至室温后,再从仪器b缓慢滴入30%双氧水
。冷却至室温后,再从仪器b缓慢滴入30%双氧水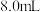 。待反应结束,滤去固体。
。待反应结束,滤去固体。③在滤液中加入95%乙醇,静置40分钟。固液分离后,依次用乙醇、乙醚洗涤固体产品,称重。
已知:i.乙醇、乙醚的沸点分别是
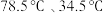 ;
;ii.
 的溶解度数据如下表。
的溶解度数据如下表。| 温度/℃ | 20 | 30 | 40 | 50 |
溶解度/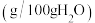 | 84.5 | 91.6 | 98.4 | 104.1 |
(1)仪器a的名称是
(2)
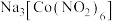 中钴的化合价是
中钴的化合价是(3)步骤①中,用热蒸馏水的目的是
(4)步骤③中,用乙醚洗涤固体产品的作用是
(5)已知:
 (亮黄色)足量
(亮黄色)足量 与
与 产品反应生成
产品反应生成 亮黄色沉淀,产品纯度为
亮黄色沉淀,产品纯度为(6)实验室检验样品中钾元素的常用方法是:将铂丝用盐酸洗净后,在外焰上灼烧至与原来的火焰颜色相同时,用铂丝蘸取样品在外焰上灼烧,
您最近一年使用:0次



