氯气在工业生产中有重要的用途。某课外活动小组利用下列装置在实验室中制备氯气,并进行有关氯气性质的研究。

(1)该小组同学欲用图1所示仪器及试剂(不一定全用)制备并收集干燥纯净的氯气。
①写出实验室制氯气的化学方程式:____ ;浓盐酸在反应中体现了____ (填编号)的性质。
A.酸性 B.氧化性 C.还原性 D.不稳定性
②选择装置,将各仪器按先后顺序连接起来,应该是a接_____,_____接_____,_____接_____,_____接h(用导管口处的字母表示)。____
(2)该小组同学设计并分别利用图2和图3所示装置探究氯气的氧化性,已知碘单质遇淀粉会变蓝。

①G中的现象是_____ ,原因是_____ (用化学方程式表示)。
②H中的现象是____ ,I中发生的离子反应方程式为____ 。

(1)该小组同学欲用图1所示仪器及试剂(不一定全用)制备并收集干燥纯净的氯气。
①写出实验室制氯气的化学方程式:
A.酸性 B.氧化性 C.还原性 D.不稳定性
②选择装置,将各仪器按先后顺序连接起来,应该是a接_____,_____接_____,_____接_____,_____接h(用导管口处的字母表示)。
(2)该小组同学设计并分别利用图2和图3所示装置探究氯气的氧化性,已知碘单质遇淀粉会变蓝。

①G中的现象是
②H中的现象是
更新时间:2022-11-29 13:13:47
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】某研究小组为探究元素周期表中元素性质的递变规律,设计了如下实验:
Ⅰ.利用如图装置可验证氯元素和碘元素非金属性的强弱。___________ ,仪器D的作用是___________ 。
(2)A中加浓盐酸,B中加 (
( 与浓盐酸常温下反应生成氯气)。
与浓盐酸常温下反应生成氯气)。
①C中加淀粉碘化钾混合溶液,观察到C中溶液有___________ 的现象,即可证明;
②从环境保护的观点考虑,此装置缺少尾气处理装置,可用___________ 溶液吸收尾气;
③ 与
与 的空间结构相似,其键角大小的关系是
的空间结构相似,其键角大小的关系是
___________  (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。
Ⅱ.验证同周期元素性质变化规律
(3)将钠、镁、铝各 分别投入到足量的同浓度的盐酸中,试预测实验结果:
分别投入到足量的同浓度的盐酸中,试预测实验结果: 与盐酸反应最剧烈,它的晶体堆积模型如图所示:
与盐酸反应最剧烈,它的晶体堆积模型如图所示:___________ 。以镁为例,发现随着反应时间的进行,化学反应速率是先加快后减慢,分析先加快的主要原因可能是(假设不考虑固体质量的减少对反应速率的影响,填序号)___________ 。
A.该反应是放热反应
B.该反应是吸热反应
C.温度升高速率加快对化学反应的影响,大于盐酸浓度降低速率减慢的影响
D.温度升高速率加快对化学反应的影响,小于盐酸浓度降低速率减慢的影响
(4)查阅有关氯化铝的一些资料,得到如下一些信息:①将氯化铝加热,在180℃时开始升华;②在 条件下,氯化铝的熔点为190℃;③在
条件下,氯化铝的熔点为190℃;③在 和
和 时,它的蒸气密度(换算成标准状况时)是氢气密度的133.5倍;④氯化铝的结构中含有配位键。
时,它的蒸气密度(换算成标准状况时)是氢气密度的133.5倍;④氯化铝的结构中含有配位键。
请根据以上资料回答下列问题:
①根据资料猜测氯化铝是___________ (填“离子化合物”或“共价化合物”)。
②通过计算确定氯化铝含有配位键的结构式正确的是___________ 。___________ 。
Ⅰ.利用如图装置可验证氯元素和碘元素非金属性的强弱。

(2)A中加浓盐酸,B中加
 (
( 与浓盐酸常温下反应生成氯气)。
与浓盐酸常温下反应生成氯气)。①C中加淀粉碘化钾混合溶液,观察到C中溶液有
②从环境保护的观点考虑,此装置缺少尾气处理装置,可用
③
 与
与 的空间结构相似,其键角大小的关系是
的空间结构相似,其键角大小的关系是
 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。Ⅱ.验证同周期元素性质变化规律
(3)将钠、镁、铝各
 分别投入到足量的同浓度的盐酸中,试预测实验结果:
分别投入到足量的同浓度的盐酸中,试预测实验结果: 与盐酸反应最剧烈,它的晶体堆积模型如图所示:
与盐酸反应最剧烈,它的晶体堆积模型如图所示:
A.该反应是放热反应
B.该反应是吸热反应
C.温度升高速率加快对化学反应的影响,大于盐酸浓度降低速率减慢的影响
D.温度升高速率加快对化学反应的影响,小于盐酸浓度降低速率减慢的影响
(4)查阅有关氯化铝的一些资料,得到如下一些信息:①将氯化铝加热,在180℃时开始升华;②在
 条件下,氯化铝的熔点为190℃;③在
条件下,氯化铝的熔点为190℃;③在 和
和 时,它的蒸气密度(换算成标准状况时)是氢气密度的133.5倍;④氯化铝的结构中含有配位键。
时,它的蒸气密度(换算成标准状况时)是氢气密度的133.5倍;④氯化铝的结构中含有配位键。请根据以上资料回答下列问题:
①根据资料猜测氯化铝是
②通过计算确定氯化铝含有配位键的结构式正确的是
A.  B.
B. C.
C.
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】无水ZnCl2常用作有机合成的脱水剂、缩合剂和催化剂。无水ZnCl2易吸水潮解。某化学兴趣小组的同学设计如下实验方案制备无水ZnCl2,并测定其纯度,实验装置如图所示:
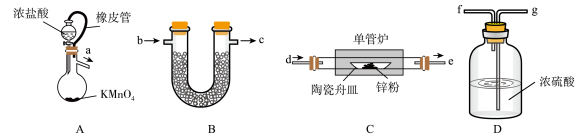
(1)装置A中反应的离子方程式为______ ;装置A中橡皮管的作用为______ 。
(2)按气流从左到右的方向,装置合理的连接顺序为a→______→______d→e→______(填接口小写字母)。______
(3)装置B中药品的作用为______ 。
(4)氯化锌纯度的测定:将ag试样配成100mL溶液。取20.00mL,加入磷酸三钠消除干扰离子后,滴入两滴半二甲酚橙作指示剂,用bmol/LEDTA(Na2H2Y)标准溶液滴定Zn2+,反应的离子方程式为Zn2++H2Y2-=ZnY2-+H+,达到终点时,消耗EDTA溶液的平均体积为5.00mL。
①配制100mLZnCl2溶液需用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、______ 。
②该氯化锌试样中氯化锌的质量分数为______ (用含a、b的代数式表示)。

(1)装置A中反应的离子方程式为
(2)按气流从左到右的方向,装置合理的连接顺序为a→______→______d→e→______(填接口小写字母)。
(3)装置B中药品的作用为
(4)氯化锌纯度的测定:将ag试样配成100mL溶液。取20.00mL,加入磷酸三钠消除干扰离子后,滴入两滴半二甲酚橙作指示剂,用bmol/LEDTA(Na2H2Y)标准溶液滴定Zn2+,反应的离子方程式为Zn2++H2Y2-=ZnY2-+H+,达到终点时,消耗EDTA溶液的平均体积为5.00mL。
①配制100mLZnCl2溶液需用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、
②该氯化锌试样中氯化锌的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】实验室里除了用二氧化锰和浓盐酸加热制取氯气,也可以在常温下利用反应:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O制取并收集纯净、干燥的氯气,装置如图所示:
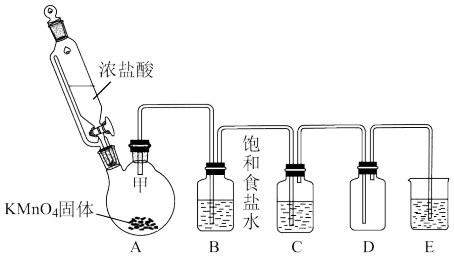
(1)装置A中盛放浓盐酸的仪器名称是___ ,该装置相比普通分液漏斗的优点是___ 。
(2)装置B的作用是___ ,装置C中盛装的药品是___ 。
(3)D装置收集氯气采用了___ 方法。
a.向下排空气法 b.向上排空气法 c.排水法 d.排饱和食盐水
(4)装置E中发生反应的化学方程式是___ 。
(5)某同学在实验室配制80mL1mol/L的NaOH溶液用于上述实验:
①该同学应选择___ mL的容量瓶,需称取NaOH的质量为___ g。
②若该同学所配溶液浓度偏大,请写出可能的一个原因是___ 。

(1)装置A中盛放浓盐酸的仪器名称是
(2)装置B的作用是
(3)D装置收集氯气采用了
a.向下排空气法 b.向上排空气法 c.排水法 d.排饱和食盐水
(4)装置E中发生反应的化学方程式是
(5)某同学在实验室配制80mL1mol/L的NaOH溶液用于上述实验:
①该同学应选择
②若该同学所配溶液浓度偏大,请写出可能的一个原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】工业上,四氯化锡(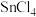 )常用作媒染剂和有机合成的氯化催化剂,在常温下其为无色液体,熔点-33℃,沸点114.1℃,在潮湿空气中极易水解,实验室将熔融的金属锡(熔点231℃)在300℃左右与绝对干燥的氯气反应生成无水四氯化锡,反应原理为:
)常用作媒染剂和有机合成的氯化催化剂,在常温下其为无色液体,熔点-33℃,沸点114.1℃,在潮湿空气中极易水解,实验室将熔融的金属锡(熔点231℃)在300℃左右与绝对干燥的氯气反应生成无水四氯化锡,反应原理为: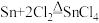 ,其实验装置如下图所示。
,其实验装置如下图所示。

(1)仪器a的名称是_______ ,其中A装置中发生反应的还原剂为_______ 。
(2)装置B和装置C中试剂相同,该试剂的作用为_______ ,进入D中的气体还含有_______ 。
(3)实验开始排完空气后应先点燃_______ 装置酒精灯或者喷灯(填装置序号);装置E中冷凝管的作用是_______ ,冷凝水应从_______ 口出水。
(4)装置F中球形干燥管内试剂为碱石灰,其作用是_______ 。
(5)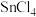 在空气中极易水解,生成白色粉末
在空气中极易水解,生成白色粉末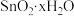 ,并释出HCl而呈现白色状。该反应的化学方程式为
,并释出HCl而呈现白色状。该反应的化学方程式为_______ 。收集少量白色粉末并称量质量,然后加热至恒重时,固体失重率为15%,则
_______ (计算结果保留小数点后一位)。
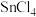 )常用作媒染剂和有机合成的氯化催化剂,在常温下其为无色液体,熔点-33℃,沸点114.1℃,在潮湿空气中极易水解,实验室将熔融的金属锡(熔点231℃)在300℃左右与绝对干燥的氯气反应生成无水四氯化锡,反应原理为:
)常用作媒染剂和有机合成的氯化催化剂,在常温下其为无色液体,熔点-33℃,沸点114.1℃,在潮湿空气中极易水解,实验室将熔融的金属锡(熔点231℃)在300℃左右与绝对干燥的氯气反应生成无水四氯化锡,反应原理为: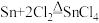 ,其实验装置如下图所示。
,其实验装置如下图所示。
(1)仪器a的名称是
(2)装置B和装置C中试剂相同,该试剂的作用为
(3)实验开始排完空气后应先点燃
(4)装置F中球形干燥管内试剂为碱石灰,其作用是
(5)
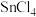 在空气中极易水解,生成白色粉末
在空气中极易水解,生成白色粉末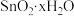 ,并释出HCl而呈现白色状。该反应的化学方程式为
,并释出HCl而呈现白色状。该反应的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】一位同学设计了一套用浓盐酸和高锰酸钾固体制取少量氯气并能比较氯气与碘单质氧化性强弱的微型装置,如图所示。
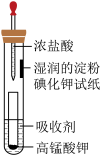
(1)下列溶液中,能吸收氯气的是______。
(2)能说明氯气的氧化性强于碘单质的实验现象是__________ 。
(3)请用原子结构的知识解释氯气的氧化性强于碘单质的原因:__________ 。

(1)下列溶液中,能吸收氯气的是______。
| A.饱和食盐水 | B.饱和Na2SO3溶液 |
| C.饱和NaOH溶液 | D.浓硫酸 |
(3)请用原子结构的知识解释氯气的氧化性强于碘单质的原因:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】实验室用如图装置制取氯气,并用氯气进行系列实验。回答下列问题:
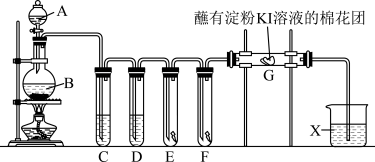
(1)A中盛有浓盐酸,B中盛有MnO2,写出反应的离子方程式:____ 。
(2)试管C中盛放饱和氯化钠溶液,D中盛放浓硫酸,E中为红色干布条,F中为湿润的蓝色石蕊试纸,可观察到F中的现象是____ ,对比E和F中的现象可得出的结论及解释是____ 。
(3)用离子方程式表示试剂X的作用:____ 。
(4)家庭中常用消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如图。

I.需“密闭保存”的原因____ 。
II.“消毒液与洁厕灵同时使用”会产生有毒的气体,写出反应的离子方程式:____ 。

(1)A中盛有浓盐酸,B中盛有MnO2,写出反应的离子方程式:
(2)试管C中盛放饱和氯化钠溶液,D中盛放浓硫酸,E中为红色干布条,F中为湿润的蓝色石蕊试纸,可观察到F中的现象是
(3)用离子方程式表示试剂X的作用:
(4)家庭中常用消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如图。

I.需“密闭保存”的原因
II.“消毒液与洁厕灵同时使用”会产生有毒的气体,写出反应的离子方程式:
您最近一年使用:0次



