弱电解质在水溶液里达到电离平衡时,溶液中已电离的电解质分子数占原总分子总数的百分数叫做该电解质的电离度。现欲粗略测定一未知浓度的醋酸溶液中醋酸的电离度,应做的实验和所需的试剂(或试纸)是
| A.电解、NaOH溶液 | B.蒸馏、Na2CO3溶液 |
| C.酯化反应、石蕊试液 | D.中和滴定、pH试纸 |
13-14高三上·上海嘉定·期末 查看更多[4]
(已下线)2013届上海市嘉定区高三上学期期末教学质量调研化学试卷2016届江西省临川区第一中学高三上学期10月月考化学试卷(已下线)上海市嘉定区2013年高考一模化学试题第17届(2003年)全国高中学生化学竞赛(江苏赛区)预赛试题
更新时间:2016-12-09 04:46:39
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】已知 ,醋酸、次氯酸的电离平衡常数如下表,下列叙述正确的是
,醋酸、次氯酸的电离平衡常数如下表,下列叙述正确的是
 ,醋酸、次氯酸的电离平衡常数如下表,下列叙述正确的是
,醋酸、次氯酸的电离平衡常数如下表,下列叙述正确的是| 酸 | 醋酸 | 次氯酸 |
| 电离平衡常数 |  | 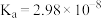 |
A. ,相同 ,相同 的 的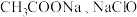 溶液中,阴离子总数较大的是 溶液中,阴离子总数较大的是 溶液 溶液 |
B. 时,等体积等浓度的 时,等体积等浓度的 和 和 溶液稀释相同倍数后 溶液稀释相同倍数后 的 的 更小 更小 |
C. 都为3的 都为3的 和 和 等体积混合后,混合液的 等体积混合后,混合液的 保持不变 保持不变 |
D.等体积且 都为3的 都为3的 和 和 分别与足量的 分别与足量的 反应, 反应, 消耗 消耗 更多 更多 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列有关叙述中正确的是
| A.强电解质的水溶液中不存在电离平衡 | B.用 试纸测得氯水的 试纸测得氯水的 为4 为4 |
| C.难溶于水的电解质一定是强电解质 | D.强电解质可能为共价化合物 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】根据下列实验操作及现象,不能推出相应结论的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向Fe2(SO4)3溶液中加入Cu片 | 溶液变蓝 | Fe3+的氧化性强于Cu2+ |
| B | 取2mL0.5mol·L-1CuCl2溶液于试管中,加热,后置于冷水中 | 加热后溶液变为黄绿色,冷却后变为蓝色 | 反应 的ΔH>0 的ΔH>0 |
| C | 缓慢加热0.5mol·L-1CH3COONa溶液至70℃ | pH逐渐减小 | 溶液中c(H+)逐渐增大,c(OH-)逐渐减小 |
| D | 恒温条件下,向两个锥形瓶中加入0.05g、表面积相同的镁条并塞紧瓶塞。然后用注射器分别注入2mL2mol·L-1的盐酸和醋酸,测量锥形瓶内气体压强随时间变化 | 反应结束时,两个锥形瓶内的气体的压强基本相等 | 过量的镁分别与体积相同、物质的量浓度相同的盐酸和醋酸反应时,生成的氢气体积相同 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】柠檬酸(用H3R表示)可用作酸洗剂。常温下,向0.1mol·L−1 H3R溶液中加入少量的NaOH固体(忽略溶液体积的变化),H3R、H2R−、HR2−和R3−的含量与pH的关系如图所示。下列正确的是
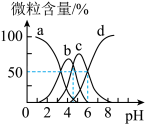

| A.图中b曲线表示HR2−的变化 |
| B.HR2−的电离常数Ka3=10−6 |
| C.pH=7时,c(Na+)=c(H2R−)+c(HR2−)+c(R3−) |
| D.pH=5时,c(H2R−)+c(HR2−)+c(R3−)=0.1mol·L−1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
真题
名校
【推荐2】能证明乙酸是弱酸的实验事实是
| A.CH3COOH溶液与Zn反应放出H2 |
| B.0.1 mol/L CH3COONa溶液的pH大于7 |
| C.CH3COOH溶液与Na2CO3反应生成CO2 |
| D.0.1 mol/L CH3COOH溶液可使紫色石蕊变红 |
您最近一年使用:0次



