化学的魅力之一来自于许许多多的“最”。例如熔点最高的金属是钨,硬度最大的金属是铬,密度最大的金属是锇……。根据下面的“最”回答问题:
(1)空气中含量最多的元素与原子核外电子数最少的元素组成的简单物质的电子式_______ ,该分子属
于___________ (填“极性”或“非极性”)分子。
(2)海水中含量最多的四种元素,除了O、H外,另外二种元素的原子半径由大到小的顺序
_____ (填元素符号),其中任意三种元素组成的物质中肯定含有的化学键是______ 键。
(3)就物理性质而言,第二周期原子序数最小的元素的单质是_________ 最小的金属,其相邻元素R的化学性质与地壳中含量最多的金属元素的化学性质相似,写出R的最高价氧化物对应水化物与NaOH溶液反应的化学方程式:______________________________ 。
(4)关于人体内含量最多的元素M和最硬非金属单质的组成元素N的说法中,正确的是___ 。
a.M和N组成的物质中,M显负价,故M的非金属性强于N
b.M的氢化物的熔沸点必定比N的氢化物的熔沸点高
c.M原子的核外电子云形状种类比N原子的核外电子云形状种类要多
d.M原子的核外未成对电子数和N原子的核外未成对电子数目相等
(1)空气中含量最多的元素与原子核外电子数最少的元素组成的简单物质的电子式
于
(2)海水中含量最多的四种元素,除了O、H外,另外二种元素的原子半径由大到小的顺序
(3)就物理性质而言,第二周期原子序数最小的元素的单质是
(4)关于人体内含量最多的元素M和最硬非金属单质的组成元素N的说法中,正确的是
a.M和N组成的物质中,M显负价,故M的非金属性强于N
b.M的氢化物的熔沸点必定比N的氢化物的熔沸点高
c.M原子的核外电子云形状种类比N原子的核外电子云形状种类要多
d.M原子的核外未成对电子数和N原子的核外未成对电子数目相等
2013·上海浦东新·二模 查看更多[2]
更新时间:2016-12-09 04:46:44
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】化学选修物质结构与性质某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,广泛用于陶瓷工业等领域。
(1)基态氮原子的核外电子排布式为________________ 。
(2)与N互为等电子体的离子有________ (任写一种)。
(3)工业上用氧化铝与氮气和碳在一定条件下反应生成X和CO,X的晶体结构如图所示,其化学式为_______ ,工业制备X的化学方程式为______________________ 。

(4)X晶体中包含的化学键类型为________ (填字母)。
X晶体中氮原子的杂化类型为________ 杂化。
(5)已知氮化硼与X晶体类型相同,且氮化硼的熔点比X高,可能的原因是
____________________________________________________________________ 。
(6)若X的密度为ρ g·cm-3,则晶体中最近的两个Al原子的距离为____________ cm。(阿伏加德罗常数的值用NA表示)
(1)基态氮原子的核外电子排布式为
(2)与N互为等电子体的离子有
(3)工业上用氧化铝与氮气和碳在一定条件下反应生成X和CO,X的晶体结构如图所示,其化学式为

(4)X晶体中包含的化学键类型为
| A.共价键 | B.配位键 | C.离子键 | D.金属键 |
X晶体中氮原子的杂化类型为
(5)已知氮化硼与X晶体类型相同,且氮化硼的熔点比X高,可能的原因是
(6)若X的密度为ρ g·cm-3,则晶体中最近的两个Al原子的距离为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表第四周期Ⅷ族,其基态原子中未成对电子个数为___________ 。
(2)基态Fe3+的核外电子排布式___________
(3)铁氧体是一种磁性材料,工业上制备时常采用水解法,制备时常加入尿素(CO(NH2)2)、醋酸钠等碱性物质。尿素分子中所含非金属元素的电负性由大到小的顺序是___________ ,分子中σ键与π键的数目之比为___________ 。醋酸钠中碳原子的杂化类型___________ 。
(4)铁氧体也可使用沉淀法,制备时常加入氨(NH3)、联氨(N2H4)等弱碱,已知氨(NH3熔点:-77.8%℃、沸点:-33.5%℃),联氨(N2H4熔点:2℃、沸点:113.5°C)解释其熔沸点高低的主要原因______________________ 。
(5)Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数为6,为确定钻的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,则第一种配合物的配体为___________ 。在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为___________ 。

(6)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如上图所示,则该物质的化学式为___________ 。若晶体密度为dg·cm-3,则晶胞中最近的两个碳原子的距离为___________ pm(阿伏伽德罗常数的值用NA表示,写出简化后的计算式即可)。
(1)钴位于元素周期表第四周期Ⅷ族,其基态原子中未成对电子个数为
(2)基态Fe3+的核外电子排布式
(3)铁氧体是一种磁性材料,工业上制备时常采用水解法,制备时常加入尿素(CO(NH2)2)、醋酸钠等碱性物质。尿素分子中所含非金属元素的电负性由大到小的顺序是
(4)铁氧体也可使用沉淀法,制备时常加入氨(NH3)、联氨(N2H4)等弱碱,已知氨(NH3熔点:-77.8%℃、沸点:-33.5%℃),联氨(N2H4熔点:2℃、沸点:113.5°C)解释其熔沸点高低的主要原因
(5)Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数为6,为确定钻的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,则第一种配合物的配体为

(6)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如上图所示,则该物质的化学式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】碳、氮、氧、氟、钙、铜等元素的化合物广泛存在于自然界,回答下列问题:
(1)将乙炔(C2H2)通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。乙炔分子中σ键与π键个数比值为___________ ,Cu+基态核外电子排布式为___________ ,[Cu(NH3)2]Cl中化学键类型为___________ 。
(2)NF3是微电子工业中优良的等离子刻蚀气体。元素第一电离能N___________ F(填“>”“<”或“=”),NF3中氮原子的杂化轨道类型为___________ ,NF3属于___________ 分子。(填“极性”或“非极性”)
(3)C60可以用作储氢材料。已知金刚石中C-C的键长为154.45pm,C60中C-C的键长为140~145pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确?理由是___________ 。
(4)氮的氧化物和含氧酸在医疗上具有重要的应用。写出与N2O互为等电子体的分子___________ (任写一种),酸性HNO3>HNO2,试着从结构上解释其原因___________ 。
(5)电石(CaC2)是有机合成化学工业的基本原料。CaC2晶体的晶胞结构与NaCl晶体相似(如图所示),但晶体中由于哑铃形C22-的存在,使晶胞沿一个方向拉长。CaC2晶体中每个Ca2+周围距离最近的C22-的数目为___________ ,已知CaC2晶体的密度为2.22g·cm-3,该晶胞的体积为___________ cm3。

(1)将乙炔(C2H2)通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。乙炔分子中σ键与π键个数比值为
(2)NF3是微电子工业中优良的等离子刻蚀气体。元素第一电离能N
(3)C60可以用作储氢材料。已知金刚石中C-C的键长为154.45pm,C60中C-C的键长为140~145pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确?理由是
(4)氮的氧化物和含氧酸在医疗上具有重要的应用。写出与N2O互为等电子体的分子
(5)电石(CaC2)是有机合成化学工业的基本原料。CaC2晶体的晶胞结构与NaCl晶体相似(如图所示),但晶体中由于哑铃形C22-的存在,使晶胞沿一个方向拉长。CaC2晶体中每个Ca2+周围距离最近的C22-的数目为

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】下表是元素周期表中的一部分。
根据A—J在周期表中的位置,用元素符号、化学式或反应式 回答下列问题:
(1)氧化性最强的单质是___ ,用一个化学反应证明H单质的氧化性强于G单质__________ 。
(2)A分别与F、G、H形成的简单化合物中,稳定性由强到弱的顺序为_________ 。
(3)B、C、G、H离子半径由大到小的顺序是_________ 。
(4)D单质可用来制造D—空气燃料电池,该电池通常以氯化钠或氢氧化钾溶液为电解质溶液,通入空气的电极为正极。若以氯化钠为电解质溶液时,正极的反应式为______ 。若以氢氧化钾溶液为电解质溶液时,电池的总反应式为____ 。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | A | |||||||
| 2 | E | F | G | H | J | |||
| 3 | B | C | D | I |
(1)氧化性最强的单质是
(2)A分别与F、G、H形成的简单化合物中,稳定性由强到弱的顺序为
(3)B、C、G、H离子半径由大到小的顺序是
(4)D单质可用来制造D—空气燃料电池,该电池通常以氯化钠或氢氧化钾溶液为电解质溶液,通入空气的电极为正极。若以氯化钠为电解质溶液时,正极的反应式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用元素符号或化学用语回答下列问题:
(1)下列事实能证明②的非金属性比⑦强的是_________ 。
A.Na2CO3+SiO2 Na2SiO3+CO2↑
Na2SiO3+CO2↑
B.SiO2+2C Si+2CO↑
Si+2CO↑
C.Na2SiO3+CO2+H2O = H2SiO3↓+Na2CO3
D.CH4比SiH4稳定
(2)①、④、⑤三种元素组成化合物所含化学键类型有_________________ 。
(3)④、⑤、⑥所形成的简单离子半径由大到小的顺序:______ 。(用元素符号表示)
(4)①、②、⑧三种元素按原子个数之比为11︰5︰1组成的有机化合物中含有两个-CH3的同分异构体有_____ 种。
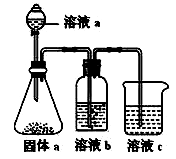
(5)某同学设计实验证明②、③、⑦的非金属性强弱关系。
①溶液a和b分别为_______________ ,_______________ 。
②溶液c中的离子方程式为______________________ 。
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
A.Na2CO3+SiO2
 Na2SiO3+CO2↑
Na2SiO3+CO2↑ B.SiO2+2C
 Si+2CO↑
Si+2CO↑C.Na2SiO3+CO2+H2O = H2SiO3↓+Na2CO3
D.CH4比SiH4稳定
(2)①、④、⑤三种元素组成化合物所含化学键类型有
(3)④、⑤、⑥所形成的简单离子半径由大到小的顺序:
(4)①、②、⑧三种元素按原子个数之比为11︰5︰1组成的有机化合物中含有两个-CH3的同分异构体有

(5)某同学设计实验证明②、③、⑦的非金属性强弱关系。
①溶液a和b分别为
②溶液c中的离子方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】回答下列问题:
(1)某元素原子的基态电子排布式为[Ar]3d104s24p1,该元素处于元素周期表的位置______ 。
(2)Ti基态原子的电子排布式为______ ,Ti元素位于____ 区,基态Ti原子核外有_____ 种不同运动状态的电子。
(3)铝原子核外电子云有_____ 种不同的伸展方向,其基态电子有_____ 种空间运动状态。
(4)基态Fe2+与Fe3+离子中未成对的电子数之比为______ 。与H2O分子互为等电子体一种阴离子为______ (填化学式)。
(1)某元素原子的基态电子排布式为[Ar]3d104s24p1,该元素处于元素周期表的位置
(2)Ti基态原子的电子排布式为
(3)铝原子核外电子云有
(4)基态Fe2+与Fe3+离子中未成对的电子数之比为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】依据原子结构知识回答下列问题。
(1)下列有关说法错误的是___________。
(2)基态V原子中具有___________ 种不同能量的电子,具有___________ 种不同空间运动状态的电子,具有___________ 种不同运动状态的电子。
(3)基态Cu原子的简化电子排布式为___________ ,基态Se原子的价电子轨道表示式为___________ ,基态Mn2+的价电子排布式为___________ 。
(1)下列有关说法错误的是___________。
| A.简单离子的还原性:P3->O2->F- |
| B.在元素周期表第二周期中元素原子的第一电离能介于硼和氮之间的元素有两种 |
| C.焰色试验与电子跃迁有关 |
| D.基态铝原子占据的最高能级的电子云轮廓图的形状为球形 |
(3)基态Cu原子的简化电子排布式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
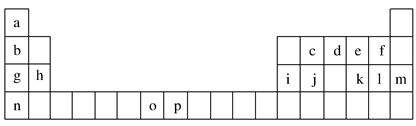
(1)元素p为26号元素,请写出其基态原子的电子排布式________________ 。
(2)d与a反应的产物的分子中,中心原子的杂化形式为________________ 。
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:________________________________________________ 。
(4)o、p两元素的部分电离能数据列于下表:
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是____________________________________ 。
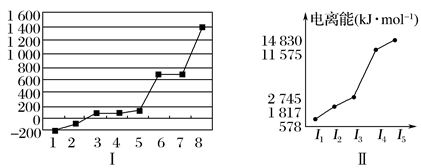
(5)第三周期8种元素按单质熔点高低的顺序如图Ⅰ所示,其中电负性最大的是________ (填图中的序号)。
(6)表中所列的某主族元素的电离能情况如图Ⅱ所示,则该元素是________ (填元素符号)。

(1)元素p为26号元素,请写出其基态原子的电子排布式
(2)d与a反应的产物的分子中,中心原子的杂化形式为
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:
(4)o、p两元素的部分电离能数据列于下表:
| 元素 | o | p | |
| 电离能/ (kJ·mol-1) | I1 | 717 | 759 |
| I2 | 1 509 | 1 561 | |
| I3 | 3 248 | 2 957 | |
(5)第三周期8种元素按单质熔点高低的顺序如图Ⅰ所示,其中电负性最大的是
(6)表中所列的某主族元素的电离能情况如图Ⅱ所示,则该元素是

您最近一年使用:0次
【推荐1】麻醉剂的发现和使用,是人类医疗史上了不起的一项成就,它可使患者在接受治疗时感觉不到疼痛。
(1)笑气是人类最早应用于医疗的麻醉剂之一,它可由NH4NO3在微热条件下分解产生,产物除N2O外还有一种,此反应的化学方程式为______________ 。有关理论认为N2O与CO2分子具有相似的结构(包括电子式),则其空间构型是_______ 型,N2O为_____________ 分子(极性或非极性)
(2)另一种常用麻醉剂氯仿,常因保存不慎而被氧化,产生剧毒光气(COCl2):2CHCl3+O2 2HCl+2COCl2,为了防止事故,使用前可用于检验氯仿是否变质的试剂是_________ 。
A.淀粉-碘化钾溶液 B.NaOH溶液 C.酚酞溶液 D.硝酸酸化的AgNO3溶液
(1)笑气是人类最早应用于医疗的麻醉剂之一,它可由NH4NO3在微热条件下分解产生,产物除N2O外还有一种,此反应的化学方程式为
(2)另一种常用麻醉剂氯仿,常因保存不慎而被氧化,产生剧毒光气(COCl2):2CHCl3+O2 2HCl+2COCl2,为了防止事故,使用前可用于检验氯仿是否变质的试剂是
A.淀粉-碘化钾溶液 B.NaOH溶液 C.酚酞溶液 D.硝酸酸化的AgNO3溶液
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】在极性分子中,正电荷重心同负电荷重心间的距离称偶极长,通常用d表示。极性分子的极性强弱同偶极长和正(或负)电荷重心的电量(q)有关,一般用偶极矩(μ)来衡量。分子的偶极矩定义为偶极长和偶极上一端电荷电量的乘积,即μ=d·q。试回答以下问题:
(1)HCl、CS2、H2S、SO2四种分子中μ=0的是__________________ ;
(2)实验测得:μ(PF3)=1.03、μ(BF3)=0。由此可知,PF3分子构型是___________________ ,BF3分子构型是 __________________ 。
(3)治癌药Pt(NH3)2Cl2具有平面四边形结构,Pt处在四边形中心,NH3和Cl分别处在四边形的4个角上。已知该化合物有两种异构体,A:棕黄色者μ>0,B:淡黄色者μ=0。在水中溶解度较大的是______________________ (填序号)。
(1)HCl、CS2、H2S、SO2四种分子中μ=0的是
(2)实验测得:μ(PF3)=1.03、μ(BF3)=0。由此可知,PF3分子构型是
(3)治癌药Pt(NH3)2Cl2具有平面四边形结构,Pt处在四边形中心,NH3和Cl分别处在四边形的4个角上。已知该化合物有两种异构体,A:棕黄色者μ>0,B:淡黄色者μ=0。在水中溶解度较大的是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】影响物质溶解性的因素
(1)外界因素:主要有_____ 、________ 等。
(2)氢键:溶剂和溶质之间的氢键作用力越大,溶解性越____ (填“好”或“差”)。
(3)分子结构的相似性:溶质和溶剂的分子结构相似程度越大,其溶解性越______ 。如乙醇与水______ ,而戊醇在水中的溶解度明显减小。
(4)溶质是否与水反应:溶质与水发生反应,溶质的溶解度会______ 。如SO2与水反应生成的H2SO3可溶于水,故SO2的溶解度_____ 。
(1)外界因素:主要有
(2)氢键:溶剂和溶质之间的氢键作用力越大,溶解性越
(3)分子结构的相似性:溶质和溶剂的分子结构相似程度越大,其溶解性越
(4)溶质是否与水反应:溶质与水发生反应,溶质的溶解度会
您最近一年使用:0次



