如图1所示,某同学设计燃料电池并探究氯碱工业原理的相美问题,其中乙装置中X为阳离子交换膜。
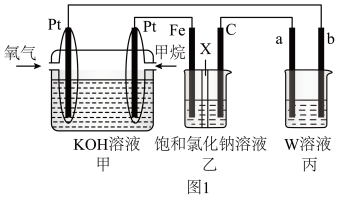
(1)石墨电极(C)作_________ 极,甲中甲烷燃料电池的负极反应式为_________ 。
(2)若在标准状况下,有 氧气参加反应,则乙装置中C电极上生成气体的物质的量为
氧气参加反应,则乙装置中C电极上生成气体的物质的量为_________  。
。
(3)若W为 溶液,欲用丙装置给铜镀银,b电极应是
溶液,欲用丙装置给铜镀银,b电极应是_________ (填化学式)。
(4)若丙中以 溶液为电解质溶液进行粗铜(含
溶液为电解质溶液进行粗铜(含 、
、 、
、 、
、 、
、 等杂质)的电解精炼,下列说法正确的是_________(填字母)。
等杂质)的电解精炼,下列说法正确的是_________(填字母)。
(5)化学在环境保护中起十分重要的作用,电化学降解法可用于治理水中硝酸盐污染,电化学降解 的原理如图2所示。
的原理如图2所示。

①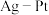 电极上的电极反应式为
电极上的电极反应式为_________ 。
②若电解过程中转移了 电子,则膜两侧电解液的质量变化差
电子,则膜两侧电解液的质量变化差 为
为_________ 。

(1)石墨电极(C)作
(2)若在标准状况下,有
 氧气参加反应,则乙装置中C电极上生成气体的物质的量为
氧气参加反应,则乙装置中C电极上生成气体的物质的量为 。
。(3)若W为
 溶液,欲用丙装置给铜镀银,b电极应是
溶液,欲用丙装置给铜镀银,b电极应是(4)若丙中以
 溶液为电解质溶液进行粗铜(含
溶液为电解质溶液进行粗铜(含 、
、 、
、 、
、 、
、 等杂质)的电解精炼,下列说法正确的是_________(填字母)。
等杂质)的电解精炼,下列说法正确的是_________(填字母)。| A.a电极为纯铜 | B.粗铜接电源正极,发生还原反应 |
C.溶液中 的浓度保持不变 的浓度保持不变 | D.利用阳极泥可回收 、 、 、 、 等金属 等金属 |
 的原理如图2所示。
的原理如图2所示。
①
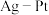 电极上的电极反应式为
电极上的电极反应式为②若电解过程中转移了
 电子,则膜两侧电解液的质量变化差
电子,则膜两侧电解液的质量变化差 为
为
更新时间:2022-12-05 19:05:52
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】合成氨是人类科学技术上的一项重大突破,氨有广泛的应用。
已知:
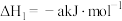

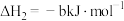
(1)有研究报道,在常温、常压、光照条件下, 在特殊催化剂表面与
在特殊催化剂表面与 反应可生成
反应可生成 。则由
。则由 与
与 反应生成
反应生成 的热化学方程式是
的热化学方程式是___________ 。
(2)工业上主要以 、
、 为原料气合成
为原料气合成 。
。
①将物质的量之比为1:3的 和
和 充入2L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:
充入2L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:
该条件下 的转化率为
的转化率为___________ ,平衡常数
___________ (可用分数表示)。
②若按以下浓度投料,其它反应条件与①相同,起始时反应进行的方向为___________ (填“正向”、“逆向”或“无法判断”)。
③L( 、
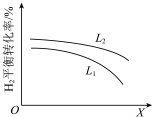
、 )、X可分别代表压强或温度。下图表示L一定时,合成氨反应中
)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中 的平衡转化率随X的变化关系。
的平衡转化率随X的变化关系。
i.X代表的物理量是___________ 。
ii. 、
、 的大小关系:
的大小关系:
___________  (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
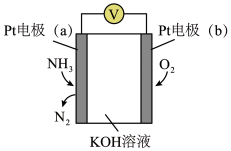
(3)电化学气敏传感器可用于检测环境中 的含量,其工作原理如图所示,则a极的电极反应式为
的含量,其工作原理如图所示,则a极的电极反应式为___________ 。
已知:

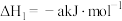

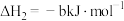
(1)有研究报道,在常温、常压、光照条件下,
 在特殊催化剂表面与
在特殊催化剂表面与 反应可生成
反应可生成 。则由
。则由 与
与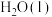 反应生成
反应生成 的热化学方程式是
的热化学方程式是(2)工业上主要以
 、
、 为原料气合成
为原料气合成 。
。①将物质的量之比为1:3的
 和
和 充入2L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:
充入2L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:| 物质 |  |  |  |
| 平衡时物质的量/mol | 0.2 | 0.6 | 0.2 |
 的转化率为
的转化率为
②若按以下浓度投料,其它反应条件与①相同,起始时反应进行的方向为
| 物质 |  |  |  |
| 起始浓度(mol/L) | 0.5 | 1.5 | 0.5 |
 、
、 )、X可分别代表压强或温度。下图表示L一定时,合成氨反应中
)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中 的平衡转化率随X的变化关系。
的平衡转化率随X的变化关系。i.X代表的物理量是
ii.
 、
、 的大小关系:
的大小关系:
 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
(3)电化学气敏传感器可用于检测环境中
 的含量,其工作原理如图所示,则a极的电极反应式为
的含量,其工作原理如图所示,则a极的电极反应式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素。已知A、C及B、E分别是同主族元素,且B、E两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍。处于同周期的C、D、E元素中,D是该周期金属元素中金属性最弱的元素。
(1)试比较C、D两元素最高价氧化物对应水化物碱性的强弱(填化学式)______ >_______ ;
(2) A、B、C形成的化合物的晶体类型为__________ ;电子式为__________ ;
(3)写出D单质与C元素最高价氧化物对应水化物反应的离子方程式___________ ;
(4)写出两种均含A、B、C、E四种元素的化合物在溶液中相互反应、且生成气体的离子方程式_________________________ ;
(5)A单质和B单质能构成电池,该电池用多孔惰性电极浸入浓KOH溶液,两极分别通入A单质和B单质,写出该电池负极电极反应方程式_______________ ;
(6)通常条件下,C的最高价氧化物对应水化物2mol与E最高价氧化物对应水化物1mol的稀溶液间反应放出的热量为114.6kJ,试写出表示该热量变化的离子方程式__________ 。
(1)试比较C、D两元素最高价氧化物对应水化物碱性的强弱(填化学式)
(2) A、B、C形成的化合物的晶体类型为
(3)写出D单质与C元素最高价氧化物对应水化物反应的离子方程式
(4)写出两种均含A、B、C、E四种元素的化合物在溶液中相互反应、且生成气体的离子方程式
(5)A单质和B单质能构成电池,该电池用多孔惰性电极浸入浓KOH溶液,两极分别通入A单质和B单质,写出该电池负极电极反应方程式
(6)通常条件下,C的最高价氧化物对应水化物2mol与E最高价氧化物对应水化物1mol的稀溶液间反应放出的热量为114.6kJ,试写出表示该热量变化的离子方程式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】回答下列问题:
(1)已知:①4NH3(g)+6NO(g)=5N2(g)+6H2O(g) △H1=-1812.0kJ•mol-1,②4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H2=-1269.0kJ•mol-1,则NH3(g)与O2(g)反应生成NO(g)和H2O(g)的热化学方程式为______ 。
(2)在一定温度和适当催化剂存在下,将1molCO、2molH2充入2L恒容密闭容器中,使其发生反应CO(g)+2H2(g) CH3OH(g) △H=-91kJ•mol-1,测得开始时容器内总压为3×105Pa,2min末达平衡时,c(CH3OH)=0.2mol•L-1。
CH3OH(g) △H=-91kJ•mol-1,测得开始时容器内总压为3×105Pa,2min末达平衡时,c(CH3OH)=0.2mol•L-1。
①0~2min内,平均反应速率v(H2)=_____ mol•L-1•min-1,平衡时CH3OH的体积分数为_____ %(计算结果保留2位小数,下同)。
②该温度下的分压平衡常数Kp=______ Pa-2(分压=总压×物质的量分数)。
③该反应在______ (填“高温”“低温”或“任何温度”)下能自发进行。
(3)工业上可用氨水除去尾气中SO2,常温下,将SO2通入氨水中,当溶液显中性时,溶液中 =
=_____ (常温下H2SO3的电离平衡常数Ka1=1.4×10-2,Ka2=1.2×10-8)。
(4)甲醇碱性燃料电池原理如图所示:

①Y电极为______ 极,X电极的电极反应式为______ 。
②用该燃料电池做电源,电解足量硫酸铜溶液(电极均为惰性电极)。当某极析出9.6g红色固体时,理论上消耗甲醇的质量为______ g。
(1)已知:①4NH3(g)+6NO(g)=5N2(g)+6H2O(g) △H1=-1812.0kJ•mol-1,②4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H2=-1269.0kJ•mol-1,则NH3(g)与O2(g)反应生成NO(g)和H2O(g)的热化学方程式为
(2)在一定温度和适当催化剂存在下,将1molCO、2molH2充入2L恒容密闭容器中,使其发生反应CO(g)+2H2(g)
 CH3OH(g) △H=-91kJ•mol-1,测得开始时容器内总压为3×105Pa,2min末达平衡时,c(CH3OH)=0.2mol•L-1。
CH3OH(g) △H=-91kJ•mol-1,测得开始时容器内总压为3×105Pa,2min末达平衡时,c(CH3OH)=0.2mol•L-1。①0~2min内,平均反应速率v(H2)=
②该温度下的分压平衡常数Kp=
③该反应在
(3)工业上可用氨水除去尾气中SO2,常温下,将SO2通入氨水中,当溶液显中性时,溶液中
 =
=(4)甲醇碱性燃料电池原理如图所示:

①Y电极为
②用该燃料电池做电源,电解足量硫酸铜溶液(电极均为惰性电极)。当某极析出9.6g红色固体时,理论上消耗甲醇的质量为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】合成氨对人类的生存和发展有着重要意义,1909年哈伯在实验室中首次利用氮气与氢气反应合成氨,实现了人工固氮。
(1)反应N2(g)+3H2(g) 2NH3(g)的化学平衡常数表达式为
2NH3(g)的化学平衡常数表达式为_____ 。
(2)请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是_____ 。
(3)对于反应N2(g)+3H2(g) 2NH3(g)在一定条件下氨的平衡含量如下表。
2NH3(g)在一定条件下氨的平衡含量如下表。
①该反应为_____ (填“吸热”或“放热”)反应。
②其他条件不变时,温度升高氨的平衡含量减小的原因是_____ (填字母序号)。
A.温度升高,正反应速率减小,逆反应速率增大,平衡逆向移动
B.温度升高,K变小。平衡逆向移动
C.温度升高,活化分子数增多,反应速率加快
(4)在合成氨工业中,原料气(N2、H2及少量CO、NH3混合气)在进入合成塔前需经过铜氨液处理,目的是除去其中的CO,其反应为: [CuNH3)2]++CO+NH3 [Cu(NH3)3CO]+ΔH<0,则利用铜氨液吸收CO适宜的生产条件是
[Cu(NH3)3CO]+ΔH<0,则利用铜氨液吸收CO适宜的生产条件是_________ 。
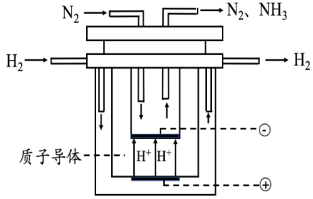
(5)科学家持续探索,寻求合成氨的新路径。如图为电解法合成氨的原理示意图,阴极的电极反应式为_____ 。
(1)反应N2(g)+3H2(g)
 2NH3(g)的化学平衡常数表达式为
2NH3(g)的化学平衡常数表达式为(2)请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是
| 序号 | 化学反应 | K(298K)的数值 |
| ① | N2(g)+O2(g) 2NO(g) 2NO(g) | 5×10-31 |
| ② | N2(g)+3H2(g) 2NH3(g) 2NH3(g) | 4.1×106 |
 2NH3(g)在一定条件下氨的平衡含量如下表。
2NH3(g)在一定条件下氨的平衡含量如下表。| 温度/°C | 压强MPa | 氨的平衡含量 |
| 200 | 10 | 81.5% |
| 550 | 10 | 8.25% |
②其他条件不变时,温度升高氨的平衡含量减小的原因是
A.温度升高,正反应速率减小,逆反应速率增大,平衡逆向移动
B.温度升高,K变小。平衡逆向移动
C.温度升高,活化分子数增多,反应速率加快
(4)在合成氨工业中,原料气(N2、H2及少量CO、NH3混合气)在进入合成塔前需经过铜氨液处理,目的是除去其中的CO,其反应为: [CuNH3)2]++CO+NH3
 [Cu(NH3)3CO]+ΔH<0,则利用铜氨液吸收CO适宜的生产条件是
[Cu(NH3)3CO]+ΔH<0,则利用铜氨液吸收CO适宜的生产条件是(5)科学家持续探索,寻求合成氨的新路径。如图为电解法合成氨的原理示意图,阴极的电极反应式为

您最近一年使用:0次
【推荐2】含氮化合物是化工、能源、环保等领域的研究热点。回答下列问题:
 如图所示为利用
如图所示为利用 和空气中的
和空气中的 以LDH超薄纳米为催化剂在光催化作用下合成氨的原理:
以LDH超薄纳米为催化剂在光催化作用下合成氨的原理:

已知:
 ;
;
Ⅱ
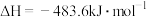 ;
;
则上述合成氨的热化学方程式为____________ 。
 合成尿素
合成尿素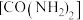 的反应为
的反应为
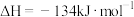 。向恒容密闭容器中按物质的量之比
。向恒容密闭容器中按物质的量之比 充入
充入 和
和 ,使反应进行,保持温度不变,测得
,使反应进行,保持温度不变,测得 的转化率随时间的变化情况如图所示:
的转化率随时间的变化情况如图所示:

 若用
若用 的浓度变化表示反应速率,则A点的逆反应速率
的浓度变化表示反应速率,则A点的逆反应速率__________ B点的正反应速率 填“
填“ ”“
”“ ”或“
”或“ ”
” 。
。
 下列叙述中不能说明该反应达到平衡状态的是
下列叙述中不能说明该反应达到平衡状态的是_______  填选项字母
填选项字母 。
。
A.体系压强不再变化
B.气体平均摩尔质量不再变化
C. 的消耗速率和
的消耗速率和 的消耗速率之比为
的消耗速率之比为
D.固体质量不再发生变化
 工业上合成尿素时,既能加快反应速率,又能提高原料利用率的措施有
工业上合成尿素时,既能加快反应速率,又能提高原料利用率的措施有______  填选项字母
填选项字母 。
。
A.升高温度 加入催化剂 C.将尿素及时分离出去
加入催化剂 C.将尿素及时分离出去  增大反应体系的压强
增大反应体系的压强
 汽车尾气已成为许多大城市空气的主要污染源,其中存在大量NO。实验发现,NO易发生二聚反应
汽车尾气已成为许多大城市空气的主要污染源,其中存在大量NO。实验发现,NO易发生二聚反应 并快速达到平衡。向真空钢瓶中充入一定量的NO进行反应,测得温度分别为
并快速达到平衡。向真空钢瓶中充入一定量的NO进行反应,测得温度分别为 和
和 时NO的转化率随时间变化的结果如图所示:
时NO的转化率随时间变化的结果如图所示:

 温度为
温度为 时,达到平衡时体系的总压强为
时,达到平衡时体系的总压强为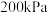 ,X点
,X点 的物质的量分数为
的物质的量分数为_______  保留三位有效数字
保留三位有效数字 ,X点对应的平衡常数
,X点对应的平衡常数
______ 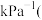 用分压表示,保留小数点后三位
用分压表示,保留小数点后三位 ;提高NO平衡转化率的条件为
;提高NO平衡转化率的条件为______  任写两点
任写两点 。
。
 如图所示,利用电解原理,可将废气中的NO转化为
如图所示,利用电解原理,可将废气中的NO转化为 ,阳极的电极反应式为
,阳极的电极反应式为______________ ,通入 的目的是
的目的是_________ 。

 如图所示为利用
如图所示为利用 和空气中的
和空气中的 以LDH超薄纳米为催化剂在光催化作用下合成氨的原理:
以LDH超薄纳米为催化剂在光催化作用下合成氨的原理:
已知:

 ;
;Ⅱ

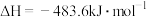 ;
;则上述合成氨的热化学方程式为
 合成尿素
合成尿素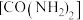 的反应为
的反应为
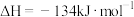 。向恒容密闭容器中按物质的量之比
。向恒容密闭容器中按物质的量之比 充入
充入 和
和 ,使反应进行,保持温度不变,测得
,使反应进行,保持温度不变,测得 的转化率随时间的变化情况如图所示:
的转化率随时间的变化情况如图所示:
 若用
若用 的浓度变化表示反应速率,则A点的逆反应速率
的浓度变化表示反应速率,则A点的逆反应速率 填“
填“ ”“
”“ ”或“
”或“ ”
” 。
。 下列叙述中不能说明该反应达到平衡状态的是
下列叙述中不能说明该反应达到平衡状态的是 填选项字母
填选项字母 。
。A.体系压强不再变化
B.气体平均摩尔质量不再变化
C.
 的消耗速率和
的消耗速率和 的消耗速率之比为
的消耗速率之比为
D.固体质量不再发生变化
 工业上合成尿素时,既能加快反应速率,又能提高原料利用率的措施有
工业上合成尿素时,既能加快反应速率,又能提高原料利用率的措施有 填选项字母
填选项字母 。
。A.升高温度
 加入催化剂 C.将尿素及时分离出去
加入催化剂 C.将尿素及时分离出去  增大反应体系的压强
增大反应体系的压强 汽车尾气已成为许多大城市空气的主要污染源,其中存在大量NO。实验发现,NO易发生二聚反应
汽车尾气已成为许多大城市空气的主要污染源,其中存在大量NO。实验发现,NO易发生二聚反应 并快速达到平衡。向真空钢瓶中充入一定量的NO进行反应,测得温度分别为
并快速达到平衡。向真空钢瓶中充入一定量的NO进行反应,测得温度分别为 和
和 时NO的转化率随时间变化的结果如图所示:
时NO的转化率随时间变化的结果如图所示:
 温度为
温度为 时,达到平衡时体系的总压强为
时,达到平衡时体系的总压强为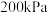 ,X点
,X点 的物质的量分数为
的物质的量分数为 保留三位有效数字
保留三位有效数字 ,X点对应的平衡常数
,X点对应的平衡常数
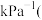 用分压表示,保留小数点后三位
用分压表示,保留小数点后三位 ;提高NO平衡转化率的条件为
;提高NO平衡转化率的条件为 任写两点
任写两点 。
。 如图所示,利用电解原理,可将废气中的NO转化为
如图所示,利用电解原理,可将废气中的NO转化为 ,阳极的电极反应式为
,阳极的电极反应式为 的目的是
的目的是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】我国科学家研发的“液态阳光”计划通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢制备甲醇。
(1)制备甲醇主反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-48.7kJ/mol。
CH3OH(g)+H2O(g)△H=-48.7kJ/mol。
该过程中还存在一个生成CO的副反应,结合反应:CO(g)+2H2(g)=CH3OH(g)△H=-90.0kJ/mol
写出该副反应的热化学方程式:_______ 。
(2)将CO2和H2按物质的量比1:3混合,以固定流速通过盛放Cu/Zn/A/Zr催化剂的反应器,在相同时间内,不同温度下的实验数据如图所示。 。
。
①催化剂活性最好的温度为_______ 。
a.483K b.503 K c.1523 K d.543 K
②温度由523K升到543K,CO2的平衡转化率和CH3OH的实验产率均降低,解释原因:_______ 。
(3)使用Cu2O-ZnO薄膜电极作阴极,通过电催化法将二氧化碳转化为甲醇。
①将铜箔放入煮沸的饱和磕酸铜溶液中,制得Cu2O薄膜电极。反应的离子方程式为_______ 。
②用Cu2O薄膜电极作阴极,Zn(NO3)2溶液作电解液,采用电沉积法制备Cu2O-ZnO薄膜电极,制备完成后电解液中检测到了 制备ZnO薄膜的电极反应式为
制备ZnO薄膜的电极反应式为_______ 。
(1)制备甲醇主反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H=-48.7kJ/mol。
CH3OH(g)+H2O(g)△H=-48.7kJ/mol。该过程中还存在一个生成CO的副反应,结合反应:CO(g)+2H2(g)=CH3OH(g)△H=-90.0kJ/mol
写出该副反应的热化学方程式:
(2)将CO2和H2按物质的量比1:3混合,以固定流速通过盛放Cu/Zn/A/Zr催化剂的反应器,在相同时间内,不同温度下的实验数据如图所示。

 。
。①催化剂活性最好的温度为
a.483K b.503 K c.1523 K d.543 K
②温度由523K升到543K,CO2的平衡转化率和CH3OH的实验产率均降低,解释原因:
(3)使用Cu2O-ZnO薄膜电极作阴极,通过电催化法将二氧化碳转化为甲醇。
①将铜箔放入煮沸的饱和磕酸铜溶液中,制得Cu2O薄膜电极。反应的离子方程式为
②用Cu2O薄膜电极作阴极,Zn(NO3)2溶液作电解液,采用电沉积法制备Cu2O-ZnO薄膜电极,制备完成后电解液中检测到了
 制备ZnO薄膜的电极反应式为
制备ZnO薄膜的电极反应式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】铂是重要的催化剂和吸氢材料,广泛用于新能源和化工行业。一种以电解精炼铜的阳极泥(含Pt、Au、Ag及少量有机物)为原料生产海绵Pt及Au的工艺流程如下:

回答下列问题:
(1)电解精炼铜时阴极的电极反应式为___________ 。
(2)“焙烧”的主要目的是___________ ,“操作Ⅰ”为___________ 。
(3)已知“滤液Ⅰ”主要含HAuCl4、H2PtCl6,且二者均为强酸。HAuCl4中金元素化合价为___________ ,H2PtCl6的电离方程式为___________ 。
(4)“沉金”的化学反应方程式为___________ 。
(5)“沉铂”中,生成(NH4)2PtCl6的沉淀率随温度的变化曲线如图所示,结合平衡移动原理解释升高温度,(NH4)2PtCl6沉淀率升高的主要原因___________ 。

(6)“灼烧”时发生分解反应的化学方程式为___________ 。

回答下列问题:
(1)电解精炼铜时阴极的电极反应式为
(2)“焙烧”的主要目的是
(3)已知“滤液Ⅰ”主要含HAuCl4、H2PtCl6,且二者均为强酸。HAuCl4中金元素化合价为
(4)“沉金”的化学反应方程式为
(5)“沉铂”中,生成(NH4)2PtCl6的沉淀率随温度的变化曲线如图所示,结合平衡移动原理解释升高温度,(NH4)2PtCl6沉淀率升高的主要原因

(6)“灼烧”时发生分解反应的化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】图甲为甲烷燃料电池,图乙是在铜钥匙上镀银,图丙是电解精炼铜(粗铜中只含银、铜和锌),请回答下列问题:
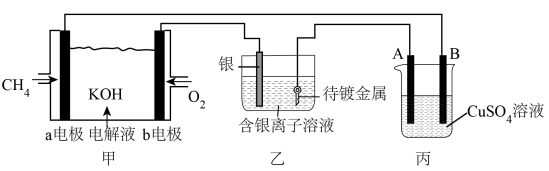
(1)甲装置中a极发生_______ 反应(填“氧化”、“还原”),电极反应式为_______ 。电解质溶液中OH-从_______ 极移向_______ 极(填“a、b”)。
(2)丙装置中A电极上发生的电极反应有_______ 、_______ 。溶液中c(Cu2+)_______ (填“变大”、“变小”或“不变”。)
(3)乙装置电解质溶液中c(Ag+)_______ (填“变大”、“变小”或“不变”。)
(4)如果利用甲电池给铅蓄电池充电,阳极的电极反应式为_______ 。 (已知铅蓄电池的工作原理为: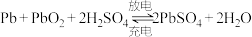 )
)

(1)甲装置中a极发生
(2)丙装置中A电极上发生的电极反应有
(3)乙装置电解质溶液中c(Ag+)
(4)如果利用甲电池给铅蓄电池充电,阳极的电极反应式为
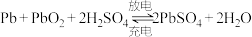 )
)
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧铜片回收Cu并制备绿矾晶体的部分实验过程如下:

已知: I2+2S2O =S4O
=S4O +2I-
+2I-
(1)①铜片溶解时加入H2O2的作用是___________ (用化学方程式表示)
②铜片溶解完全后,需将溶液中过量的H2O2除去。除去H2O2的简便方法是___________
(2)某学习小组用“间接碘量法”测定试样A中Cu2+ (不含能与I- 发生反应的杂质)的浓度。过程如下:取20.00mL试样于锥形瓶中,加入过量KI.固体,充分反应,生成白色沉淀。用0.1000mol/L的Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液10.00 mL。
①可选用___________ 作滴定指示剂,滴定终点的现象是___________
②CuCl2溶液与KI反应的离子方程式为___________
③试样A中c(Cu2+)为___________ mol/L
(3)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、 Au等杂质)的电解精炼,下列说法正确的是___________
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(4)①从滤液B中制取绿矾晶体的实验操作为___________
②某溶液中c(Fe3+)= 0.100mol/L, c(Cu2+)= 0.200mol/L。要实现Fe3+沉淀完全而Cu2+保持不变,可控制溶液pH范围为___________

已知: I2+2S2O
 =S4O
=S4O +2I-
+2I-| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2 ×10-20 | 4.0 ×10-38 | 1.7 ×10-7 | 1.3 ×10-12 |
(1)①铜片溶解时加入H2O2的作用是
②铜片溶解完全后,需将溶液中过量的H2O2除去。除去H2O2的简便方法是
(2)某学习小组用“间接碘量法”测定试样A中Cu2+ (不含能与I- 发生反应的杂质)的浓度。过程如下:取20.00mL试样于锥形瓶中,加入过量KI.固体,充分反应,生成白色沉淀。用0.1000mol/L的Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液10.00 mL。
①可选用
②CuCl2溶液与KI反应的离子方程式为
③试样A中c(Cu2+)为
(3)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、 Au等杂质)的电解精炼,下列说法正确的是
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(4)①从滤液B中制取绿矾晶体的实验操作为
②某溶液中c(Fe3+)= 0.100mol/L, c(Cu2+)= 0.200mol/L。要实现Fe3+沉淀完全而Cu2+保持不变,可控制溶液pH范围为
您最近一年使用:0次
【推荐1】某兴趣小组在实验室探究用石墨做电极电解饱和氯化铜溶液。

(1)在阳极区观察到的现象与预期一致,现象是_______ ,检验该物质的方法是_______ 。
(2)电解2分钟后阴极碳棒上出现少量的红色物质,且阴极区碳棒周围的溶液颜色变成黑色。持续电解20分钟后,U形管阴极区最上面覆盖一层白色的薄膜,薄膜下层有约1cm厚度的黑色溶液,黑色溶液下是深绿色溶液。电解50分钟后,关闭电源,发现上层薄膜增厚,阴极碳棒表面呈白色,碳棒下端有红色物质附着。取出阴极碳棒放置一晚后碳棒表面白色固体变成绿色。
理论分析:
①假设一:黑色物质可能是氧化铜。理论依据是_______ 。
②假设二:黑色物质可能是纳米铜粉。查阅资料知纳米铜粉为紫黑色粉末,电解析出铜过快,没来得及析出在电极上,所以液体显黑色。
③假设三:黑色物质可能是碱式氯化铜。产生的原因是铜离子水解:4Cu2++6H2O+2Cl-=Cu4(OH)6Cl2+6H+,碱式氯化铜是墨绿色能溶于稀酸,颜色太深看上去像黑色。
(3)实验验证:取2mL黑色液体于试管中,加入2mL12mol/L的浓盐酸,充分振荡、静置后,离心分离发现溶液颜色是无色,黑色物质没有溶解,证明假设二成立,请另设计实验证明黑色物质是单质铜_______ 。
(4)理论分析和实验证明,阴极区产生的“白色薄膜”是氯化亚铜,写出产生该物质的电极反应式_______ ;该物质在空气中长时间放置变成绿色物质Cu(OH)Cl的化学方程式是_______ 。
(5)该小组同学在老师指导下反复实验,氯化铜溶液的浓度控制在10%左右时,实验现象与预期的现象完全一致。电解时用铅蓄电池提供电能,若电解得到ag铜,理论上消耗硫酸的质量是_______ g。

(1)在阳极区观察到的现象与预期一致,现象是
(2)电解2分钟后阴极碳棒上出现少量的红色物质,且阴极区碳棒周围的溶液颜色变成黑色。持续电解20分钟后,U形管阴极区最上面覆盖一层白色的薄膜,薄膜下层有约1cm厚度的黑色溶液,黑色溶液下是深绿色溶液。电解50分钟后,关闭电源,发现上层薄膜增厚,阴极碳棒表面呈白色,碳棒下端有红色物质附着。取出阴极碳棒放置一晚后碳棒表面白色固体变成绿色。
理论分析:
①假设一:黑色物质可能是氧化铜。理论依据是
②假设二:黑色物质可能是纳米铜粉。查阅资料知纳米铜粉为紫黑色粉末,电解析出铜过快,没来得及析出在电极上,所以液体显黑色。
③假设三:黑色物质可能是碱式氯化铜。产生的原因是铜离子水解:4Cu2++6H2O+2Cl-=Cu4(OH)6Cl2+6H+,碱式氯化铜是墨绿色能溶于稀酸,颜色太深看上去像黑色。
(3)实验验证:取2mL黑色液体于试管中,加入2mL12mol/L的浓盐酸,充分振荡、静置后,离心分离发现溶液颜色是无色,黑色物质没有溶解,证明假设二成立,请另设计实验证明黑色物质是单质铜
(4)理论分析和实验证明,阴极区产生的“白色薄膜”是氯化亚铜,写出产生该物质的电极反应式
(5)该小组同学在老师指导下反复实验,氯化铜溶液的浓度控制在10%左右时,实验现象与预期的现象完全一致。电解时用铅蓄电池提供电能,若电解得到ag铜,理论上消耗硫酸的质量是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关。SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)反应过程能量变化如图所示:
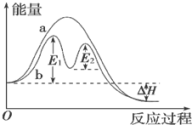
下列说法正确的是_____ 。
A.反应过程a有催化剂参与
B.该反应为放热反应,热效应等于ΔH
C.改变催化剂,能改变该反应的活化能和反应热
D.有催化剂条件下,反应的活化能等于E1
(2)已知:CH3OH、H2的燃烧热(ΔH)分别为﹣726.5kJ/mol、﹣285.8kJ/mol,则常温下CO2和H2反应生成CH3OH和H2O的热化学方程式是______________ 。
(3)工业上还可以通过下列反应制备甲醇:CO(g)+2H2(g) CH3OH(g)。在一容积可变的密闭容器 中充入10mol CO和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。
CH3OH(g)。在一容积可变的密闭容器 中充入10mol CO和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。
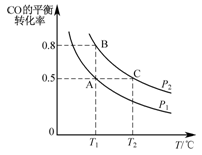
①下列说法不能判断该反应达到化学平衡状态的是_________ (填字母)。
a.H2的消耗速率等于CH3OH的生成速率的2倍
b.H2的体积分数不再改变
c.体系中H2的转化率和CO的转化率相等
d.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA____ PB(填“>、<或=”)。
③若达到化学平衡状态A时,容器的体积为20 L。如果反应开始时仍充入10molCO和20molH2,则在平衡状态B时容器的体积V(B)=____ L。
(4)SO2在一定条件下可与氧气构成原电池。下图是利用该电池在铁表面镀银的装置示意图:

①该电池的负极反应式是___________________ 。
②当甲中消耗标况下1.12L氧气时,乙中_____ 极(填a或b)增重_____ g。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)反应过程能量变化如图所示:

下列说法正确的是
A.反应过程a有催化剂参与
B.该反应为放热反应,热效应等于ΔH
C.改变催化剂,能改变该反应的活化能和反应热
D.有催化剂条件下,反应的活化能等于E1
(2)已知:CH3OH、H2的燃烧热(ΔH)分别为﹣726.5kJ/mol、﹣285.8kJ/mol,则常温下CO2和H2反应生成CH3OH和H2O的热化学方程式是
(3)工业上还可以通过下列反应制备甲醇:CO(g)+2H2(g)
 CH3OH(g)。在一容积可变的密闭容器 中充入10mol CO和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。
CH3OH(g)。在一容积可变的密闭容器 中充入10mol CO和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。
①下列说法不能判断该反应达到化学平衡状态的是
a.H2的消耗速率等于CH3OH的生成速率的2倍
b.H2的体积分数不再改变
c.体系中H2的转化率和CO的转化率相等
d.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA
③若达到化学平衡状态A时,容器的体积为20 L。如果反应开始时仍充入10molCO和20molH2,则在平衡状态B时容器的体积V(B)=
(4)SO2在一定条件下可与氧气构成原电池。下图是利用该电池在铁表面镀银的装置示意图:

①该电池的负极反应式是
②当甲中消耗标况下1.12L氧气时,乙中
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:

(1)若两池中电解质溶液均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的________ 棒,乙池中的________ 棒。
②乙池中阳极的电极反应式是_________________________________________________ 。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式_____________________________________________ 。
②甲池中碳极上电极反应式是_________________________________________________ ,
乙池中碳极上电极反应属于________ (填“氧化反应”或“还原反应”)。
③若乙池转移0.02 mol e-后停止实验,池中溶液体积是200 mL,则溶液混匀后的c(OH--)=________ 。

(1)若两池中电解质溶液均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的
②乙池中阳极的电极反应式是
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式
②甲池中碳极上电极反应式是
乙池中碳极上电极反应属于
③若乙池转移0.02 mol e-后停止实验,池中溶液体积是200 mL,则溶液混匀后的c(OH--)=
您最近一年使用:0次



