已知K3[Fe(CN)6]溶液遇 Fe2+生成蓝色沉淀,可检验溶液中的Fe2+。某实验小组测定菠菜和黑木耳中的铁元素。实验如下:
I.水煮菠菜(铁元素主要以难溶的 FeC2O4形式存在)检验法:

II.灼烧检验法:
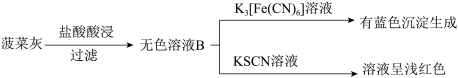
(1)操作i中起分离作用的仪器名称为_______ ;溶液A中未能检测出Fe2+的可能原因是_______ 。
(2)甲同学取少量无色溶液B,滴加酸性KMnO4溶液,振荡后,溶液紫色消失,因此得出结论,溶液B含有Fe2+。乙同学认为甲同学的实验方法不严谨,理由是_______ 。
有研究表明,黑木耳中铁的含量约为13.93mg/100g,是菠菜含铁量的10倍以上。
III.测定木耳铁中元素含量。
(3)称取2.00g干黑木耳置于_______ (填仪器名称)中灼烧。经过一系列操作后配制成100mL待测液。过程中,用到盐酸羟胺(在溶液中可完全电离出NH3OH+与Cl-)将溶液中Fe3+还原Fe2+,同时产生一种无污染的气体。该反应的离子方程式为_______ ;配制100mL一定物质的量浓度的酸性高锰酸钾溶液时,所需要的玻璃仪器除量筒、玻璃棒、烧杯外还有_______ 。
(4)从配制的待测液中取出10mL,利用吸光度法测得其吸光度为0.400(吸光度与Fe2+的浓度关系如下图所示)。试计算该黑木耳中铁元素的含量(溶液密度为1g·mL-1)_______ (mg/100g);若以13.93mg/100g 为标准值,则本次实验的相对偏差为_______ 。(保留三位有效数字)

I.水煮菠菜(铁元素主要以难溶的 FeC2O4形式存在)检验法:

II.灼烧检验法:

(1)操作i中起分离作用的仪器名称为
(2)甲同学取少量无色溶液B,滴加酸性KMnO4溶液,振荡后,溶液紫色消失,因此得出结论,溶液B含有Fe2+。乙同学认为甲同学的实验方法不严谨,理由是
有研究表明,黑木耳中铁的含量约为13.93mg/100g,是菠菜含铁量的10倍以上。
III.测定木耳铁中元素含量。
(3)称取2.00g干黑木耳置于
(4)从配制的待测液中取出10mL,利用吸光度法测得其吸光度为0.400(吸光度与Fe2+的浓度关系如下图所示)。试计算该黑木耳中铁元素的含量(溶液密度为1g·mL-1)

更新时间:2023-01-01 15:38:41
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】FeCO3是制备补血剂原料之一。一种在实验室里制备FeCO3的流程如图所示:
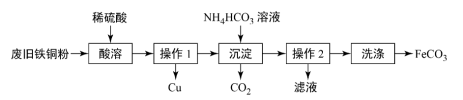
回答下列问题:
(1)“酸溶”时,常采取加热或搅拌措施,其目的是___ 。
(2)写出酸溶步骤的离子反应方程式___ 。
(3)“操作1”和“操作2”为___ 操作。
(4)写出“沉淀”时反应的化学方程式:___ 。
(4)“沉淀”反应前,检验溶液中是否含有Fe2+且不含Fe3+,写出检验的具体操作___ 。
(5)检验FeCO3是否“洗涤”干净的方法是___ 。

回答下列问题:
(1)“酸溶”时,常采取加热或搅拌措施,其目的是
(2)写出酸溶步骤的离子反应方程式
(3)“操作1”和“操作2”为
(4)写出“沉淀”时反应的化学方程式:
(4)“沉淀”反应前,检验溶液中是否含有Fe2+且不含Fe3+,写出检验的具体操作
(5)检验FeCO3是否“洗涤”干净的方法是
您最近一年使用:0次
【推荐2】Ⅰ.用覆铜板制作印刷电路板时,常用FeCl3溶液作腐蚀液。某兴趣小组在实验室进行了模拟。
(模拟实验Ⅰ)
向盛有4mL 0.2mol/L FeCl3溶液的试管中,加入一块铜片(Cu过量),反应一段时间后,溶液黄色褪去。
(分析解释)
(1)FeCl3与Cu反应的离子方程式是_______ 。
(2)为检验反应生成的Fe2+,最宜选择的试剂是_______ (填字母)。
a.KSCN溶液 b.NaOH溶液 c.K3[Fe(CN)6]溶液
(继续实验Ⅱ)
为验证上述实验中Fe3+是否完全反应,该小组同学取上层清液于另一支试管中,滴入3滴0.1mol/L KSCN溶液。结果发现,上层清液中立即产生白色沉淀,同时滴入处局部出现红色,振荡后红色立即消失。
(查阅资料)
为解释该异常现象产生的原因,同学们查阅资料得知:
①2CuCl2+4KSCN=2CuSCN↓+(SCN)2+4KCl
②CuSCN为白色固体,几乎不溶于水;
③(SCN)2与Cl2的性质相似。
(继续实验Ⅲ)
(分析解释)
(3)实验Ⅱ中白色沉淀的成分是_______ (填化学式)。
(4)请结合资料,用离子方程式解释实验Ⅱ中“滴入KSCN溶液处局部出现红色”的原因_______ 。
Ⅱ.水热法制备Fe3O4纳米颗粒的反应为3Fe2++2S2O +O2+xOH-=Fe3O4↓+S4O
+O2+xOH-=Fe3O4↓+S4O +2H2O。请回答下列问题:
+2H2O。请回答下列问题:
(5)水热法制备Fe3O4纳米颗粒的反应中,被氧化的元素为_______ (填元素符号)。
(6)该反应的化学方程式中,x=_______ 。
(7)每生成1mol Fe3O4,反应转移的电子为_______ mol。
(模拟实验Ⅰ)
向盛有4mL 0.2mol/L FeCl3溶液的试管中,加入一块铜片(Cu过量),反应一段时间后,溶液黄色褪去。
(分析解释)
(1)FeCl3与Cu反应的离子方程式是
(2)为检验反应生成的Fe2+,最宜选择的试剂是
a.KSCN溶液 b.NaOH溶液 c.K3[Fe(CN)6]溶液
(继续实验Ⅱ)
为验证上述实验中Fe3+是否完全反应,该小组同学取上层清液于另一支试管中,滴入3滴0.1mol/L KSCN溶液。结果发现,上层清液中立即产生白色沉淀,同时滴入处局部出现红色,振荡后红色立即消失。
(查阅资料)
为解释该异常现象产生的原因,同学们查阅资料得知:
①2CuCl2+4KSCN=2CuSCN↓+(SCN)2+4KCl
②CuSCN为白色固体,几乎不溶于水;
③(SCN)2与Cl2的性质相似。
(继续实验Ⅲ)
| 实验方案 | 现象 | |
| 步骤Ⅰ | 取4mL 0.2mol/L FeCl2溶液,向其中滴加3滴0.1mol/L KSCN溶液 | 无明显现象 |
| 步骤Ⅱ | 取4mL 0.2mol/L CuCl2溶液,向其中滴加3滴0.1mol/L KSCN溶液 | 产生白色沉淀 |
(3)实验Ⅱ中白色沉淀的成分是
(4)请结合资料,用离子方程式解释实验Ⅱ中“滴入KSCN溶液处局部出现红色”的原因
Ⅱ.水热法制备Fe3O4纳米颗粒的反应为3Fe2++2S2O
 +O2+xOH-=Fe3O4↓+S4O
+O2+xOH-=Fe3O4↓+S4O +2H2O。请回答下列问题:
+2H2O。请回答下列问题:(5)水热法制备Fe3O4纳米颗粒的反应中,被氧化的元素为
(6)该反应的化学方程式中,x=
(7)每生成1mol Fe3O4,反应转移的电子为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】摩尔盐[(NH4)2Fe(SO4)2·6H2O]是一种重要的化工原料,用途广泛。几位同学进行了如下实验以检验摩尔盐溶液中的NH4+、Fe2+、SO42-。
完成下列填空:
(1)甲同学向试样溶液中加入足量的Ba(OH)2溶液,微热,逸出可使_______ 试纸变蓝的气体以检验NH4+离子,同时生成白色沉淀,随即沉淀变为灰绿色,最后带有_________ 色,用足量_______ 溶液处理沉淀物,沉淀部分溶解以检验Fe2+、SO42-;
(2)乙同学提出检验Fe2+的方法:先向试样溶液中滴加KSCN,溶液呈无色,再加___________ 试剂,溶液呈血红色则有Fe2+。但实际操作中,乙同学向试样溶液中加入KSCN后,发现溶液变成浅红色,原因是________________ ;
丙同学欲测定某摩尔盐样品中Fe2+的含量。他称取0.400g该样品,溶于水,加入适量稀硫酸后,用0.0200mol/L的KMnO4溶液滴定,消耗KMnO4溶液10.00mL。
反应的离子方程式为:5Fe2++MnO4-+8H+→Mn2++5Fe3++4H2O。
(3)滴定终点的现象是_______________________ ,样品中Fe2+的百分含量是____________ 。
完成下列填空:
(1)甲同学向试样溶液中加入足量的Ba(OH)2溶液,微热,逸出可使
(2)乙同学提出检验Fe2+的方法:先向试样溶液中滴加KSCN,溶液呈无色,再加
丙同学欲测定某摩尔盐样品中Fe2+的含量。他称取0.400g该样品,溶于水,加入适量稀硫酸后,用0.0200mol/L的KMnO4溶液滴定,消耗KMnO4溶液10.00mL。
反应的离子方程式为:5Fe2++MnO4-+8H+→Mn2++5Fe3++4H2O。
(3)滴定终点的现象是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】已知A是一种常见金属,F是一种红褐色沉淀。试根据图中转化关系,回答下列问题。

(1)写出F、G的化学式。F:__ ,G:___ 。
(2)检验D中阳离子的方法___ 。
(3)保存C溶液时为什么要加固体A__ 。
(4)写出下列转化的离子方程式或化学方程式。
①A→C:___ 。
②C→D:___ 。

(1)写出F、G的化学式。F:
(2)检验D中阳离子的方法
(3)保存C溶液时为什么要加固体A
(4)写出下列转化的离子方程式或化学方程式。
①A→C:
②C→D:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】钒及其化合物在工业上有许多用途。某钒精矿的主要成分及质量分数如下表:
一种从该钒精矿中提取五氧化二钒的流程如下:

回答下列问题:
(1)“酸浸、氧化”时,V2O3转化为VO2+,反应的离子方程式为____________________________________ ;若用浓盐酸代替硫酸,V2O5转化为VO2+,同时生成有毒的黄绿色气体,反应的化学方程式为__________________ 。
(2)萃取剂对四价钒具有高选择性,且萃取Fe3+而不萃取Fe2+,所以萃取前可用____________ (填名称,下同)对浸出液进行“还原”处理。为检验“还原”后的滤液中是否含有Fe3+,可选用的化学试剂是____________________ 。
(3)“溶剂萃取与反萃取”可表示为:VO2+ + (HR2PO4)2(O) VO(R2PO4)2(O)+ 2H+。其中(HR2PO4)2(O)为萃取剂,为了提高VO2+的产率,反萃取剂应该呈
VO(R2PO4)2(O)+ 2H+。其中(HR2PO4)2(O)为萃取剂,为了提高VO2+的产率,反萃取剂应该呈 __________ 性(填“酸”“碱”或“中”)。
(4)“氧化”中,欲使3molVO2+变为VO2+,则需要氧化剂NaClO3至少为____________ mol。
(5)单质钒可用于制造特种合金钢。以五氧化二钒和金属钙为原料在高温条件下可制备单质钒,表示制备过程的化学方程式为________________________________________ 。
| 物质 | V2O5 | V2O3 | K2O | SiO2 | Fe2O3 | Al2O3 |
| 质量分数% | 0.81 | 1.70 | 2.11 | 63.91 | 5.86 | 12.51 |
一种从该钒精矿中提取五氧化二钒的流程如下:

回答下列问题:
(1)“酸浸、氧化”时,V2O3转化为VO2+,反应的离子方程式为
(2)萃取剂对四价钒具有高选择性,且萃取Fe3+而不萃取Fe2+,所以萃取前可用
(3)“溶剂萃取与反萃取”可表示为:VO2+ + (HR2PO4)2(O)
 VO(R2PO4)2(O)+ 2H+。其中(HR2PO4)2(O)为萃取剂,为了提高VO2+的产率,反萃取剂应该呈
VO(R2PO4)2(O)+ 2H+。其中(HR2PO4)2(O)为萃取剂,为了提高VO2+的产率,反萃取剂应该呈 (4)“氧化”中,欲使3molVO2+变为VO2+,则需要氧化剂NaClO3至少为
(5)单质钒可用于制造特种合金钢。以五氧化二钒和金属钙为原料在高温条件下可制备单质钒,表示制备过程的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】甲、乙同学对Fe及其化合物的相关性质与用途进行探究。
(1)实验I:甲、乙两同学分别用下图装置进行Fe粉与水蒸气反应的实验。
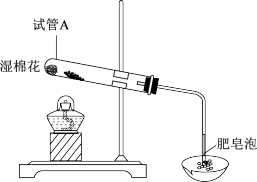
①证明生成的气体是氢气,依据的现象是_______ 。
②该反应的化学方程式是_______ 。
(2)实验II:甲、乙同学分别对各自实验I反应后的黑色固体进行研究。冷却取试管A中冷却后的固体加入过量稀HCl,充分反应后将溶液分成两份(如图)。请将下表中的现象或结论补充完整。
已知: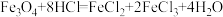
(1)实验I:甲、乙两同学分别用下图装置进行Fe粉与水蒸气反应的实验。

①证明生成的气体是氢气,依据的现象是
②该反应的化学方程式是
(2)实验II:甲、乙同学分别对各自实验I反应后的黑色固体进行研究。冷却取试管A中冷却后的固体加入过量稀HCl,充分反应后将溶液分成两份(如图)。请将下表中的现象或结论补充完整。
已知:
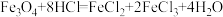
| 操作过程 | 现象及结论 | |
| 甲同学 | 乙同学 | |
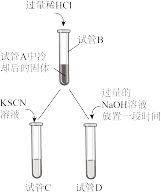 | 试管B中固体全部溶解,得到溶液M | 试管B固体全部溶解,同时有大量气泡产生,得到溶液N |
| 试管C溶液变红 | 试管C溶液没有变红,用离子方程式解释原因② | |
| 试管D开始有红褐色和灰绿色沉淀生成,最终全部变为红褐色。则溶液M中存在的阳离子有① | 试管D实验现象是③ 产生该现象发生的氧化还原反应的化学方程式是④ | |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】某化学研究性学习小组需配制含有NH 、Cl-、K+、SO
、Cl-、K+、SO 的植物培养液450 mL,且要求该培养液中c(Cl-)=c(K+)=c(SO
的植物培养液450 mL,且要求该培养液中c(Cl-)=c(K+)=c(SO )=0.4 mol·L-1。实验室提供的药品有:NH4Cl、KCl、(NH4)2SO4、K2SO4和蒸馏水;提供的实验仪器有:①药匙 ②托盘天平 ③烧杯 ④玻璃棒 ⑤胶头滴管 ⑥量筒。请回答下列问题:
)=0.4 mol·L-1。实验室提供的药品有:NH4Cl、KCl、(NH4)2SO4、K2SO4和蒸馏水;提供的实验仪器有:①药匙 ②托盘天平 ③烧杯 ④玻璃棒 ⑤胶头滴管 ⑥量筒。请回答下列问题:
(1)该植物培养液中,NH 的物质的量浓度为
的物质的量浓度为_______ 。
(2)该研究小组配制该植物培养液时,还须用到的实验仪器是_______ (填字母)。
A.450 mL容量瓶 B.500 mL容量瓶 C.两个250 mL容量瓶
(3)甲同学用KCl和(NH4)2SO4两种物质进行配制,则需称取m(KCl)=_______ g,m[(NH4)2SO4]=_______ g。
(4)若配制该培养液的其他操作均正确,则下列操作将使所配制溶液的浓度偏低的是_______ (填字母)。
A.将溶液转移至容量瓶后,未洗涤烧杯和玻璃棒
B.将烧杯内的溶液向容量瓶中转移时,因操作不当使部分溶液溅出容量瓶
C.用胶头滴管向容量瓶中加水时,溶液的凹液面高于容量瓶刻度线
D.用胶头滴管向容量瓶中加水时,俯视容量瓶刻度线
E.用已生锈的砝码称量所需物质的质量
 、Cl-、K+、SO
、Cl-、K+、SO 的植物培养液450 mL,且要求该培养液中c(Cl-)=c(K+)=c(SO
的植物培养液450 mL,且要求该培养液中c(Cl-)=c(K+)=c(SO )=0.4 mol·L-1。实验室提供的药品有:NH4Cl、KCl、(NH4)2SO4、K2SO4和蒸馏水;提供的实验仪器有:①药匙 ②托盘天平 ③烧杯 ④玻璃棒 ⑤胶头滴管 ⑥量筒。请回答下列问题:
)=0.4 mol·L-1。实验室提供的药品有:NH4Cl、KCl、(NH4)2SO4、K2SO4和蒸馏水;提供的实验仪器有:①药匙 ②托盘天平 ③烧杯 ④玻璃棒 ⑤胶头滴管 ⑥量筒。请回答下列问题:(1)该植物培养液中,NH
 的物质的量浓度为
的物质的量浓度为(2)该研究小组配制该植物培养液时,还须用到的实验仪器是
A.450 mL容量瓶 B.500 mL容量瓶 C.两个250 mL容量瓶
(3)甲同学用KCl和(NH4)2SO4两种物质进行配制,则需称取m(KCl)=
(4)若配制该培养液的其他操作均正确,则下列操作将使所配制溶液的浓度偏低的是
A.将溶液转移至容量瓶后,未洗涤烧杯和玻璃棒
B.将烧杯内的溶液向容量瓶中转移时,因操作不当使部分溶液溅出容量瓶
C.用胶头滴管向容量瓶中加水时,溶液的凹液面高于容量瓶刻度线
D.用胶头滴管向容量瓶中加水时,俯视容量瓶刻度线
E.用已生锈的砝码称量所需物质的质量
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】利用课堂上学到的知识来解决生活中的问题是我们学习的重要目的。
(1)某化学实验兴趣小组自行购置了鸡蛋、食醋等生活用品,进行了如下探究。
①甲同学测出从超市购买的食醋中醋酸(CH3COOH)含量为0.75mol/L,则食醋中醋酸含量为_______ g/100mL,属于_______ 醋(填“酿造”或“配制”,已知:酿造醋的国家标准为醋酸含量必须大于3.50g/100mL,而配制醋仅为1.50g~3.50g/100mL)。
②乙同学将鸡蛋壳(主要成分为CaCO3)泡进食醋中,发现有气泡产生,请写出该反应的离子方程式_______ ;
(2)下图是化学实验室浓盐酸试剂标签上的部分内容。
丁同学计划用该浓盐酸配制470mL1mol·L-1的稀盐酸,可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤玻璃棒 ⑥试剂瓶。请回答下列问题:
①经计算,配制1mol·L-1的稀盐酸需要量取上述浓盐酸的体积为_______ mL(结果保留1位小数)。
②配制稀盐酸时,还缺少的仪器有_______ 。
③测定所配制的稀盐酸,发现其浓度大于1mol·L-1,引起误差的原因可能是_______ 。
A.将量取的浓盐酸倒入烧杯后,洗涤量筒,洗涤液也注入烧杯
B.定容时俯视容量瓶刻度线
C.转移溶液后,未洗涤烧杯和玻璃棒
D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
(1)某化学实验兴趣小组自行购置了鸡蛋、食醋等生活用品,进行了如下探究。
①甲同学测出从超市购买的食醋中醋酸(CH3COOH)含量为0.75mol/L,则食醋中醋酸含量为
②乙同学将鸡蛋壳(主要成分为CaCO3)泡进食醋中,发现有气泡产生,请写出该反应的离子方程式
(2)下图是化学实验室浓盐酸试剂标签上的部分内容。
| 盐酸 分子式:HC1 相对分子质量:36.5 密度约1.18g.cm-3 HCl的质量分数:36.5% |
①经计算,配制1mol·L-1的稀盐酸需要量取上述浓盐酸的体积为
②配制稀盐酸时,还缺少的仪器有
③测定所配制的稀盐酸,发现其浓度大于1mol·L-1,引起误差的原因可能是
A.将量取的浓盐酸倒入烧杯后,洗涤量筒,洗涤液也注入烧杯
B.定容时俯视容量瓶刻度线
C.转移溶液后,未洗涤烧杯和玻璃棒
D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】孔雀石铜矿(含Cu、Fe、Al等元素)是工业上提取铁、铜等金属的原材料,某工厂由孔雀石铜矿制备单质铜和绿矾( )的工艺流程如下:
)的工艺流程如下:
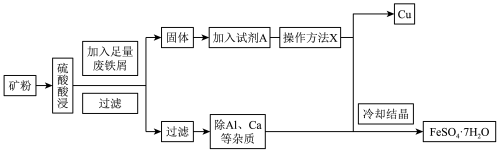
回答下列问题:
(1)试剂A为___________ ,此步骤涉及反应的离子方程式是___________ ,1molA参与上述反应转移电子的物质的量为___________ 。
(2)操作X是___________ 。
(3)实验室需要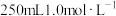 稀硫酸,化学小组用98%浓硫酸(
稀硫酸,化学小组用98%浓硫酸(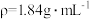 )配制上述稀硫酸,配制过程中可能用到下列仪器:①100mL量筒②25mL量筒③烧杯④托盘天平⑤250mL容量瓶⑥胶头滴管⑦玻璃棒,按使用时出现的先后顺序排列是___________。
)配制上述稀硫酸,配制过程中可能用到下列仪器:①100mL量筒②25mL量筒③烧杯④托盘天平⑤250mL容量瓶⑥胶头滴管⑦玻璃棒,按使用时出现的先后顺序排列是___________。
(4)将稀释后的硫酸转移到容量瓶之前需___________ 。若将稀释后的硫酸立即转移到容量瓶将使所配溶液的物质的量浓度___________ 。(填“偏高”“偏低”或“无影响”)
 )的工艺流程如下:
)的工艺流程如下:
回答下列问题:
(1)试剂A为
(2)操作X是
(3)实验室需要
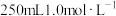 稀硫酸,化学小组用98%浓硫酸(
稀硫酸,化学小组用98%浓硫酸(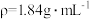 )配制上述稀硫酸,配制过程中可能用到下列仪器:①100mL量筒②25mL量筒③烧杯④托盘天平⑤250mL容量瓶⑥胶头滴管⑦玻璃棒,按使用时出现的先后顺序排列是___________。
)配制上述稀硫酸,配制过程中可能用到下列仪器:①100mL量筒②25mL量筒③烧杯④托盘天平⑤250mL容量瓶⑥胶头滴管⑦玻璃棒,按使用时出现的先后顺序排列是___________。| A.①③⑤⑦⑥ | B.②③⑦⑤⑥ | C.④③⑤⑦⑥ | D.①③⑦⑤⑥ |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】某种市售食用碱是纯碱与小苏打的混合物,可大量应用于食品加工,如面条、面包、馒头等,某校化学兴趣小组利用如图所示装置进行实验,测定此种食用碱中纯碱的质量分数(各装置中气体吸收剂足量)。

实验步骤:
①检查装置的气密性,称取样品(仅由纯碱与小苏打组成)10g,加到装置B中;
②连接装置,打开弹簧夹,先通一段时间空气后,关闭弹簧夹,打开仪器a的活塞滴入稀硫酸至不再有气体生成;
③关闭仪器a的活塞,打开弹簧夹,继续通入一段时间空气。实验中记录的数据如表所示:
请回答下列问题:
(1)仪器a的名称是_______ ,写出稀硫酸与碳酸氢钠反应的离子方程式:__________ 。
(2)实验开始前,先打开弹簧夹,通入一段时间空气,试剂X为___________ 溶液,实验结束后,需要继续通入一段时间的空气,其目的为___________ 。
(3)若缺少干燥管I,会造成测定结果___________ (填“偏大”“不变”或“偏小”)。
(4)有同学认为,表格中三组数据都可以计算该样品中 的质量分数,但也有同学认为不能用装置C前后的质量差来计算,其理由是
的质量分数,但也有同学认为不能用装置C前后的质量差来计算,其理由是___________ 。通过实验数据计算,食用碱中 的质量分数为
的质量分数为___________ (保留三位有效数字)。

实验步骤:
①检查装置的气密性,称取样品(仅由纯碱与小苏打组成)10g,加到装置B中;
②连接装置,打开弹簧夹,先通一段时间空气后,关闭弹簧夹,打开仪器a的活塞滴入稀硫酸至不再有气体生成;
③关闭仪器a的活塞,打开弹簧夹,继续通入一段时间空气。实验中记录的数据如表所示:
| 装置B | 装置C | 干燥管I | |
| 实验前称得的质量/g | 180.0 | 30.0 | 120.4 |
| 实验后称得的质量/g | 174.2 | 31.5 | 124.8 |
(1)仪器a的名称是
(2)实验开始前,先打开弹簧夹,通入一段时间空气,试剂X为
(3)若缺少干燥管I,会造成测定结果
(4)有同学认为,表格中三组数据都可以计算该样品中
 的质量分数,但也有同学认为不能用装置C前后的质量差来计算,其理由是
的质量分数,但也有同学认为不能用装置C前后的质量差来计算,其理由是 的质量分数为
的质量分数为
您最近一年使用:0次
【推荐2】某混合物澄清透明的水溶液中,可能含有以下离子中的若干种:K+、Ca2+、Fe2+、Cu2+、Cl-、 、
、 ,现每次取100.00mL该溶液进行以下实验:
,现每次取100.00mL该溶液进行以下实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量BaCl2溶液后生成沉淀,洗涤后干燥沉淀6.27g,再将该沉淀加入足量盐酸溶解后再过滤洗涤干燥后得沉淀2.33g。
请回答下列问题:
(1)根据以上实验判断,原溶液中一定不存在的离子是_______ ,可能存在的离子是_______ 。要确定可能含有的离子,还需要进行的实验操作是_______ ,写出沉淀与盐酸反应的离子方程式为_______ 。
(2)原溶液中一定存在的阳离子为_______ ,其物质的量浓度至少为_______ mol∙L-1。
(3)原溶液中一定存在的阴离子是_______ ,其物质的量浓度为_______ mol∙L-1、_______ mol∙L-1。
 、
、 ,现每次取100.00mL该溶液进行以下实验:
,现每次取100.00mL该溶液进行以下实验:①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量BaCl2溶液后生成沉淀,洗涤后干燥沉淀6.27g,再将该沉淀加入足量盐酸溶解后再过滤洗涤干燥后得沉淀2.33g。
请回答下列问题:
(1)根据以上实验判断,原溶液中一定不存在的离子是
(2)原溶液中一定存在的阳离子为
(3)原溶液中一定存在的阴离子是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】C1O2是国际上公认为安全、无毒的绿色消毒剂。为满足市场需求,科学家研究出多种可用于生产制备 C1O2的方法,一种以 NaCl为原料制备 C1O2的工艺流程如图所示:

回答下列问题:
(1)电解饱和食盐水的离子方程式为_______________ 。
(2)气体 X 的化学式为______ ,该气体在___ (填“阴”或 “阳”)极生成。常温下,若电解1L NaCl溶液,生成标准状况下1.12L 气体 X,电解后溶液的 pH=______ (假设溶液体积不变)。
(3)气体X与Y溶液在常温下反应可生成一种常用含氯消毒剂,该消毒剂在新冠肺炎疫情期间被广泛应用于环境消毒,其有效成分为____ (填化学式)。
(4)流程中由NaClO3溶液制得 C1O2反应的化学方程式为_________ 。
(5)国家规定,饮用水中C1O2的残留量不得高于0.8 mg·L-1。检测饮用水中 C1O2 残留浓度的实验步骤如下:
I.取50.00 mL 水样,加入过量的碘化钾和适量稀硫酸,发生反应2C1O2 +10I-+8H+=2C1-+5I2+4H2O,充分反应后加入2滴淀粉溶液;
II.用1.000×10-4 mol·L-1 Na2S2O3溶液滴定步骤I中生成的I2。
已知:步骤II中发生反应的离子方程式为2S2O +I2 =S4O
+I2 =S4O +2I-。
+2I-。
①当步骤II中出现_____ (填现象)时,停止滴加 Na2S2O3溶液,消耗 Na2S2O3 溶液的体积为25.00mL。
②上述水样中C1O2的残留浓度为______ mg·L-1。

回答下列问题:
(1)电解饱和食盐水的离子方程式为
(2)气体 X 的化学式为
(3)气体X与Y溶液在常温下反应可生成一种常用含氯消毒剂,该消毒剂在新冠肺炎疫情期间被广泛应用于环境消毒,其有效成分为
(4)流程中由NaClO3溶液制得 C1O2反应的化学方程式为
(5)国家规定,饮用水中C1O2的残留量不得高于0.8 mg·L-1。检测饮用水中 C1O2 残留浓度的实验步骤如下:
I.取50.00 mL 水样,加入过量的碘化钾和适量稀硫酸,发生反应2C1O2 +10I-+8H+=2C1-+5I2+4H2O,充分反应后加入2滴淀粉溶液;
II.用1.000×10-4 mol·L-1 Na2S2O3溶液滴定步骤I中生成的I2。
已知:步骤II中发生反应的离子方程式为2S2O
 +I2 =S4O
+I2 =S4O +2I-。
+2I-。①当步骤II中出现
②上述水样中C1O2的残留浓度为
您最近一年使用:0次



