化学反应是人类获得能量的重要途径。请结合所学知识解决以下问题。
I.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
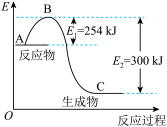
(1)如图是 和
和 反应生成
反应生成 的过程中能量变化示意图,请写出
的过程中能量变化示意图,请写出 和
和 反应的热化学方程式
反应的热化学方程式_______ 。
(2)用 催化还原NO,还可以消除氮氧化物的污染。已知:
催化还原NO,还可以消除氮氧化物的污染。已知:
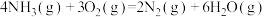
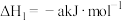 ①
①
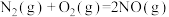
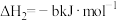 ②
②
若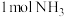 还原NO至
还原NO至 ,则该反应过程中的反应热
,则该反应过程中的反应热
____ kJ/mol(用含a、b的式子表示)。
II.某科研单位利用电化学原理用来制备硫酸,装置如图所示。电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。
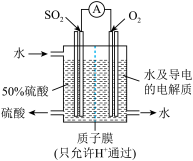
(3)通入 的电极为
的电极为_______ 极,其电极反应式为_______ 。
(4)电解质溶液中的 通过质子膜
通过质子膜_______ 移动(填“向左”、“向右”或“不”)。
III.用石墨棒作电极,在 、
、 、
、 、
、 等离子中选出适当离子组成电解质,电解其溶液,写出符合条件的一种电解质的化学式:
等离子中选出适当离子组成电解质,电解其溶液,写出符合条件的一种电解质的化学式:
(5)当阴极放出 ,阳极放出
,阳极放出 时,电解质是
时,电解质是_______ (写化学式,下同)。
(6)当阴极放出 ,阳极放出
,阳极放出 时,电解质是
时,电解质是_______ 。
(7)通过电子的物质的量与阴极析出的金属的物质的量、阳极放出的气体的物质的量之比为4∶2∶1时,电解质是_______ 。
I.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)如图是
 和
和 反应生成
反应生成 的过程中能量变化示意图,请写出
的过程中能量变化示意图,请写出 和
和 反应的热化学方程式
反应的热化学方程式
(2)用
 催化还原NO,还可以消除氮氧化物的污染。已知:
催化还原NO,还可以消除氮氧化物的污染。已知: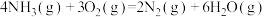
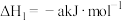 ①
①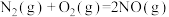
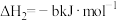 ②
②若
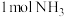 还原NO至
还原NO至 ,则该反应过程中的反应热
,则该反应过程中的反应热
II.某科研单位利用电化学原理用来制备硫酸,装置如图所示。电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。

(3)通入
 的电极为
的电极为(4)电解质溶液中的
 通过质子膜
通过质子膜III.用石墨棒作电极,在
 、
、 、
、 、
、 等离子中选出适当离子组成电解质,电解其溶液,写出符合条件的一种电解质的化学式:
等离子中选出适当离子组成电解质,电解其溶液,写出符合条件的一种电解质的化学式:(5)当阴极放出
 ,阳极放出
,阳极放出 时,电解质是
时,电解质是(6)当阴极放出
 ,阳极放出
,阳极放出 时,电解质是
时,电解质是(7)通过电子的物质的量与阴极析出的金属的物质的量、阳极放出的气体的物质的量之比为4∶2∶1时,电解质是
22-23高二上·天津河西·期末 查看更多[2]
更新时间:2023-01-12 21:39:18
|
相似题推荐
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐1】回答下列问题:
(1)将黑色的 固体加入足量盐酸中,溶液中有淡黄色固体生成,产物还有
固体加入足量盐酸中,溶液中有淡黄色固体生成,产物还有_______ 、_______ 。过滤,微热滤液,然后加入过量的氢氧化钠溶液,可观察到的现象是_______ 。
(2)Bunsen热化学循环制氢工艺由下列三个反应组成:
①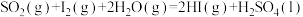
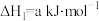
②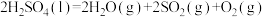

③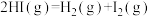
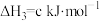
则:
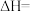
_______ 。
(3) 和
和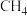 的燃烧热分别为
的燃烧热分别为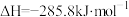 和
和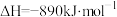 ,标准状况下
,标准状况下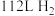 和
和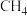 的混合气体完全燃烧生成
的混合气体完全燃烧生成 气体和液态水时放出
气体和液态水时放出 热量,则混合气体中
热量,则混合气体中 和
和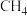 的物质的量之比是
的物质的量之比是_______ 。
(4)氯化铵固体溶于水温度降低,请解释原因_______ 。
(5)合成氨反应:
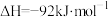 ;
;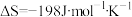 。
。
①判断该反应在室温下能否自发进行?为什么?_______ 。
③室温下推动该反应自发进行的主要因素是熵变还是焓变_______ ?
(1)将黑色的
 固体加入足量盐酸中,溶液中有淡黄色固体生成,产物还有
固体加入足量盐酸中,溶液中有淡黄色固体生成,产物还有(2)Bunsen热化学循环制氢工艺由下列三个反应组成:
①
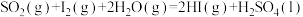
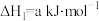
②
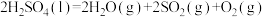

③
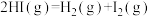
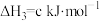
则:

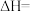
(3)
 和
和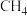 的燃烧热分别为
的燃烧热分别为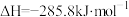 和
和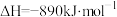 ,标准状况下
,标准状况下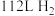 和
和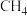 的混合气体完全燃烧生成
的混合气体完全燃烧生成 气体和液态水时放出
气体和液态水时放出 热量,则混合气体中
热量,则混合气体中 和
和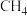 的物质的量之比是
的物质的量之比是(4)氯化铵固体溶于水温度降低,请解释原因
(5)合成氨反应:

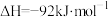 ;
;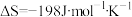 。
。①判断该反应在室温下能否自发进行?为什么?
③室温下推动该反应自发进行的主要因素是熵变还是焓变
您最近一年使用:0次
【推荐2】 是汽车尾气中的主要污染物之一,硝酸盐是水体污染的污染物之一。
是汽车尾气中的主要污染物之一,硝酸盐是水体污染的污染物之一。
(1) 可用于烟气脱硝。已知有如下反应:
可用于烟气脱硝。已知有如下反应:
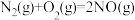
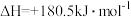


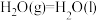
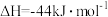
则

________ 
(2)电化学降解 的原理如图所示,电源正极为
的原理如图所示,电源正极为________ (填“a”或"b"),阴极电极反应式________ 。
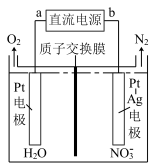
(3)某研究小组在100°C时,将 充入2L的真空密闭容器中,每隔一段时间就对该容器内的物质进行分析,得到如下数据
充入2L的真空密闭容器中,每隔一段时间就对该容器内的物质进行分析,得到如下数据
①上述条件下,对于 的说法正确的是
的说法正确的是________ 。
A.该反应为吸热反应
B. ,
,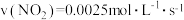
C.
D.该反应的平衡常数为2.8(保留小数点后一位)
②在相同情况下,最初向该容器中充入的是 ,要达到相同的平衡状态,
,要达到相同的平衡状态, 的起始浓度是
的起始浓度是________  。在80s时达到平衡,请在图中画出并标明
。在80s时达到平衡,请在图中画出并标明 和
和 的浓度随时间变化(0-100s)的曲线。
的浓度随时间变化(0-100s)的曲线。______________

③反应 达到平衡后,向该密闭容器中再充入0.32mol氮气,并把容器体积扩大为4L,判断平衡如何移动并解释原因
达到平衡后,向该密闭容器中再充入0.32mol氮气,并把容器体积扩大为4L,判断平衡如何移动并解释原因________ 。
 是汽车尾气中的主要污染物之一,硝酸盐是水体污染的污染物之一。
是汽车尾气中的主要污染物之一,硝酸盐是水体污染的污染物之一。(1)
 可用于烟气脱硝。已知有如下反应:
可用于烟气脱硝。已知有如下反应: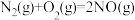
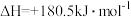


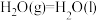
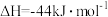
则



(2)电化学降解
 的原理如图所示,电源正极为
的原理如图所示,电源正极为
(3)某研究小组在100°C时,将
 充入2L的真空密闭容器中,每隔一段时间就对该容器内的物质进行分析,得到如下数据
充入2L的真空密闭容器中,每隔一段时间就对该容器内的物质进行分析,得到如下数据| 时间(s) | 0 | 20 | 40 | 60 | 80 |
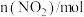 | 0.40 | 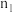 | 0.26 |  |  |
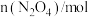 | 0.00 | 0.05 |  | 0.08 | 0.08 |
①上述条件下,对于
 的说法正确的是
的说法正确的是A.该反应为吸热反应
B.
 ,
,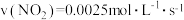
C.

D.该反应的平衡常数为2.8(保留小数点后一位)
②在相同情况下,最初向该容器中充入的是
 ,要达到相同的平衡状态,
,要达到相同的平衡状态, 的起始浓度是
的起始浓度是 。在80s时达到平衡,请在图中画出并标明
。在80s时达到平衡,请在图中画出并标明 和
和 的浓度随时间变化(0-100s)的曲线。
的浓度随时间变化(0-100s)的曲线。
③反应
 达到平衡后,向该密闭容器中再充入0.32mol氮气,并把容器体积扩大为4L,判断平衡如何移动并解释原因
达到平衡后,向该密闭容器中再充入0.32mol氮气,并把容器体积扩大为4L,判断平衡如何移动并解释原因
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
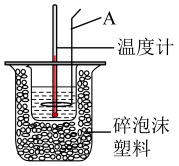
【推荐3】化学反应伴随有能量的变化,获取反应能量变化有多条途径。
(1)通过测定反应过程中所放出的热量可计算中和热。某学生分别取50mL的0.50mol/L盐酸与0.55mol/L氢氧化钠溶液进行中和反应,实验记录数据如下:
①已知热量计算 ,盐酸和氢氧化钠溶液的密度都是
,盐酸和氢氧化钠溶液的密度都是 ,又知中和后生成溶液的比热容c=4.180J/(g・℃),依据该学生的实验数据计算,该实验测得的
,又知中和后生成溶液的比热容c=4.180J/(g・℃),依据该学生的实验数据计算,该实验测得的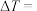
______ ℃,
______ J;该实验数据测出的中和热
______  (保留1位有效数字)。
(保留1位有效数字)。
②上述实验得出的 大于-57.3
大于-57.3 ,产生偏差的原因不可能是
,产生偏差的原因不可能是______ (填字母)。
a.实验装置保温、隔热效果差
b.量取HCl溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
③若改用60mL 0.25
 和50mL 0.55
和50mL 0.55 NaOH溶液进行反应与上述实验相比,所放出的热量
NaOH溶液进行反应与上述实验相比,所放出的热量______ (填“相等”或“不相等”),若实验操作均正确,则是否影响中和热的计算结果______ (填“偏大”、“偏小”或“不影响”)。
④若改用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热 会
会______ (填“偏大”、“偏小”或“不影响”)。
(2)通过化学键的键能计算。已知:
计算可得: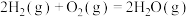

______  。
。
(3)通过盖斯定律计算。氧化亚铜()常用于制船底防污漆,已知反应:
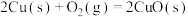

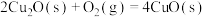

则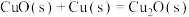 的
的
______ (用 和
和 表达)。
表达)。
(1)通过测定反应过程中所放出的热量可计算中和热。某学生分别取50mL的0.50mol/L盐酸与0.55mol/L氢氧化钠溶液进行中和反应,实验记录数据如下:

实验序号 | 起始温度 | 终止温度 | |
盐酸 | 氢氧化钠 | 混合溶液 | |
1 | 20.0 | 20.2 | 23.3 |
2 | 20.2 | 20.4 | 23.5 |
3 | 20.6 | 20.6 | 25.6 |
 ,盐酸和氢氧化钠溶液的密度都是
,盐酸和氢氧化钠溶液的密度都是 ,又知中和后生成溶液的比热容c=4.180J/(g・℃),依据该学生的实验数据计算,该实验测得的
,又知中和后生成溶液的比热容c=4.180J/(g・℃),依据该学生的实验数据计算,该实验测得的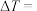


 (保留1位有效数字)。
(保留1位有效数字)。②上述实验得出的
 大于-57.3
大于-57.3 ,产生偏差的原因不可能是
,产生偏差的原因不可能是a.实验装置保温、隔热效果差
b.量取HCl溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
③若改用60mL 0.25

 和50mL 0.55
和50mL 0.55 NaOH溶液进行反应与上述实验相比,所放出的热量
NaOH溶液进行反应与上述实验相比,所放出的热量④若改用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热
 会
会(2)通过化学键的键能计算。已知:
化学键种类 |
|
|
|
键能/ | 436 | 496 | 463.4 |
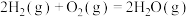

 。
。(3)通过盖斯定律计算。氧化亚铜()常用于制船底防污漆,已知反应:
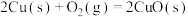

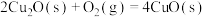

则
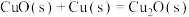 的
的
 和
和 表达)。
表达)。
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
【推荐1】在一定温度下,对冰醋酸加水稀释的过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。请回答下列问题:
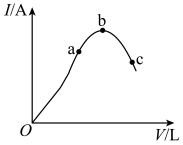
(1)a、b、c三点对应的溶液中, 由小到大的顺序为
由小到大的顺序为__________ 。
(2)a、b、c三点对应的溶液中, 的电离程度最大的是
的电离程度最大的是__________ 。
(3)若使c点对应的溶液中的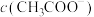 增大,则下列措施中,可行的是
增大,则下列措施中,可行的是__________ (填字母,下同)。
A.加热 B.加入NaOH固体 C.加入浓盐酸溶液
D.加水 E.加入 固体 F.加入锌粒
固体 F.加入锌粒
(4)在稀释过程中,随着醋酸浓度的减小,下列始终保持增大趋势的是__________。
(5)依反应 设计的原电池如图1所示。
设计的原电池如图1所示。
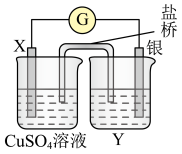
图1
请回答下列问题:
①电极X的材料是__________ ;电解质溶液Y是__________ 溶液。
②银电极为电池的__________ 极,发生的电极反应式为__________ 。

(1)a、b、c三点对应的溶液中,
 由小到大的顺序为
由小到大的顺序为(2)a、b、c三点对应的溶液中,
 的电离程度最大的是
的电离程度最大的是(3)若使c点对应的溶液中的
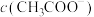 增大,则下列措施中,可行的是
增大,则下列措施中,可行的是A.加热 B.加入NaOH固体 C.加入浓盐酸溶液
D.加水 E.加入
 固体 F.加入锌粒
固体 F.加入锌粒(4)在稀释过程中,随着醋酸浓度的减小,下列始终保持增大趋势的是__________。
A. | B. |
C. 分子数 分子数 | D.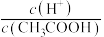 |
(5)依反应
 设计的原电池如图1所示。
设计的原电池如图1所示。
图1
请回答下列问题:
①电极X的材料是
②银电极为电池的
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐2】用“锌”和“碳棒”作为导电材料,根据氧化还原反应H2SO4+Zn=ZnSO4+H2↑,设计如下原电池装置:
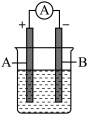
⑴该原电池电解质溶液中的溶质是________ 。
⑵电极A是________ ,该电极反应现象为_______ 。
⑶电极B是______ ,该电极反应现象为_________ 。

⑴该原电池电解质溶液中的溶质是
⑵电极A是
⑶电极B是
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
【推荐3】化学反应在发生物质变化的同时伴随有能量变化,能量、速率与限度是认识和研究化学反应的重要视角。
(1)天然气已经成为我国主要的民用清洁能源,已知天然气的主要成分甲烷( )燃烧时的能量变化如图所示:
)燃烧时的能量变化如图所示:

①下列说法中正确的是___________ (填字母)
A.甲烷完全燃烧时化学能全部转化为热能
B.由图可知二氧化碳比甲烷稳定
C.标准状况下, 甲烷完全燃烧时放出
甲烷完全燃烧时放出 的热量
的热量
D.该反应中断键吸收的总能量低于形成键放出的总能量
E.甲烷属于清洁能源,也属于新能源
②已知断开图示中部分化学键需要的能量为, :
: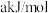 ,
, :
: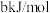 ,
, :
: ,则形成
,则形成
 释放的能量为
释放的能量为___________ kJ。
(2)电化学气敏传感器可用于监测环境中 的含量,其工作原理示意图如图。
的含量,其工作原理示意图如图。

①Pt电极(a)上的电极反应式为:___________ ; 溶液中
溶液中 离子移向Pt电极
离子移向Pt电极___________ (填“a”或“b”)。
②反应一段时间后, 溶液的浓度将
溶液的浓度将___________ (填“增大”“减小”或“不变”);理论上,Pt电极(a)与(b)消耗气体的物质的量之比为___________ 。
(3)工业制硫酸的一步重要反应是 在400~500℃的催化氧化,在容积为
在400~500℃的催化氧化,在容积为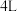 的绝热密闭容器中投入
的绝热密闭容器中投入
 和
和
 ,反应过程中部分物质的物质的量随反应时间变化的曲线如图所示。
,反应过程中部分物质的物质的量随反应时间变化的曲线如图所示。

① ,
, 的平均反应速率
的平均反应速率
___________ 。
②下列情况能说明该反应达到化学平衡的是___________ 。
A.t时刻,体系的温度不再发生改变
B.混合气体的密度保持不变
C.单位时间内生成
 的同时断开
的同时断开
 键
键
D.混合气体的平均相对分子质量
E.反应物 和
和 的转化率相等
的转化率相等
(1)天然气已经成为我国主要的民用清洁能源,已知天然气的主要成分甲烷(
 )燃烧时的能量变化如图所示:
)燃烧时的能量变化如图所示:
①下列说法中正确的是
A.甲烷完全燃烧时化学能全部转化为热能
B.由图可知二氧化碳比甲烷稳定
C.标准状况下,
 甲烷完全燃烧时放出
甲烷完全燃烧时放出 的热量
的热量D.该反应中断键吸收的总能量低于形成键放出的总能量
E.甲烷属于清洁能源,也属于新能源
②已知断开图示中部分化学键需要的能量为,
 :
: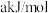 ,
, :
: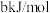 ,
, :
: ,则形成
,则形成
 释放的能量为
释放的能量为(2)电化学气敏传感器可用于监测环境中
 的含量,其工作原理示意图如图。
的含量,其工作原理示意图如图。
①Pt电极(a)上的电极反应式为:
 溶液中
溶液中 离子移向Pt电极
离子移向Pt电极②反应一段时间后,
 溶液的浓度将
溶液的浓度将(3)工业制硫酸的一步重要反应是
 在400~500℃的催化氧化,在容积为
在400~500℃的催化氧化,在容积为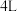 的绝热密闭容器中投入
的绝热密闭容器中投入
 和
和
 ,反应过程中部分物质的物质的量随反应时间变化的曲线如图所示。
,反应过程中部分物质的物质的量随反应时间变化的曲线如图所示。
①
 ,
, 的平均反应速率
的平均反应速率
②下列情况能说明该反应达到化学平衡的是
A.t时刻,体系的温度不再发生改变
B.混合气体的密度保持不变
C.单位时间内生成

 的同时断开
的同时断开
 键
键D.混合气体的平均相对分子质量
E.反应物
 和
和 的转化率相等
的转化率相等
您最近一年使用:0次
【推荐1】CuCl难溶于水,不溶于乙醇和稀酸, 可溶于Cl-浓度较大的溶液,露置于潮湿空气中易被氧化。回答下列问题。
(1)铜制品发生电化学腐蚀过程中产生CuCl,如图所示。
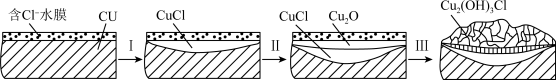
过程I的负极反应式为___________ 。
(2)工业上氯化亚铜可由亚硫酸铵与氯化铜溶液反应制得,其产率与温度、溶液pH的关系如图所示。

析出CuCl晶体的最佳条件为___________ ,
A.60°C左右,pH为2.0~2.5 B.90°C左右,pH为2.0~2.5
C.60°C左右,pH为5.0~6.0 D. 90°C 左右, pH为5.0~6.0
该方法制备CuCl的离子方程式为___________ 。 制得的CuCl先用稀盐酸洗涤,再用乙醇洗涤,乙醇的作用是___________ 。
(3)实验室模拟工业电解氨性含铜蚀刻液的装置如图所示(阴极液主要成分为[Cu(NH3)4]SO4)。电解后阴极液经盐酸酸化,再用蒸馏水稀释,生成CuCl, 阳极区得到副产物硫酸。电解时选用___________ (填 “阳”或“阴”)离子交换膜,阴极电极反应式为___________ 。

(4)用H2还原CuCl制备活性铜的反应为H2(g)+ 2CuCl(s) 2Cu(s)+ 2HCl(g) ΔH=−149 kJ∙mol−1。常温下正反应
2Cu(s)+ 2HCl(g) ΔH=−149 kJ∙mol−1。常温下正反应___________ (填“能” 或“不能” )自发进行。 反应速率υ=υ正−υ逆=k正∙x(H2) −k 逆∙x2(HCl), k 正、k逆分别为正、逆反应速率常数,x为气体的物质的量分数。在T°C和p kPa条件下,上述反应中H2的平衡转化率为80%,该条件下当H2的转化率为60%时, =
=___________ 。(保留两位有效数位)
(1)铜制品发生电化学腐蚀过程中产生CuCl,如图所示。

过程I的负极反应式为
(2)工业上氯化亚铜可由亚硫酸铵与氯化铜溶液反应制得,其产率与温度、溶液pH的关系如图所示。

析出CuCl晶体的最佳条件为
A.60°C左右,pH为2.0~2.5 B.90°C左右,pH为2.0~2.5
C.60°C左右,pH为5.0~6.0 D. 90°C 左右, pH为5.0~6.0
该方法制备CuCl的离子方程式为
(3)实验室模拟工业电解氨性含铜蚀刻液的装置如图所示(阴极液主要成分为[Cu(NH3)4]SO4)。电解后阴极液经盐酸酸化,再用蒸馏水稀释,生成CuCl, 阳极区得到副产物硫酸。电解时选用

(4)用H2还原CuCl制备活性铜的反应为H2(g)+ 2CuCl(s)
 2Cu(s)+ 2HCl(g) ΔH=−149 kJ∙mol−1。常温下正反应
2Cu(s)+ 2HCl(g) ΔH=−149 kJ∙mol−1。常温下正反应 =
=
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
【推荐2】过渡元素的金属及其氧化物常用作反应的催化剂。
(1) 和
和 催化合成
催化合成 的反应如下:
的反应如下: (未配平)
(未配平)
①该反应的催化历程可简化为两步:第Ⅰ步: ;第Ⅱ步的方程式为
;第Ⅱ步的方程式为___________ 。第Ⅰ步反应决定了总反应达到平衡的时间,两步反应的活化能EI___________ EⅡ。(填“>”、“=”或“<”)
②加入Ga可以增大催化剂的表面积。Ga的基态原子核外电子排布式为___________ 。
(2)我国科学家以 和
和 为原料,熔融
为原料,熔融 为离子导体,通过催化电解法制备
为离子导体,通过催化电解法制备 ,装置如图1所示,其中在电极B上的反应过程如图2所示。
,装置如图1所示,其中在电极B上的反应过程如图2所示。

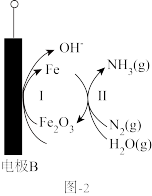
①参与电极B上反应的催化剂是___________ ,
②描述在电极B上催化生成 的过程
的过程___________ 。
(3)富氧条件下, 和NO在钒基催化作用下发生脱硝反应,方程式可表示为
和NO在钒基催化作用下发生脱硝反应,方程式可表示为
主反应: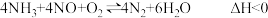
副反应:Ⅰ.
Ⅱ.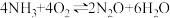
…… ……
不同氨氮比[ ]下,NO的转化率和
]下,NO的转化率和 的生成量随温度的变化曲线如图3和图4所示,测得300℃后,
的生成量随温度的变化曲线如图3和图4所示,测得300℃后, 转化率基本不变。
转化率基本不变。
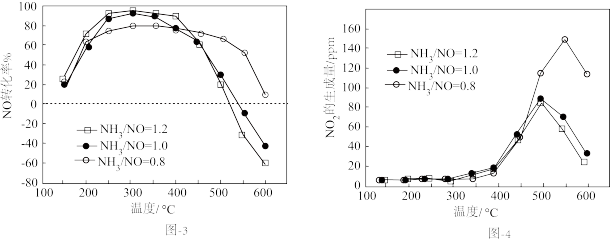
①上述脱硝的主反应中,分别被NO和 氧化的
氧化的 的质量之比为
的质量之比为___________ ,
②超过400℃:温度升高,NO转化率下降,可能原因是___________ ;氨氮比越大,NO转化率越小,可能原因是___________ 。
(1)
 和
和 催化合成
催化合成 的反应如下:
的反应如下: (未配平)
(未配平)①该反应的催化历程可简化为两步:第Ⅰ步:
 ;第Ⅱ步的方程式为
;第Ⅱ步的方程式为②加入Ga可以增大催化剂的表面积。Ga的基态原子核外电子排布式为
(2)我国科学家以
 和
和 为原料,熔融
为原料,熔融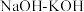 为离子导体,通过催化电解法制备
为离子导体,通过催化电解法制备 ,装置如图1所示,其中在电极B上的反应过程如图2所示。
,装置如图1所示,其中在电极B上的反应过程如图2所示。

①参与电极B上反应的催化剂是
②描述在电极B上催化生成
 的过程
的过程(3)富氧条件下,
 和NO在钒基催化作用下发生脱硝反应,方程式可表示为
和NO在钒基催化作用下发生脱硝反应,方程式可表示为主反应:
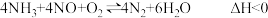
副反应:Ⅰ.

Ⅱ.
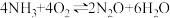
…… ……
不同氨氮比[
 ]下,NO的转化率和
]下,NO的转化率和 的生成量随温度的变化曲线如图3和图4所示,测得300℃后,
的生成量随温度的变化曲线如图3和图4所示,测得300℃后, 转化率基本不变。
转化率基本不变。
①上述脱硝的主反应中,分别被NO和
 氧化的
氧化的 的质量之比为
的质量之比为②超过400℃:温度升高,NO转化率下降,可能原因是
您最近一年使用:0次
【推荐3】下图为相互串联的三个装置,试回答:
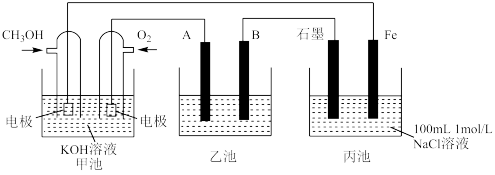
(1)写出甲池负极的电极反应式:_______ 。
(2)若利用乙池在铁片上镀银,则B是_______ (填电极材料),电极反应式是_______ 。
(3)若利用乙池进行粗铜的电解精炼,则_______ 极(填" A"或B")是粗铜。粗铜中杂质Au、Ag在精炼结束后,它们在电解槽中的存在形式和位置为_______ 。
(4)向丙池溶液中滴加几滴酚酞试液,_______ 电极(填“石墨”或“Fe”)周围先出现红色,该电极方程式为:____ ;若甲池消耗3.2g CH3OH气体,则丙池中阳极上产生气体的物质的量为_____ mol。
(5)钢铁的吸氧腐蚀简单示意图如下图:

正极的电极反应式为_______ ,该图某处稍作修改即可成为钢铁电化学防护的简单示意图,请作出修改并标出电子流动方向_______ 。

(1)写出甲池负极的电极反应式:
(2)若利用乙池在铁片上镀银,则B是
(3)若利用乙池进行粗铜的电解精炼,则
(4)向丙池溶液中滴加几滴酚酞试液,
(5)钢铁的吸氧腐蚀简单示意图如下图:

正极的电极反应式为
您最近一年使用:0次

 ℃
℃ ℃
℃


