某校探究性学习小组用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜。探究过程如图:
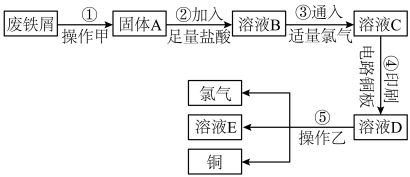
请回答下列问题:
(1)写出步骤②中生成 Fe2+的离子方程式_______ 。(写一个即可)
(2)若将③改加入 H2O2,写出反应的离子方程式:_______ 。
(3)若溶液 B 中只含有 Fe2+而不含 Fe3+,可证明该事实的实验方法是_______(填序号)。
①先加氯水,后加 KSCN 溶液后显红色
②先加 KSCN 溶液,不显红色,再加氯水后显红色
③滴加 NaOH 溶液,只产生白色沉淀,迅速变为灰绿色,最后呈红褐色
④只滴加 KSCN 溶液不显红色
(4)溶液 D 中可能含有的金属阳离子_______ 。

请回答下列问题:
(1)写出步骤②中生成 Fe2+的离子方程式
(2)若将③改加入 H2O2,写出反应的离子方程式:
(3)若溶液 B 中只含有 Fe2+而不含 Fe3+,可证明该事实的实验方法是_______(填序号)。
①先加氯水,后加 KSCN 溶液后显红色
②先加 KSCN 溶液,不显红色,再加氯水后显红色
③滴加 NaOH 溶液,只产生白色沉淀,迅速变为灰绿色,最后呈红褐色
④只滴加 KSCN 溶液不显红色
| A.①② | B.②③ | C.③④ | D.①④ |
更新时间:2023-01-12 20:38:29
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
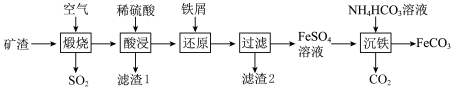
【推荐1】利用金属矿渣(含有FeS2、SiO2及Cu2O)制备FeCO3的实验流程如下。已知煅烧过程中FeS2和Cu2O转化为Fe2O3和CuO。______ (写化学式),该物质是工业制备高纯度硅的原料,写出硅与氯化氢在高温条件下发生的化学方程式:________ 。
(2)FeS2在空气中煅烧的化学方程式为______ 。
(3)在“还原”步骤,在向酸浸后溶液加入过量铁屑,除了能将 转化为
转化为 外,还能
外,还能______ 。若将6 g铁粉加入200 mL  和CuSO4的混合溶液中,充分反应得到200 mL
和CuSO4的混合溶液中,充分反应得到200 mL 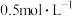 FeSO4溶液和5.2 g固体沉淀物。
FeSO4溶液和5.2 g固体沉淀物。
①5.2 g固体沉淀物的成份为_______ (写化学式)。
②原 溶液的物质的量浓度是
溶液的物质的量浓度是_______ 。
(4)检验 是否完全被还原的实验操作是
是否完全被还原的实验操作是_______ 。
(5)制备FeCO3,写出“沉铁”步骤发生反应的离子方程式:_______ 。
(2)FeS2在空气中煅烧的化学方程式为
(3)在“还原”步骤,在向酸浸后溶液加入过量铁屑,除了能将
 转化为
转化为 外,还能
外,还能 和CuSO4的混合溶液中,充分反应得到200 mL
和CuSO4的混合溶液中,充分反应得到200 mL 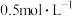 FeSO4溶液和5.2 g固体沉淀物。
FeSO4溶液和5.2 g固体沉淀物。①5.2 g固体沉淀物的成份为
②原
 溶液的物质的量浓度是
溶液的物质的量浓度是(4)检验
 是否完全被还原的实验操作是
是否完全被还原的实验操作是(5)制备FeCO3,写出“沉铁”步骤发生反应的离子方程式:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料。制备TiO2和Ti的原料是钛铁矿,我国的钛铁储量居世界首位。用含Fe2O3的钛铁矿(主要成分为FeTiO3)制备TiO2流程如下:
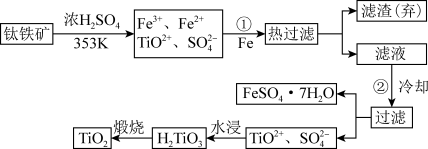
已知反应TiO2++2H2O H2TiO3+2H+ ΔH<0
H2TiO3+2H+ ΔH<0
(1)步骤①加Fe的目的是___________________________________ (用离子方程式表达);步骤②冷却的目的是_________________________________________________________ 。
(2)上述制备TiO2的过程中,可以利用的副产物是__________________ ;考虑成本和废物综合利用因素,废液中应加入______ 处理;在“水浸”步骤中加入大量的水即可获得H2TiO3沉淀,请用相关化学原理解释___________________________________________________ 。
(3)由金红石(TiO2)制取单质钛(Ti),涉及到的步骤为
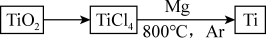
反应TiCl4+2Mg===2MgCl2+Ti在Ar气氛中进行的理由是___________________________ 。

已知反应TiO2++2H2O
 H2TiO3+2H+ ΔH<0
H2TiO3+2H+ ΔH<0(1)步骤①加Fe的目的是
(2)上述制备TiO2的过程中,可以利用的副产物是
(3)由金红石(TiO2)制取单质钛(Ti),涉及到的步骤为
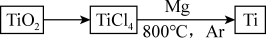
反应TiCl4+2Mg===2MgCl2+Ti在Ar气氛中进行的理由是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】某湿法炼锌厂在除杂过程中产生的黄钾铁矾渣主要含有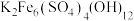 、ZnO、
、ZnO、 ,及少量CaO、MgO、
,及少量CaO、MgO、 等。由黄钾铁矾渣制备复合镍锌铁氧体(
等。由黄钾铁矾渣制备复合镍锌铁氧体(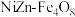 )的流程如下:
)的流程如下:
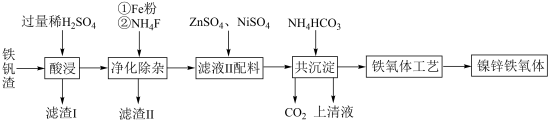
回答下列问题:
(1)“滤渣Ⅰ”的主要成分是___________ 。
(2)写出“净化除杂”中加入铁粉发生的离子反应方程式:___________ 。
(3)在 、
、 、
、 “共沉淀”过程中,三种离子的损失浓度的对数与pH、pH与
“共沉淀”过程中,三种离子的损失浓度的对数与pH、pH与 的关系曲线分别如图1、2。为提高原料利用率,
的关系曲线分别如图1、2。为提高原料利用率, 最好控制在
最好控制在___________ 左右;若以Me代表Fe、Ni、Zn元素,则生成 沉淀的化学反应方程式为
沉淀的化学反应方程式为___________ 。

(4)“共沉淀”过程中温度不宜过高,原因是___________ 。
(5)常温下,向 溶液中滴加
溶液中滴加 ,发生反应:
,发生反应: (已知:
(已知: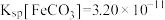 ,
,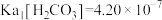 ,
,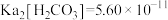 )求该反应的平衡常数K=
)求该反应的平衡常数K=___________ 。
(6)在“铁氧体工艺”阶段制备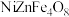 过程中,需加入
过程中,需加入___________ (填“氧化剂”或“还原剂”)。按照上述流程,一座10万吨规模的炼锌厂每年产生黄钾铁矾渣约5万吨, 含量为28%,理论上每年可制备复合镍锌铁氧体(
含量为28%,理论上每年可制备复合镍锌铁氧体(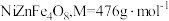 )
)___________ 万吨(保留两位有效数)。
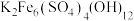 、ZnO、
、ZnO、 ,及少量CaO、MgO、
,及少量CaO、MgO、 等。由黄钾铁矾渣制备复合镍锌铁氧体(
等。由黄钾铁矾渣制备复合镍锌铁氧体(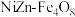 )的流程如下:
)的流程如下:
回答下列问题:
(1)“滤渣Ⅰ”的主要成分是
(2)写出“净化除杂”中加入铁粉发生的离子反应方程式:
(3)在
 、
、 、
、 “共沉淀”过程中,三种离子的损失浓度的对数与pH、pH与
“共沉淀”过程中,三种离子的损失浓度的对数与pH、pH与 的关系曲线分别如图1、2。为提高原料利用率,
的关系曲线分别如图1、2。为提高原料利用率, 最好控制在
最好控制在 沉淀的化学反应方程式为
沉淀的化学反应方程式为
(4)“共沉淀”过程中温度不宜过高,原因是
(5)常温下,向
 溶液中滴加
溶液中滴加 ,发生反应:
,发生反应: (已知:
(已知: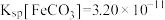 ,
,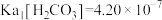 ,
,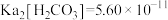 )求该反应的平衡常数K=
)求该反应的平衡常数K=(6)在“铁氧体工艺”阶段制备
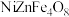 过程中,需加入
过程中,需加入 含量为28%,理论上每年可制备复合镍锌铁氧体(
含量为28%,理论上每年可制备复合镍锌铁氧体( )
)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】用莫尔盐[(NH4)2Fe(SO4)2·6H2O]为浅绿色晶体,隔绝空气时遇强热可完全分解为一种固体产物和多种气体产物(已知产物中无O2,其中确定的成分之一为N2)。在定量分析中莫尔盐常用作标定高锰酸钾、重铬酸钾等溶液的标准物质。回答下列问题:
(1)莫尔盐在空气中比硫酸亚铁稳定,但长期露置于空气中也会变质,可用来检验莫尔盐是否变质的试剂是_________ 。
(2)莫尔盐标定高锰酸钾溶液时,准确移取KMnO4溶液的仪器名称是_________ ,滴定过程中反应的离子方程式为________________________ 。
(3)某课题组组装如图所示的装置,通过实验检验莫尔盐晶体遇强热时的分解产物。实验中可观察到A中绿色粉末逐渐变成红色粉末,据此推测分解产物中有_________ (填化学式),同时装置C中酚酞溶液变红,酚酞溶液的作用是__________________ 。该装置可能存在的缺点是____________________________________ 。
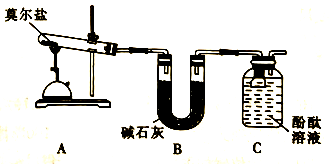 ,
,
(4)为分别检验产物中SO3(g)和SO2(g)的存在,应选用的试剂为_________ 和_________ 。加入试剂后经检验产物中不存在SO3(g),据此写出莫尔盐遇强热分解的化学方程式:_____________________________________________ 。
(1)莫尔盐在空气中比硫酸亚铁稳定,但长期露置于空气中也会变质,可用来检验莫尔盐是否变质的试剂是
(2)莫尔盐标定高锰酸钾溶液时,准确移取KMnO4溶液的仪器名称是
(3)某课题组组装如图所示的装置,通过实验检验莫尔盐晶体遇强热时的分解产物。实验中可观察到A中绿色粉末逐渐变成红色粉末,据此推测分解产物中有
 ,
,(4)为分别检验产物中SO3(g)和SO2(g)的存在,应选用的试剂为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】由两种元素组成的化合物A,按如下流程进行实验。气体B能使湿润的红色石蕊试纸变蓝;固体E可做耐高温材料。
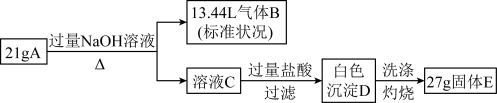
请回答:
(1)组成A的两种元素是_______ (用元素符号表示);
(2)写出A与NaOH溶液反应的化学方程式_______ ;
(3)溶液C与过量盐酸反应的离子方程式是_______ ;
(4)气体B与氧化铁在高温下反应,生成黑色粉末(纯净物),黑色粉末成分可能是_______ ,请给出检验黑色粉末的实验方案_______ 。

请回答:
(1)组成A的两种元素是
(2)写出A与NaOH溶液反应的化学方程式
(3)溶液C与过量盐酸反应的离子方程式是
(4)气体B与氧化铁在高温下反应,生成黑色粉末(纯净物),黑色粉末成分可能是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出)。
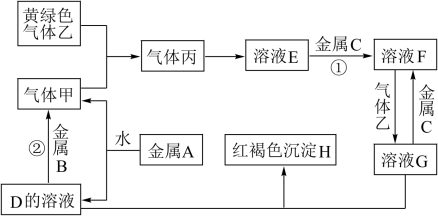
请根据以上信息回答下列问题
(1)写出下列物质的化学式:A__ ;H ___ ; G____ ;乙___ 。
(2)写出下列反应的化学方程式:
反应①_______ ;
反应②________ 。
(3)检测溶液G中金属离子的常用方法是:____ 。

请根据以上信息回答下列问题
(1)写出下列物质的化学式:A
(2)写出下列反应的化学方程式:
反应①
反应②
(3)检测溶液G中金属离子的常用方法是:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】由废旧铜包钢线缆[含Fe、Cu和少量 、碳]回收铜,并制备磷酸亚铁锂,有望代替传统的锂离子电池正极材料。其工艺流程如图所示。
、碳]回收铜,并制备磷酸亚铁锂,有望代替传统的锂离子电池正极材料。其工艺流程如图所示。
(1)常温下进行“酸溶”时,稀硝酸不宜用浓硝酸代替,原因为_______ (写一条)。
(2)滤渣1的主要成分为_______ (填名称)。滤渣2主要成分_______ (填化学式)。
(3)写出用 溶液通过湿法制备Cu的离子反应方程式:
溶液通过湿法制备Cu的离子反应方程式:_______ 。
(4)若滤液2中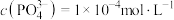 ,则“转化”过程调pH不能高于
,则“转化”过程调pH不能高于_______ {已知:常温下,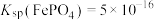 、
、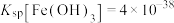 、
、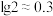 。忽略溶液体积变化}。
。忽略溶液体积变化}。
(5)“焙烧”反应的化学方程式为_______ ;该工序需在氩气氛围中进行的原因为_______ 。
(6)上述工艺中可以循环利用的物质为_______ (填化学式)。
 、碳]回收铜,并制备磷酸亚铁锂,有望代替传统的锂离子电池正极材料。其工艺流程如图所示。
、碳]回收铜,并制备磷酸亚铁锂,有望代替传统的锂离子电池正极材料。其工艺流程如图所示。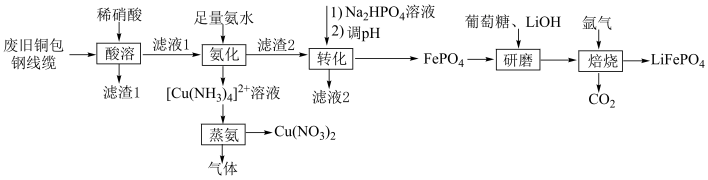
(1)常温下进行“酸溶”时,稀硝酸不宜用浓硝酸代替,原因为
(2)滤渣1的主要成分为
(3)写出用
 溶液通过湿法制备Cu的离子反应方程式:
溶液通过湿法制备Cu的离子反应方程式:(4)若滤液2中
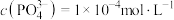 ,则“转化”过程调pH不能高于
,则“转化”过程调pH不能高于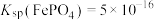 、
、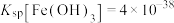 、
、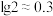 。忽略溶液体积变化}。
。忽略溶液体积变化}。(5)“焙烧”反应的化学方程式为
(6)上述工艺中可以循环利用的物质为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
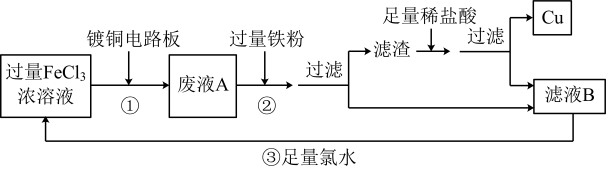
【推荐2】电子工业中常用FeCl3溶液做刻蚀液,来腐蚀镀铜板制作印刷电路板,并回收Cu和综合利用FeCl3溶液。流程图如下:
请回答:
(1)废液A中含有的金属阳离子有Fe3+和_______ 。
(2)过程①反应的离子方程式是_______ 。
(3)过程②中发生化合反应的离子方程式为_______ 。过程②中发生置换反应的离子方程式为_______ 。
(4)过程③中反应的离子方程式是_______ 。
(5)检验滤液B中金属阳离子存在的方法是_______ (简述操作方法、现象和结论)。

请回答:
(1)废液A中含有的金属阳离子有Fe3+和
(2)过程①反应的离子方程式是
(3)过程②中发生化合反应的离子方程式为
(4)过程③中反应的离子方程式是
(5)检验滤液B中金属阳离子存在的方法是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】已知X为 和
和 的混合物,且知氧化性顺序:
的混合物,且知氧化性顺序: 。取等质量的两份X样品进行如图所示的实验:
。取等质量的两份X样品进行如图所示的实验:
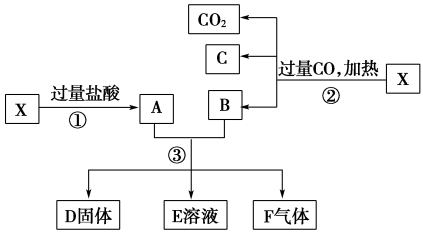
(1)若溶液E中只有一种金属离子,则一定是___________ ;若D固体是纯净物,该固体是___________ 。
(2)印刷电路板是由高分子材料和铜箔复合而成,可用A溶液作“腐蚀剂”刻制印刷电路的离子反应方程式为___________ 。
(3)若步骤③所得固体D是纯净物,质量为 ,无色气体F在标准状况下的体积为
,无色气体F在标准状况下的体积为 。则每份X样品中
。则每份X样品中 的质量为
的质量为___________ 。
 和
和 的混合物,且知氧化性顺序:
的混合物,且知氧化性顺序: 。取等质量的两份X样品进行如图所示的实验:
。取等质量的两份X样品进行如图所示的实验:
(1)若溶液E中只有一种金属离子,则一定是
(2)印刷电路板是由高分子材料和铜箔复合而成,可用A溶液作“腐蚀剂”刻制印刷电路的离子反应方程式为
(3)若步骤③所得固体D是纯净物,质量为
 ,无色气体F在标准状况下的体积为
,无色气体F在标准状况下的体积为 。则每份X样品中
。则每份X样品中 的质量为
的质量为
您最近一年使用:0次



