油气开采、石油化工、煤化工等行业废气普遍含有硫化氢,需要回收处理并加以利用。回答下列问题:
已知下列反应的热化学方程式:
①
②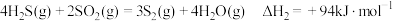
③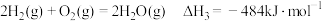
计算 热分解反应④
热分解反应④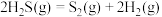 的
的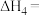
_______  。
。
已知下列反应的热化学方程式:
①

②
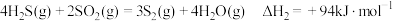
③
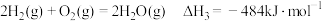
计算
 热分解反应④
热分解反应④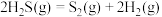 的
的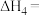
 。
。
2023高三·全国·专题练习 查看更多[4]
(已下线)第一部分 二轮专题突破 专题10 热化学方程式的书写与盖斯定律(已下线)01 常考题空1 热化学方程式及反应热的计算 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)(已下线)题型14 盖斯定律与热化学方程式(已下线)题型一 反应热的计算-备战2024年高考化学答题技巧与模板构建
更新时间:2023-02-01 21:12:33
|
【知识点】 盖斯定律与热化学方程式解读
相似题推荐
填空题
|
较难
(0.4)
【推荐1】目前低碳经济已成为科学家研究的主要课题之一,如何降低大气中CO2的含量及有效地开发利用CO2,引起全世界的关注:
(1)用电弧法合成的储氢材料常伴有大量的碳纳米颗粒(杂质),这些杂质颗粒通常用硫酸酸化的锰酸钾氧化除去,在反应中,杂质碳被氧化为无污染气体而除去,Mn元素转变为Mn2+,请写出对应的化学方程式并配平:___________ ;
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下两组数据:
CO2(g)+H2(g),得到如下两组数据:
①实验2条件下的H2O 体积分数为___________ ;
②下列方法中可以证明上述已达平衡状态的是___________ ;
a.单位时间内生成n mol H2的同时生成n mol CO
b.容器内压强不再变化
c.混合气体密度不再变化
d.混合气体的平均相对分子质量不再变化
e.CO2的质量分数不再变化
③已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:
则反应CO(g)+H2O(g) CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=
CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=___________ 。
(3)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g) △ H 1=-393.5kJ·mol-1
CO2(g)+C(s) =2CO(g) △ H 2=+172.5kJ·mol-1
S(s)+O2(g) =SO2(g) △ H 3=-296.0kJ·mol-1
请写出CO除SO2的热化学方程式___________ 。
(4)25℃时,在20 mL0.1 mol/L醋酸中加入V mL0.1 mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,
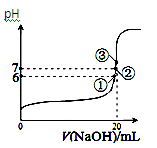
下列说法正确的是___________ 。
A.pH=3的CH3COOH溶液和pH=11的CH3COONa溶液中,由水电离出的c(OH-)相等
B.①点时pH=6,此时溶液中,c(CH3COO-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(CH3COO-)=c(Na+)
D.③点时V=20mL,此时溶液中c(CH3COO-)< c(Na+)=0.1mol/L
(5)下图是一种新型燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。回答下列问题:

①写出A极发生的电极反应式___________ ;
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与___________ 极(填“C”或“D”)相连。
(1)用电弧法合成的储氢材料常伴有大量的碳纳米颗粒(杂质),这些杂质颗粒通常用硫酸酸化的锰酸钾氧化除去,在反应中,杂质碳被氧化为无污染气体而除去,Mn元素转变为Mn2+,请写出对应的化学方程式并配平:
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)
 CO2(g)+H2(g),得到如下两组数据:
CO2(g)+H2(g),得到如下两组数据:| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
①实验2条件下的H2O 体积分数为
②下列方法中可以证明上述已达平衡状态的是
a.单位时间内生成n mol H2的同时生成n mol CO
b.容器内压强不再变化
c.混合气体密度不再变化
d.混合气体的平均相对分子质量不再变化
e.CO2的质量分数不再变化
③已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:
| 气化反应式 | lgK | ||
| 700K | 900K | 1200K | |
| C(s)+H2O(g)=CO(g)+H2(g) | -2.64 | -0.39 | 1.58 |
| C(s)+2H2O(g)=CO2(g)+2H2(g) | -1.67 | -0.03 | 1.44 |
则反应CO(g)+H2O(g)
 CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=
CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=(3)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g) △ H 1=-393.5kJ·mol-1
CO2(g)+C(s) =2CO(g) △ H 2=+172.5kJ·mol-1
S(s)+O2(g) =SO2(g) △ H 3=-296.0kJ·mol-1
请写出CO除SO2的热化学方程式
(4)25℃时,在20 mL0.1 mol/L醋酸中加入V mL0.1 mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,

下列说法正确的是
A.pH=3的CH3COOH溶液和pH=11的CH3COONa溶液中,由水电离出的c(OH-)相等
B.①点时pH=6,此时溶液中,c(CH3COO-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(CH3COO-)=c(Na+)
D.③点时V=20mL,此时溶液中c(CH3COO-)< c(Na+)=0.1mol/L
(5)下图是一种新型燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。回答下列问题:

①写出A极发生的电极反应式
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】随着人们生活的发展,能源的利用倍受关注。
(1)甲醇中(CH3OH)作为一种清洁能源开始走进人们的生活。某实验小组向一10 L的恒容密闭容器中通入1 molCO和3molH2,发生反应:CO(g)+2H2(g) CH3OH(g) △H<0,测得CO在不同温度下的平衡转化率与压强的关系如图1所示。
CH3OH(g) △H<0,测得CO在不同温度下的平衡转化率与压强的关系如图1所示。
①已知:2H2(g)+O2(g)===2H2O(g) ΔH1;
CO(g)+ O2(g)=CO2(g) ΔH2;
O2(g)=CO2(g) ΔH2;
CH3OH(g)+ O2(g)= CO2(g)+2H2O(g) ΔH3.
O2(g)= CO2(g)+2H2O(g) ΔH3.
则ΔH=__________(用含ΔH1、ΔH2、ΔH3的代数式表示)。
②温度T1、T2、T3由小到大的顺序为__________________,a、b、c三点对应的混合气体的平均摩尔质
量M(a)、M(b)、M(c)大到小的顺序为_____________________。
③温度为T2时,化学平衡常数K=_________(保留三位有效数字)。
(2)电化学在生产生活中有广泛的应用。
①高铁电池因其储电容量大而开始应用于电动汽车。已知该电池放电时的总反应为2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,则电解质溶液可能为__________ (填字母)。
A.KOH溶液 B.H2SO4C.稀HNO3
②甲醇燃料电池能大幅度地提高甲醇的利用率,其工作原理如图2所示,电解质是掺杂了Y2O3的ZrO2晶体,它能传导O2-。工作时O2-向__________(填“正极”或“负极”)移动,负极的电极反应式为____________。
③铝一空气电池装置如图所示,该电池的负极是__________(填“铝电极”或“空气电极”),每消耗0.54g A1,需消耗标准状况下的空气_______(设空气中O2的体积分数为20%)L。
(1)甲醇中(CH3OH)作为一种清洁能源开始走进人们的生活。某实验小组向一10 L的恒容密闭容器中通入1 molCO和3molH2,发生反应:CO(g)+2H2(g)
 CH3OH(g) △H<0,测得CO在不同温度下的平衡转化率与压强的关系如图1所示。
CH3OH(g) △H<0,测得CO在不同温度下的平衡转化率与压强的关系如图1所示。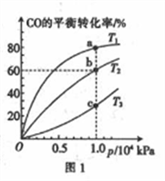
①已知:2H2(g)+O2(g)===2H2O(g) ΔH1;
CO(g)+
 O2(g)=CO2(g) ΔH2;
O2(g)=CO2(g) ΔH2;CH3OH(g)+
 O2(g)= CO2(g)+2H2O(g) ΔH3.
O2(g)= CO2(g)+2H2O(g) ΔH3.则ΔH=__________(用含ΔH1、ΔH2、ΔH3的代数式表示)。
②温度T1、T2、T3由小到大的顺序为__________________,a、b、c三点对应的混合气体的平均摩尔质
量M(a)、M(b)、M(c)大到小的顺序为_____________________。
③温度为T2时,化学平衡常数K=_________(保留三位有效数字)。
(2)电化学在生产生活中有广泛的应用。
①高铁电池因其储电容量大而开始应用于电动汽车。已知该电池放电时的总反应为2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,则电解质溶液可能为__________ (填字母)。
A.KOH溶液 B.H2SO4C.稀HNO3
②甲醇燃料电池能大幅度地提高甲醇的利用率,其工作原理如图2所示,电解质是掺杂了Y2O3的ZrO2晶体,它能传导O2-。工作时O2-向__________(填“正极”或“负极”)移动,负极的电极反应式为____________。
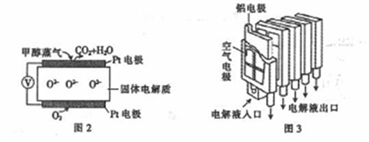
③铝一空气电池装置如图所示,该电池的负极是__________(填“铝电极”或“空气电极”),每消耗0.54g A1,需消耗标准状况下的空气_______(设空气中O2的体积分数为20%)L。
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】铜、硫的单质及其化合物在生产、生活中应用广泛,辉铜矿(主要成分是Cu2S)是冶炼铜和制硫酸的重要原料。
(1)已知:①2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) △H=-768.2kJ/mol
②2Cu2O(s)+ Cu2S(s)=6Cu(s)+ SO2(g) △H=+116.0kJ/mol
则Cu2S(s)+O2(g)=2Cu(s)+SO2(g) △H=__________ 。
(2)利用化石燃料开采、加工过程产生的H2S废气可制取氢气,既廉价又环保,若得到56L(标准状况)氢气,则转移的电子为________ 。
(3)上述冶炼过程中会产生大量的SO2,回收处理SO2不仅能防止环境污染,而且能变害为宝。回收处理的方法之一是先将SO2转化为SO3,然后再转化为H2SO4。
①450℃时,某恒容密闭容器中存在反应:2SO2(g)+O2(g) 2SO3(g)△H<0,下列事实能表明该反应达到平衡的是
2SO3(g)△H<0,下列事实能表明该反应达到平衡的是___________ 。
A.容器内气体密度不变 B.O2、SO2的消耗速率之比为1:2
C.n(SO2):n(O2):n(SO3)=2:1:2 D.容器内压强不再发生交化
②450℃、0.1Mpa下,将2.0molSO2和1.0molO2置于5L密闭容器中开始反应,保持温度和容器体积不变,SO2的转化率(a)随着时间(t)的变化如图1所示。则该温度下反应的平衡常数K=_____ 。若维持其他条件不变,使反应开始时温度升高到500℃ ,请在图l中画出反应从开始到平衡时SO2转化率的变化图像_______ 。
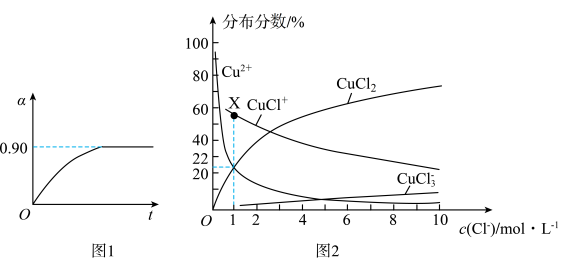
(4)已知CuCl2溶液中,铜元素的存在形式与c(Cl-)的相对大小有关,具体情况如图2所示(分布分数是指平衡体系中各含铜微粒物质的量占铜元素总物质的量的百分比)。
①若溶液中含铜微粒的总浓度为amol/L,则X点对应的c(CuCl+)=___________ (用含a的代数式表示)。
②向c(Cl-)=1mol/L的氯化铜溶液中滴入少量AgNO3溶液,则浓度最大的含铜微粒发生反应的离子方程式为__________ 。
(1)已知:①2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) △H=-768.2kJ/mol
②2Cu2O(s)+ Cu2S(s)=6Cu(s)+ SO2(g) △H=+116.0kJ/mol
则Cu2S(s)+O2(g)=2Cu(s)+SO2(g) △H=
(2)利用化石燃料开采、加工过程产生的H2S废气可制取氢气,既廉价又环保,若得到56L(标准状况)氢气,则转移的电子为
(3)上述冶炼过程中会产生大量的SO2,回收处理SO2不仅能防止环境污染,而且能变害为宝。回收处理的方法之一是先将SO2转化为SO3,然后再转化为H2SO4。
①450℃时,某恒容密闭容器中存在反应:2SO2(g)+O2(g)
 2SO3(g)△H<0,下列事实能表明该反应达到平衡的是
2SO3(g)△H<0,下列事实能表明该反应达到平衡的是A.容器内气体密度不变 B.O2、SO2的消耗速率之比为1:2
C.n(SO2):n(O2):n(SO3)=2:1:2 D.容器内压强不再发生交化
②450℃、0.1Mpa下,将2.0molSO2和1.0molO2置于5L密闭容器中开始反应,保持温度和容器体积不变,SO2的转化率(a)随着时间(t)的变化如图1所示。则该温度下反应的平衡常数K=

(4)已知CuCl2溶液中,铜元素的存在形式与c(Cl-)的相对大小有关,具体情况如图2所示(分布分数是指平衡体系中各含铜微粒物质的量占铜元素总物质的量的百分比)。
①若溶液中含铜微粒的总浓度为amol/L,则X点对应的c(CuCl+)=
②向c(Cl-)=1mol/L的氯化铜溶液中滴入少量AgNO3溶液,则浓度最大的含铜微粒发生反应的离子方程式为
您最近一年使用:0次



