为深刻理解强电解质和弱电解质的概念,某小组以室温下2mL2mol/L盐酸和2mL2mol/L醋酸为例,设计了如下角度对比分析。已知室温下醋酸的 ;
;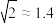 。请按要求回答下列问题。
。请按要求回答下列问题。
(1)写出 的电离方程式:
的电离方程式:_______ 。
(2)上述盐酸、醋酸中 分别为2mol/L、
分别为2mol/L、_______ 。
(3)室温下,在上述盐酸、醋酸中分别滴入1mol/L 溶液,观察到二者都有气泡冒出。可预测:
溶液,观察到二者都有气泡冒出。可预测: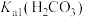
_______ 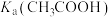 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(4)将上述盐酸、醋酸用注射器分别注入到各盛有0.03gMg条的两个锥形瓶中,塞紧橡胶塞。测得锥形瓶内气体的压强随时间的变化如图所示。
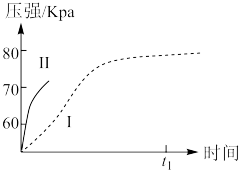
①能表示醋酸参与反应的曲线为_______ (填编号)。
②在图将曲线Ⅱ补充画至 
时刻 _______ 。
(5)分别向盛有上述盐酸、醋酸的烧杯中加2mL水,忽略混合溶液体积变化。则稀释后的盐酸、醋酸溶液中的 分别为
分别为_______ mol/L、_______ mol/L。
(6)中和上述醋酸溶液,需滴入2mol/LNaOH溶液的体积为_______ mL。当醋酸被中和至50%时,溶液中除 外各种粒子浓度由大到小的顺序为
外各种粒子浓度由大到小的顺序为_______ 。
 ;
;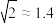 。请按要求回答下列问题。
。请按要求回答下列问题。(1)写出
 的电离方程式:
的电离方程式:(2)上述盐酸、醋酸中
 分别为2mol/L、
分别为2mol/L、(3)室温下,在上述盐酸、醋酸中分别滴入1mol/L
 溶液,观察到二者都有气泡冒出。可预测:
溶液,观察到二者都有气泡冒出。可预测: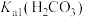
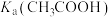 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(4)将上述盐酸、醋酸用注射器分别注入到各盛有0.03gMg条的两个锥形瓶中,塞紧橡胶塞。测得锥形瓶内气体的压强随时间的变化如图所示。

①能表示醋酸参与反应的曲线为
②在图将曲线Ⅱ

(5)分别向盛有上述盐酸、醋酸的烧杯中加2mL水,忽略混合溶液体积变化。则稀释后的盐酸、醋酸溶液中的
 分别为
分别为(6)中和上述醋酸溶液,需滴入2mol/LNaOH溶液的体积为
 外各种粒子浓度由大到小的顺序为
外各种粒子浓度由大到小的顺序为
21-22高二上·天津河西·期末 查看更多[4]
天津市河西区2021-2022学年高二上学期期末质量调查化学试题四川省绵阳市高中2022-2023学年高二理科突击班下学期3月月考化学试题(已下线)专题04 电离平衡-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(天津专用)(已下线)寒假作业05 电离平衡及溶液的酸碱性-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)
更新时间:2023-02-10 09:17:52
|
【知识点】 一元强酸与一元弱酸的比较解读
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】Ⅰ.水的电离平衡曲线如图所示。若以A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态为B点。
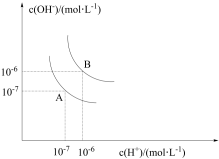
(1)在100℃时,Kw的表达式为________ ,在此温度下,Kw的值为________ mol2/L2。
(2)在室温下,将pH=9的Ba(OH)2溶液与pH=5的稀盐酸混合,欲使混合溶液pH=7,则Ba(OH)2溶液与盐酸的体积比为________ 。
(3)室温时将pH为3的硫酸溶液稀释100倍,稀释后溶液中,c( )和c(H+)之比为
)和c(H+)之比为________ 。
Ⅱ.现有溶质为①CH3COOH,②HCl、③H2SO4的三种溶液,根据要求回答下列问题:
(1)写出①的电离方程式:________ 。
(2)当它们pH相同时,其物质的量浓度最大的是________ (填序号)。
(3)当它们的物质的量浓度相同时,其pH最小的是________ (填序号)。
(4)在室温下,将c(H+)均为0.1mol/L的三种酸分别加水稀释至原来的10倍,c(H+)由大到小的顺序为________ (填序号)。
(5)体积和物质的量浓度均相同的①②③三种酸溶液,分别与相同浓度的烧碱溶液恰好完全反应,所需烧碱溶液的体积比为________ 。
(6)三种酸溶液的pH相同时,若消耗等量的Zn,则需三种酸溶液的体积大小关系为________ (填序号)。

(1)在100℃时,Kw的表达式为
(2)在室温下,将pH=9的Ba(OH)2溶液与pH=5的稀盐酸混合,欲使混合溶液pH=7,则Ba(OH)2溶液与盐酸的体积比为
(3)室温时将pH为3的硫酸溶液稀释100倍,稀释后溶液中,c(
 )和c(H+)之比为
)和c(H+)之比为Ⅱ.现有溶质为①CH3COOH,②HCl、③H2SO4的三种溶液,根据要求回答下列问题:
(1)写出①的电离方程式:
(2)当它们pH相同时,其物质的量浓度最大的是
(3)当它们的物质的量浓度相同时,其pH最小的是
(4)在室温下,将c(H+)均为0.1mol/L的三种酸分别加水稀释至原来的10倍,c(H+)由大到小的顺序为
(5)体积和物质的量浓度均相同的①②③三种酸溶液,分别与相同浓度的烧碱溶液恰好完全反应,所需烧碱溶液的体积比为
(6)三种酸溶液的pH相同时,若消耗等量的Zn,则需三种酸溶液的体积大小关系为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】水是极弱的电解质,改变温度或加入某些电解质会影响水的电离。请回答下列问题。
(1)若纯水在100℃时 ,该温度下
,该温度下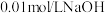 溶液的
溶液的
___________ 。
(2)25℃时,向水中加入少量碳酸钠固体,得到 为11的溶液,碳酸钠水解的离子方程式为
为11的溶液,碳酸钠水解的离子方程式为___________ ,由水电离出的
___________  。
。
(3)体积均为 、
、 均为2的盐酸与一元酸
均为2的盐酸与一元酸 ,加水稀释过程中
,加水稀释过程中 与溶液体积的关系如图所示,则
与溶液体积的关系如图所示,则 是
是___________ (填“强酸”或“弱酸”),理由是___________ 。

(4)电离平衡常数是衡量弱电解质电离强弱的物理量。已知:
①25℃时,等浓度的 溶液、
溶液、 溶液和
溶液和 溶液,其溶液的
溶液,其溶液的 由大到小的顺序为
由大到小的顺序为___________ 。
②25℃时,在 的醋酸溶液中由醋酸电离出的
的醋酸溶液中由醋酸电离出的 约是由水电离出的
约是由水电离出的 的
的_____ 倍。
(1)若纯水在100℃时
 ,该温度下
,该温度下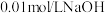 溶液的
溶液的
(2)25℃时,向水中加入少量碳酸钠固体,得到
 为11的溶液,碳酸钠水解的离子方程式为
为11的溶液,碳酸钠水解的离子方程式为
 。
。(3)体积均为
 、
、 均为2的盐酸与一元酸
均为2的盐酸与一元酸 ,加水稀释过程中
,加水稀释过程中 与溶液体积的关系如图所示,则
与溶液体积的关系如图所示,则 是
是
(4)电离平衡常数是衡量弱电解质电离强弱的物理量。已知:
| 化学式 | 电离常数( ) ) |
 | 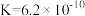 |
 | 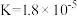 |
 | 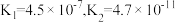 |
 溶液、
溶液、 溶液和
溶液和 溶液,其溶液的
溶液,其溶液的 由大到小的顺序为
由大到小的顺序为②25℃时,在
 的醋酸溶液中由醋酸电离出的
的醋酸溶液中由醋酸电离出的 约是由水电离出的
约是由水电离出的 的
的
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】一定温度下,有a.盐酸、b.硫酸、c.醋酸三种酸:(用>或=表示) 如:a>b=c
①当其物质的量浓度相同时,c(H+)由大到小的关系是_________ 。
②同体积、同物质的量浓度的三种酸溶液,中和相同物质的量浓度的NaOH的体积由大到小的关系是___________________ ;
③当pH相同、体积相同时,分别加入足量锌,相同状况下产生的气体体积由大到小的关系是_______ ;
④当pH相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的氢气(相同状况)则反应所需时间的长短关系是____________ ;
⑤如果三种酸的浓度相同时,则由水电离出的氢离子浓度由大到小的关系为___________ 。
①当其物质的量浓度相同时,c(H+)由大到小的关系是
②同体积、同物质的量浓度的三种酸溶液,中和相同物质的量浓度的NaOH的体积由大到小的关系是
③当pH相同、体积相同时,分别加入足量锌,相同状况下产生的气体体积由大到小的关系是
④当pH相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的氢气(相同状况)则反应所需时间的长短关系是
⑤如果三种酸的浓度相同时,则由水电离出的氢离子浓度由大到小的关系为
您最近一年使用:0次



