过氧化氢与尿素通过氢键形成加合物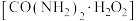 ,这是一种高效、安全的固态过氧化氢形式,既解决了储藏运输等困难,也提高了高活性高含量氧在水溶液中的稳定性。
,这是一种高效、安全的固态过氧化氢形式,既解决了储藏运输等困难,也提高了高活性高含量氧在水溶液中的稳定性。
I.加合物的制备
量取一定量 溶液放于反应容器中,再加入尿素。控制
溶液放于反应容器中,再加入尿素。控制 下加热几分钟,得到无色溶液。继续加热,观察到针状晶体在溶液中逐渐生长,至只有极少量水时,停止加热,冷却至室温,过滤,得到产品。
下加热几分钟,得到无色溶液。继续加热,观察到针状晶体在溶液中逐渐生长,至只有极少量水时,停止加热,冷却至室温,过滤,得到产品。
II.产品纯度测定
实验步骤:填写下述测定步骤中的空白。
(1)取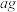 产品至
产品至 烧杯中,
烧杯中,________________________ ,将溶液转移至 容量瓶中定容并摇匀。吸取
容量瓶中定容并摇匀。吸取 溶液于
溶液于______________ 中,加入 水和
水和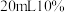 硫酸,用
硫酸,用 溶液(不与尿素反应)滳定至粉红色,
溶液(不与尿素反应)滳定至粉红色, 不褪色。平行测定三次,平均消耗
不褪色。平行测定三次,平均消耗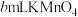 溶液。
溶液。
数据分析:
(2)酸性 溶液滴定
溶液滴定 时,氧化剂与还原剂的物质的量之比为
时,氧化剂与还原剂的物质的量之比为_______________ ,据此计算产品的纯度为_______________  (用含
(用含 、
、 、
、 的代数式表示)。
的代数式表示)。
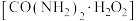 ,这是一种高效、安全的固态过氧化氢形式,既解决了储藏运输等困难,也提高了高活性高含量氧在水溶液中的稳定性。
,这是一种高效、安全的固态过氧化氢形式,既解决了储藏运输等困难,也提高了高活性高含量氧在水溶液中的稳定性。I.加合物的制备
量取一定量
 溶液放于反应容器中,再加入尿素。控制
溶液放于反应容器中,再加入尿素。控制 下加热几分钟,得到无色溶液。继续加热,观察到针状晶体在溶液中逐渐生长,至只有极少量水时,停止加热,冷却至室温,过滤,得到产品。
下加热几分钟,得到无色溶液。继续加热,观察到针状晶体在溶液中逐渐生长,至只有极少量水时,停止加热,冷却至室温,过滤,得到产品。II.产品纯度测定
实验步骤:填写下述测定步骤中的空白。
(1)取
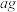 产品至
产品至 烧杯中,
烧杯中, 容量瓶中定容并摇匀。吸取
容量瓶中定容并摇匀。吸取 溶液于
溶液于 水和
水和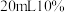 硫酸,用
硫酸,用 溶液(不与尿素反应)滳定至粉红色,
溶液(不与尿素反应)滳定至粉红色, 不褪色。平行测定三次,平均消耗
不褪色。平行测定三次,平均消耗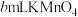 溶液。
溶液。数据分析:
(2)酸性
 溶液滴定
溶液滴定 时,氧化剂与还原剂的物质的量之比为
时,氧化剂与还原剂的物质的量之比为 (用含
(用含 、
、 、
、 的代数式表示)。
的代数式表示)。
2023高三·全国·专题练习 查看更多[1]
(已下线)题型43 氧化还原滴定——高锰酸钾法
更新时间:2023-02-25 13:01:13
|
【知识点】 探究物质组成或测量物质的含量解读
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】氧化钪 可用作半导体镀层的蒸镀材料。可从金属提取工艺中的固体废料“赤泥”(含有
可用作半导体镀层的蒸镀材料。可从金属提取工艺中的固体废料“赤泥”(含有 等)里回收:
等)里回收: 。请结合流程,回答以下问题:
。请结合流程,回答以下问题: 和
和 性质较稳定,不易被还原,且
性质较稳定,不易被还原,且 难溶于盐酸;
难溶于盐酸;
②“熔炼”过程中,单质硅和大部分单质铁转化为熔融物分离出来;
③草酸可与多种金属离子形成可溶性络合物;
④常温下,部分氢氧化物的溶度积常数约为下表所示:
(1)元素Sc在元素周期表中位于_______ 区。
(2)“熔炼”时,请写出生成Fe的反应方程式_______ 。
(3)“酸浸”时,滤渣的主要成分为_______ (填化学式)。
(4)“氧化”时,加入 的目的是
的目的是_______ (用离子方程式表示)。
(5)常温下,“调pH”时,溶液中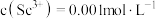 ,为除去杂质离子,应控制的pH范围是
,为除去杂质离子,应控制的pH范围是_______ ;为检验该杂质离子是否除尽,可选用_______ (填化学式)溶液进行检验。(当溶液中某离子浓度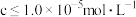 时,可认为该离子沉淀完全)
时,可认为该离子沉淀完全)
(6)反应过程中,测得钪的沉淀率随 的变化情况如图1所示。当草酸用量过多时,钪的沉淀率下降的原因是
的变化情况如图1所示。当草酸用量过多时,钪的沉淀率下降的原因是_______ 。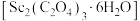 在空气中加热,
在空气中加热, 随温度的变化情况如图2所示。250℃时,晶体的主要成分是
随温度的变化情况如图2所示。250℃时,晶体的主要成分是_______ (填化学式) 。
。
 可用作半导体镀层的蒸镀材料。可从金属提取工艺中的固体废料“赤泥”(含有
可用作半导体镀层的蒸镀材料。可从金属提取工艺中的固体废料“赤泥”(含有 等)里回收:
等)里回收: 。请结合流程,回答以下问题:
。请结合流程,回答以下问题:
 和
和 性质较稳定,不易被还原,且
性质较稳定,不易被还原,且 难溶于盐酸;
难溶于盐酸;②“熔炼”过程中,单质硅和大部分单质铁转化为熔融物分离出来;
③草酸可与多种金属离子形成可溶性络合物;
④常温下,部分氢氧化物的溶度积常数约为下表所示:
| 物质 |  |  | 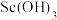 |
 | 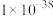 |  | 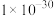 |
(2)“熔炼”时,请写出生成Fe的反应方程式
(3)“酸浸”时,滤渣的主要成分为
(4)“氧化”时,加入
 的目的是
的目的是(5)常温下,“调pH”时,溶液中
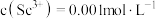 ,为除去杂质离子,应控制的pH范围是
,为除去杂质离子,应控制的pH范围是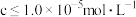 时,可认为该离子沉淀完全)
时,可认为该离子沉淀完全)(6)反应过程中,测得钪的沉淀率随
 的变化情况如图1所示。当草酸用量过多时,钪的沉淀率下降的原因是
的变化情况如图1所示。当草酸用量过多时,钪的沉淀率下降的原因是
 在空气中加热,
在空气中加热, 随温度的变化情况如图2所示。250℃时,晶体的主要成分是
随温度的变化情况如图2所示。250℃时,晶体的主要成分是 。
。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】硫酸铜在工农业生产中有着重要的用途。回答下列问题:
(1)以印刷线路板的碱性蚀刻废液主要成分为{[Cu(NH3)4]Cl2}为原料制备CuSO4·5H2O晶体。取一定量蚀刻废液和稍过量的NaOH溶液,加入如图所示实验装置的三颈烧瓶中,在搅拌下加热反应并通入空气;待产生大量的黑色沉淀时停止反应,趁热过滤、洗涤,得到CuO固体,所得固体经酸溶、结晶、过滤等操作,得到CuSO4·5H2O晶体。

①[Cu(NH3)4]Cl2中含有的化学键有_______ 。
②装置X的作用是_______ 。
③用蚀刻废液制备CuO反应的化学方程式为_______ 。
④检验CuO固体是否洗净的实验方法是_______ 。
(2)测定产品纯度:准确称取0.5000gCuSO4·5H2O样品,加适量水溶解,转移至碘量瓶中,加过量KI溶液并用稀硫酸酸化,以淀粉溶液为指示剂,用0.1000mol·L-1Na2S2O3标准溶液滴定至终点,消耗 Na2S2O3溶液19.80mL。测定过程中发生下列反应:2Cu2++4I-=2CuI↓+I2、2S2O +I2=S4O
+I2=S4O +2I-,滴定终点的实验现象为
+2I-,滴定终点的实验现象为_______ 硫酸铜晶体的纯度为_______ 。
(3)为探究硫酸铜晶体的热稳定性,某学生取少量硫酸铜晶体进行实验,装置如图所示。

实验现象:A中蓝色晶体逐渐变成白色粉末,最后变成黑色粉末;B中产生白色沉淀;C中品红溶液褪色;D中无色溶液变红色溶液。据此写出硫酸铜晶体分解化学方程式_______ 。
(1)以印刷线路板的碱性蚀刻废液主要成分为{[Cu(NH3)4]Cl2}为原料制备CuSO4·5H2O晶体。取一定量蚀刻废液和稍过量的NaOH溶液,加入如图所示实验装置的三颈烧瓶中,在搅拌下加热反应并通入空气;待产生大量的黑色沉淀时停止反应,趁热过滤、洗涤,得到CuO固体,所得固体经酸溶、结晶、过滤等操作,得到CuSO4·5H2O晶体。

①[Cu(NH3)4]Cl2中含有的化学键有
②装置X的作用是
③用蚀刻废液制备CuO反应的化学方程式为
④检验CuO固体是否洗净的实验方法是
(2)测定产品纯度:准确称取0.5000gCuSO4·5H2O样品,加适量水溶解,转移至碘量瓶中,加过量KI溶液并用稀硫酸酸化,以淀粉溶液为指示剂,用0.1000mol·L-1Na2S2O3标准溶液滴定至终点,消耗 Na2S2O3溶液19.80mL。测定过程中发生下列反应:2Cu2++4I-=2CuI↓+I2、2S2O
 +I2=S4O
+I2=S4O +2I-,滴定终点的实验现象为
+2I-,滴定终点的实验现象为(3)为探究硫酸铜晶体的热稳定性,某学生取少量硫酸铜晶体进行实验,装置如图所示。

实验现象:A中蓝色晶体逐渐变成白色粉末,最后变成黑色粉末;B中产生白色沉淀;C中品红溶液褪色;D中无色溶液变红色溶液。据此写出硫酸铜晶体分解化学方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】氯化亚砜(SOCl2)是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛.SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生。实验室合成原理:SO2+C12+SCl2=2SOCl2,部分装置如下图所示,回答以下问题:
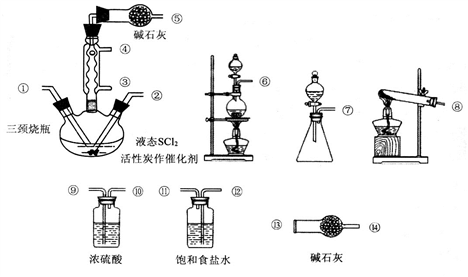
(1)实验室制取SOCl2在三颈烧瓶中合成,整个装置所选仪器的连接顺序是⑥→_______ →① ②←_______ (某些仪器可以多次使用)。
(2)冷凝管口③是_______ 口(填“进水”或“出水”),冷凝管上连接的干燥管的作用是_____________________________ 。
(3)实验室制C12的离子方程式为_______________ 。SOCl2与水反应的化学方程式为________________ 。
(4)已知SCl2的沸点为50℃。实验结束后,将三颈烧瓶中混合物分离开的实验操作名称是__________________ 。若反应中消耗的C12的体积为896m1。(已转化为标准状况,SO2足量),最后得到纯净的SOCl2 6.76g,则SOCl2的产率为__________ (保留二位有效数字)。
(5)取少量的SOCl2加入足量NaOH溶液,振荡、静置得到无色溶液,检验溶液中存在的C1-的方法是____________________ 。

(1)实验室制取SOCl2在三颈烧瓶中合成,整个装置所选仪器的连接顺序是⑥→
(2)冷凝管口③是
(3)实验室制C12的离子方程式为
(4)已知SCl2的沸点为50℃。实验结束后,将三颈烧瓶中混合物分离开的实验操作名称是
(5)取少量的SOCl2加入足量NaOH溶液,振荡、静置得到无色溶液,检验溶液中存在的C1-的方法是
您最近一年使用:0次



