某浓度的HF溶液中存在平衡:HF ⇌ H++F-,若要增大F-的浓度,同时减小H+的浓度,可以采取的方法是
| A.加入少量NaOH固体 | B.增大HF浓度 |
| C.加入少量的浓盐酸 | D.加水稀释 |
更新时间:2023-02-27 20:34:26
|
相似题推荐
单选题
|
适中
(0.65)
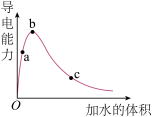
【推荐1】一定温度下,将一定质量的冰醋酸加水稀释,溶液的导电能力变化如图所示,下列说法中,正确的是


| A.a,b,c三点溶液的n(H+):c<a<b |
| B.a,b,c三点醋酸的电离程度:a<b<c |
| C.用湿润的pH试纸测量a处溶液的pH,测量结果偏大 |
| D.a,b,c三点溶液用1 mol•L-1的氢氧化钠溶液中和,消耗氢氧化钠溶液的体积:c<a<b |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】现有 氨水,加蒸馏水稀释到
氨水,加蒸馏水稀释到 后,下列变化中正确的是
后,下列变化中正确的是
① 的电离程度增大②
的电离程度增大②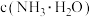 增大③
增大③ 增大④
增大④ 增大⑤溶液的导电性增强⑥
增大⑤溶液的导电性增强⑥ 减小⑦
减小⑦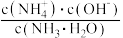 减小
减小
 氨水,加蒸馏水稀释到
氨水,加蒸馏水稀释到 后,下列变化中正确的是
后,下列变化中正确的是①
 的电离程度增大②
的电离程度增大②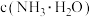 增大③
增大③ 增大④
增大④ 增大⑤溶液的导电性增强⑥
增大⑤溶液的导电性增强⑥ 减小⑦
减小⑦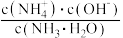 减小
减小| A.①②③⑤ | B.①③⑥ | C.①③ | D.②④⑦ |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】下列对0.1mol/L的醋酸溶液和0.1mol/L的醋酸钠溶液说法不正确 的是
| A.向两种溶液中加入少量固体醋酸钠,电离平衡和水解平衡都逆向移动 |
| B.将两种溶液加水稀释,不是所有离子浓度都下降 |
| C.将等体积的两种溶液混合,若c(Na+)<c(CH3COO-),则c(CH3COOH)<c(CH3COO-) |
| D.将两种溶液混合,醋酸的电离平衡和醋酸钠的水解平衡都被抑制 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】常温下,在 pH=4 的醋酸溶液中存在如下电离平衡:CH3COOH  CH3COO-+H+,对于该平衡,下列叙述正确的是
CH3COO-+H+,对于该平衡,下列叙述正确的是
 CH3COO-+H+,对于该平衡,下列叙述正确的是
CH3COO-+H+,对于该平衡,下列叙述正确的是| A.加入水时,平衡向右移动,溶液 pH 增大,导电能力增强 |
| B.加入少量 CH3COONa 固体,平衡向左移动,电离常数变小 |
| C.加入少量 NaOH 固体,平衡向右移动,c(H+)减少 |
| D.升高温度,平衡向右移动,CH3COOH 电离常数不变 |
您最近一年使用:0次

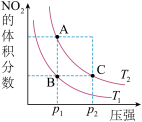
 溶液中通入少量HCl气体,溶液导电能力的变化曲线
溶液中通入少量HCl气体,溶液导电能力的变化曲线
 ,A点比B、C点颜色均深
,A点比B、C点颜色均深 的电离程度:c<a<b
的电离程度:c<a<b 一定减小的是
一定减小的是

