下表是实验室模拟合成氨反应: 的部分数据。请分析后回答下列问题。
的部分数据。请分析后回答下列问题。
(1)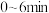 内该反应的化学反应速率
内该反应的化学反应速率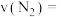
_______ 。
(2)在上表空格中填入合适数据_______ 、_______ 。
(3)如果用 浓度的增加值来表示化学反应速率,则
浓度的增加值来表示化学反应速率,则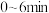 内
内 为
为_______ 。
(4)经测定反应开始后到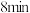 末
末 的反应速率
的反应速率 ,则
,则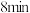 末
末 的浓度为
的浓度为_______ 。
 的部分数据。请分析后回答下列问题。
的部分数据。请分析后回答下列问题。| 浓度 |  |  |  |
反应开始时的浓度( ) ) | 2.5 | 2 | 0 |
 时的浓度( 时的浓度( ) ) | 1.9 |
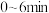 内该反应的化学反应速率
内该反应的化学反应速率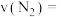
(2)在上表空格中填入合适数据
(3)如果用
 浓度的增加值来表示化学反应速率,则
浓度的增加值来表示化学反应速率,则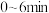 内
内 为
为(4)经测定反应开始后到
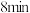 末
末 的反应速率
的反应速率 ,则
,则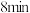 末
末 的浓度为
的浓度为
2023高一·全国·专题练习 查看更多[2]
更新时间:2023-03-13 17:16:13
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】回答下列问题
(1)在温度为T2时,通入气体分压比为p(C3H8)∶p(O2)∶p(N2)=10∶5∶85的混合气体,各组分气体的分压随时间的变化关系如图所示。0~1.2s生成C3H6的平均速率为___________ kPa/s,在反应一段时间后,C3H8和O2的消耗速率比小于2∶1的原因为___________
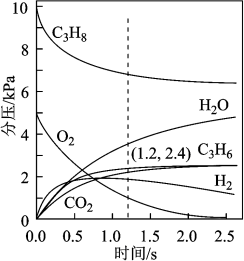
(2)恒温刚性密闭容器中通入气体分压比为p(C3H8)∶p(O2)∶p(N2)=2∶13∶85的混合气体,已知某反应条件下只发生如下反应(k、k′为速率常数):
反应Ⅱ:2C3H8(g)+O2(g)=2C3H6(g)+2H2O(g) k
反应Ⅲ:2C3H6(g)+9O2(g)=6CO2+6H2O(g) k′
实验测得丙烯的净生成速率方程为v(C3H6)= k p(C3H8)-k′p(C3H6),可推测丙烯的浓度随时间的变化趋势为___________ ,其理由是___________
(1)在温度为T2时,通入气体分压比为p(C3H8)∶p(O2)∶p(N2)=10∶5∶85的混合气体,各组分气体的分压随时间的变化关系如图所示。0~1.2s生成C3H6的平均速率为

(2)恒温刚性密闭容器中通入气体分压比为p(C3H8)∶p(O2)∶p(N2)=2∶13∶85的混合气体,已知某反应条件下只发生如下反应(k、k′为速率常数):
反应Ⅱ:2C3H8(g)+O2(g)=2C3H6(g)+2H2O(g) k
反应Ⅲ:2C3H6(g)+9O2(g)=6CO2+6H2O(g) k′
实验测得丙烯的净生成速率方程为v(C3H6)= k p(C3H8)-k′p(C3H6),可推测丙烯的浓度随时间的变化趋势为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】一定温度下,在固定容积为 5L 的密闭容器中发生可逆反应:C(s)+H2O(g)  CO(g)+H2(g)。
CO(g)+H2(g)。
(1)请写出该反应的化学平衡常数表达式 K=________________________ 。
(2)不能判断该反应一定达到化学平衡状态的依据是_____________ (填字母)
A.υ正(H2O)=υ逆(H2)
B.消耗 n mol H2的同时消耗 n mol CO
C.容器中混合气体的密度不随时间而变化
D.混合气体的压强不再变化
(3)若在固定容积为 5L 的密闭容器中加入的是 2 mol Fe(s)与 1 mol H2O(g),发生反应: 3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g),△H<0,t1秒时,H2的物质的量为 0.2 mol,到 t2秒时恰好达到平衡,此时 H2的物质的量为 0.35 mol。
Fe3O4(s)+4H2(g),△H<0,t1秒时,H2的物质的量为 0.2 mol,到 t2秒时恰好达到平衡,此时 H2的物质的量为 0.35 mol。
①t1~t2这段时间内的反应速率υ(H2O)=____ ;达到平衡时,H2的体积分数为____ 。
②若继续加入 2 mol Fe(s),则平衡___________ 移动(填“向正反应方向”、“向逆反应方向”或“不”),继续通入1molH2O再次达到平衡后,H2的物质的量为___________ 。
③该反应的逆反应速率随时间变化的关系如图:

t1时改变了某种条件,改变的条件可能是________________ 。
 CO(g)+H2(g)。
CO(g)+H2(g)。(1)请写出该反应的化学平衡常数表达式 K=
(2)不能判断该反应一定达到化学平衡状态的依据是
A.υ正(H2O)=υ逆(H2)
B.消耗 n mol H2的同时消耗 n mol CO
C.容器中混合气体的密度不随时间而变化
D.混合气体的压强不再变化
(3)若在固定容积为 5L 的密闭容器中加入的是 2 mol Fe(s)与 1 mol H2O(g),发生反应: 3Fe(s)+4H2O(g)
 Fe3O4(s)+4H2(g),△H<0,t1秒时,H2的物质的量为 0.2 mol,到 t2秒时恰好达到平衡,此时 H2的物质的量为 0.35 mol。
Fe3O4(s)+4H2(g),△H<0,t1秒时,H2的物质的量为 0.2 mol,到 t2秒时恰好达到平衡,此时 H2的物质的量为 0.35 mol。①t1~t2这段时间内的反应速率υ(H2O)=
②若继续加入 2 mol Fe(s),则平衡
③该反应的逆反应速率随时间变化的关系如图:

t1时改变了某种条件,改变的条件可能是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】一定温度下,向0.5 L的密闭容器中通入两种气体反应物,反应中各气体的物质的量变化如图所示。回答下列问题:

(1)写出容器中发生的化学反应方程式___________ (用图中字母表示)。
(2)0~1 s内,以B的浓度表示反应的平均速率ʋ(B) =___________ mol·L−1·s−1,1~5 s内,以B的浓度表示反应的平均速率为ʋ′(B),由图可知ʋ(B)___________ ʋ′(B)(填“>”“<”或“=”),其原因是___________ 。
(3)当可逆反应达到平衡时,C的转化率为___________ 。
(4)容器内初始压强用p(初)表示,平衡时压强用p(平)表示,则p(平):p(初) =___________ 。
(5)某条件下可逆反应达平衡后,降低温度,逆反应速率___________ (填“增大”“减小”或“不变”),下列情况能说明容器内可逆反应再次达到化学平衡的是___________ (填标号)。
A.ʋ(B)正 = ʋ(A)逆
B.气体B的质量分数不再改变
C.容器气体总质量不再改变
D.气体D的物质的量浓度不再改变

(1)写出容器中发生的化学反应方程式
(2)0~1 s内,以B的浓度表示反应的平均速率ʋ(B) =
(3)当可逆反应达到平衡时,C的转化率为
(4)容器内初始压强用p(初)表示,平衡时压强用p(平)表示,则p(平):p(初) =
(5)某条件下可逆反应达平衡后,降低温度,逆反应速率
A.ʋ(B)正 = ʋ(A)逆
B.气体B的质量分数不再改变
C.容器气体总质量不再改变
D.气体D的物质的量浓度不再改变
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】(1)对于反应3X(g)+Y(g)⇌Z(g),在其他条件不变时,改变其中一个条件,则生成Z的速率(填“增大”“减小”或“不变”):
①升高温度_______ ;②加入催化剂_______ ;
③保持容器的体积不变,减少气体Z的量:_______ ;
④保持容器的体积不变,增加气体Ar_______ ;
⑤保持压强不变,充入惰性气体_______ ;
(2)某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
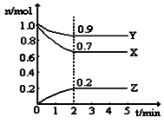
①该反应的化学方程式为_______ 。
②反应开始至2min,以气体Z表示的平均反应速率为_______ 。
③2min反应达平衡容器内混合气体的平均相对分子质量比起始时_______ (填“大”,“小”或“相等”,下同),混合气体密度比起始时_______ 。
(3)反应3A(g)+B(g)⇌2C(g)在三种不同的条件下进行反应,在同一时间内,测得的反应速率用不同的物质表示为①vA=1 mol/(L·min)、②vC=0.5 mol/(L·min)、③vB=0.5 mol/(L·min),三种情况下该反应速率由大到小的关系是_______ 。(用序号表示)
①升高温度
③保持容器的体积不变,减少气体Z的量:
④保持容器的体积不变,增加气体Ar
⑤保持压强不变,充入惰性气体
(2)某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:

①该反应的化学方程式为
②反应开始至2min,以气体Z表示的平均反应速率为
③2min反应达平衡容器内混合气体的平均相对分子质量比起始时
(3)反应3A(g)+B(g)⇌2C(g)在三种不同的条件下进行反应,在同一时间内,测得的反应速率用不同的物质表示为①vA=1 mol/(L·min)、②vC=0.5 mol/(L·min)、③vB=0.5 mol/(L·min),三种情况下该反应速率由大到小的关系是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】某温度时,在2 L密闭容器中充入NO与O2,反应过程中各物质的物质的量随时间的变化关系如图所示。
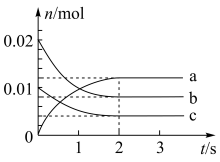
(1)NO与O2反应的化学方程式是___________ 。
(2)上图中表示NO的曲线是___________ (填序号),在 内用NO表示的平均反应速率是
内用NO表示的平均反应速率是___________ 。

(1)NO与O2反应的化学方程式是
(2)上图中表示NO的曲线是
 内用NO表示的平均反应速率是
内用NO表示的平均反应速率是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】Ⅰ.已知:反应aA(g)+bB(g)⇌cC(g),某温度下,在2L的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示:
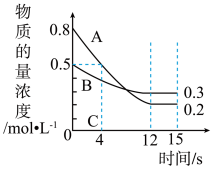
(1)经测定前4s内v(C)=0.05mol·L−1·s−1,则该反应的化学方程式为______________ 。
(2)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3mol·L−1·s−1;乙:v(B)=0.12mol·L−1·s−1;丙:v(C)=9.6mol·L−1·min−1,则甲、乙、丙三个容器中反应速率最快的是_______ 。
Ⅱ.某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折合成标准状况),实验记录如表(累计值):
(3)分析上表数据,反应速率最快的时间段是________ min之间,你认为此时影响反应速率的主要因素是______________ 。
(4)在盐酸中加入下列溶液,可以减缓反应速率又不影响产生的氢气的量的是_____ (填字母)。
A.NaNO3溶液 B.NaCl溶液 C.Na2CO3溶液 D.CH3COONa溶液

(1)经测定前4s内v(C)=0.05mol·L−1·s−1,则该反应的化学方程式为
(2)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3mol·L−1·s−1;乙:v(B)=0.12mol·L−1·s−1;丙:v(C)=9.6mol·L−1·min−1,则甲、乙、丙三个容器中反应速率最快的是
Ⅱ.某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折合成标准状况),实验记录如表(累计值):
| 时间/min | 1 | 2 | 3 | 4 | 5 | 6 |
| 氢气体积/mL | 50 | 120 | 224 | 392 | 472 | 502 |
(3)分析上表数据,反应速率最快的时间段是
(4)在盐酸中加入下列溶液,可以减缓反应速率又不影响产生的氢气的量的是
A.NaNO3溶液 B.NaCl溶液 C.Na2CO3溶液 D.CH3COONa溶液
您最近一年使用:0次



