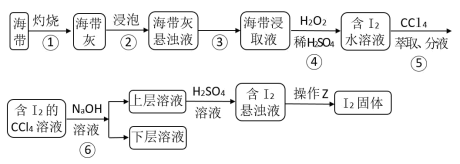
溴、碘主要存在于海水中,有“海洋元素”的美称。海水中的碘主要富集在海带中,我国海带产量居世界第一位,除供食用外,大量用于制碘。从海带中提取碘单质,工艺流程如图。
(1)步骤①操作时,除需要酒精灯、三脚架、泥三角外,还需用到的主要仪器是_____ (填名称)。
(2)海带中碘元素的存在形式为_____ (用化学符号表示)。
(3)步骤⑤的具体实验步骤为:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.检验分液漏斗旋塞和上口的瓶塞是否漏液;
C.把20mL碘水跟5mL四氯化碳加入分液漏斗中,并盖好玻璃塞;
D.倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收下层溶液;
F.将分液漏斗上口的玻璃塞打开或使塞上的凹槽对准分液漏斗口上的小孔;
G.从分液漏斗上口倒出上层溶液;
H.静止、分层。
①实验步骤的正确顺序为_____→_____→_____→A→H→_____→_____→_____。_____ 。
②静止、分层后,下层溶液的颜色为_____ 。
(4)步骤④中的H2O2可用以下_____ (填字母)试剂代替。
a.Cl2 b.Na2SO3 c.NaCl
(5)步骤⑤中,某学生选择用CCl4来萃取碘的理由_____ 。
(6)步骤⑥使用的是反萃取法,目的是富集碘元素,该步反应的离子方程式为_____ 。每消耗1molI2转移电子数为_____ 。
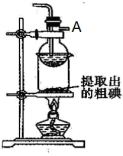
(7)某同学制得的粗碘中含有少量Na2SO4,对粗碘进行提纯的装置如图所示,采用的分离方法是_____ ;为得到较多较高纯度的单质碘,A容器中可盛放的试剂为_____ (填字母)。
a.冷水 b.热水 c.热氢氧化钠溶液
(1)步骤①操作时,除需要酒精灯、三脚架、泥三角外,还需用到的主要仪器是
(2)海带中碘元素的存在形式为
(3)步骤⑤的具体实验步骤为:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.检验分液漏斗旋塞和上口的瓶塞是否漏液;
C.把20mL碘水跟5mL四氯化碳加入分液漏斗中,并盖好玻璃塞;
D.倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收下层溶液;
F.将分液漏斗上口的玻璃塞打开或使塞上的凹槽对准分液漏斗口上的小孔;
G.从分液漏斗上口倒出上层溶液;
H.静止、分层。
①实验步骤的正确顺序为_____→_____→_____→A→H→_____→_____→_____。
②静止、分层后,下层溶液的颜色为
(4)步骤④中的H2O2可用以下
a.Cl2 b.Na2SO3 c.NaCl
(5)步骤⑤中,某学生选择用CCl4来萃取碘的理由
(6)步骤⑥使用的是反萃取法,目的是富集碘元素,该步反应的离子方程式为
(7)某同学制得的粗碘中含有少量Na2SO4,对粗碘进行提纯的装置如图所示,采用的分离方法是
a.冷水 b.热水 c.热氢氧化钠溶液
更新时间:2023-03-17 19:34:25
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】医学研究表明,砷的化合物会影响人体代谢和免疫功能造成砷中毒。某含砷(As)的酸性工业废水经处理转化为粗As2O3,流程如图;已知:亚砷酸钙微溶于水,砷酸钙难溶于水

(1)写出氧化步骤中发生的离子反应方程式:___________ 。
(2)酸化步骤产生的废渣为:___________ ,还原步骤中氧化剂与还原剂的比例为:___________ ;本实验中有两种物质可循环使用,分别是NaOH和___________ 。
(3)此流程中先沉砷再酸化的目的为:___________ 。
(4)沉砷步骤中,若将沉淀剂由石灰乳改为CaCl2固体,抽取AsO 浓度为0.01mol·L-1的废水1L,当AsO
浓度为0.01mol·L-1的废水1L,当AsO 刚好完全沉淀时,假设沉淀后废水体积不变,加入CaCl2的质量为
刚好完全沉淀时,假设沉淀后废水体积不变,加入CaCl2的质量为___________ g。(保留四位有效数字)已知:Ca3(AsO4)2的Ksp=1.0×10-19,溶液中当离子浓度小于1.0×10-5 mol·L-1时视为完全沉淀。

(1)写出氧化步骤中发生的离子反应方程式:
(2)酸化步骤产生的废渣为:
(3)此流程中先沉砷再酸化的目的为:
(4)沉砷步骤中,若将沉淀剂由石灰乳改为CaCl2固体,抽取AsO
 浓度为0.01mol·L-1的废水1L,当AsO
浓度为0.01mol·L-1的废水1L,当AsO 刚好完全沉淀时,假设沉淀后废水体积不变,加入CaCl2的质量为
刚好完全沉淀时,假设沉淀后废水体积不变,加入CaCl2的质量为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】I.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:2Mg5Al3(OH)19(H2O)4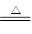 27H2O↑+10MgO+3A12O3
27H2O↑+10MgO+3A12O3
(1)写出该化合物作阻燃剂的两条依据____________________________________ 。
(2)用离子方程式表示除去固体产物中A12O3的原理________________________ 。
II.以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为A12O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
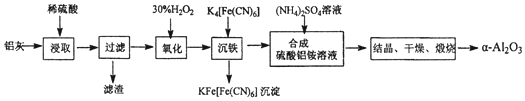
(1)用图中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为_______ (填选项编号)。
(2)验证“沉铁”后,溶液中是否还含有铁离子的操作方法为____________________ 。
(3)若用调节溶液的pH“沉铁”,则得到Fe(OH)3,已知:

为保证产品的纯度,最好选用下列物质中的_______ 调节pH(填字母),调节pH的范围为_____ 。
A.A12O3B.H2SO4C.NaOH D.Na2CO3
(4)煅烧硫酸铝铵晶体,发生的主要反应为:
4[NH4Al(SO4)2·12H2O]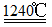 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,
将产生的气体通过下图所示的装置。
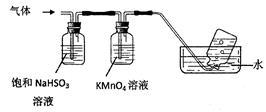
①集气瓶中收集到的气体是_____________________ (填化学式)。
②KMnO4溶液褪色,发生的离子反应方程式为_________________________________ 。
 27H2O↑+10MgO+3A12O3
27H2O↑+10MgO+3A12O3(1)写出该化合物作阻燃剂的两条依据
(2)用离子方程式表示除去固体产物中A12O3的原理
II.以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为A12O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:

(1)用图中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为

(2)验证“沉铁”后,溶液中是否还含有铁离子的操作方法为
(3)若用调节溶液的pH“沉铁”,则得到Fe(OH)3,已知:

为保证产品的纯度,最好选用下列物质中的
A.A12O3B.H2SO4C.NaOH D.Na2CO3
(4)煅烧硫酸铝铵晶体,发生的主要反应为:
4[NH4Al(SO4)2·12H2O]
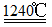 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置。

①集气瓶中收集到的气体是
②KMnO4溶液褪色,发生的离子反应方程式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐3】铋及其化合物在工业生产中用途广泛,某研究小组用浮选过的辉铋矿(主要成分是Bi2S3,还含少量SiO2等杂质)制备NaBiO3,其流程如下:

已知:水解能力:Bi3+>Fe3+。
回答下列问题:
(1)“浸取”时,为了提高浸取速率,可采取的措施有______________ (任写一条);过滤1的滤渣的主要成分有__________ (填化学式)。
(2)浸取时加入过量浓盐酸的目的是________________________________ ;“母液”中通入气体X后可循环利用,气体X为______________ (填名称)。
(3)写出焙烧时生成铋酸钠的化学方程式_______________________________ ,当消耗标准状况下4.48 L O2时,转移电子的数目是__________ 。
(4)25℃时,向浓度均为0.04 mol·L-1的Cu2+、Pb2+、Bi3+的混合溶液中滴加(NH4)2S溶液(设溶液体积增加1倍),当Pb2+恰好沉淀完全时,所得溶液中c(Cu2+)∶c(Bi3+)=______ 。[已知:Ksp(CuS)=6.0×10-36、Ksp(PbS)=3.0×10-28、Ksp(Bi2S3)=1.6×10-20]
(5)用双硫腙(H2Dz,二元弱酸)~CC14络合萃取法可从工业废水中提取金属离子:H2Dz先将金属离子络合成电中性的物质[如Cu(HDz)2等],再用CCl4萃取此络合物。下图是用上述方法处理含有Hg2+、Bi3+、Zn2+的废水时的酸度曲线(E%表示金属离子以络合物形式被萃取分离的百分率)。

①当调节pH=2.5时,铋(Bi)的存在形式有________________________ 。
②向萃取后的CCl4中加入NaOH溶液可将铋元素以氢氧化物的形式沉淀下来,相应的离子方程式为____________________________________ 。

已知:水解能力:Bi3+>Fe3+。
回答下列问题:
(1)“浸取”时,为了提高浸取速率,可采取的措施有
(2)浸取时加入过量浓盐酸的目的是
(3)写出焙烧时生成铋酸钠的化学方程式
(4)25℃时,向浓度均为0.04 mol·L-1的Cu2+、Pb2+、Bi3+的混合溶液中滴加(NH4)2S溶液(设溶液体积增加1倍),当Pb2+恰好沉淀完全时,所得溶液中c(Cu2+)∶c(Bi3+)=
(5)用双硫腙(H2Dz,二元弱酸)~CC14络合萃取法可从工业废水中提取金属离子:H2Dz先将金属离子络合成电中性的物质[如Cu(HDz)2等],再用CCl4萃取此络合物。下图是用上述方法处理含有Hg2+、Bi3+、Zn2+的废水时的酸度曲线(E%表示金属离子以络合物形式被萃取分离的百分率)。

①当调节pH=2.5时,铋(Bi)的存在形式有
②向萃取后的CCl4中加入NaOH溶液可将铋元素以氢氧化物的形式沉淀下来,相应的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐1】某同学设计以下实验方案,从海带中提取I2。

(1)操作①的名称是______ 。
(2)向滤液中加入双氧水的作用是______ 。
(3)试剂a可以是______ (填序号)。
①四氯化碳 ②苯 ③酒精 ④乙酸
(4)I–和IO3-在酸性条件下生成I2的离子方程式是________________ 。
(5)上图中,含I2的溶液经3步转化为I2的悬浊液,其目的是____________ 。

(1)操作①的名称是
(2)向滤液中加入双氧水的作用是
(3)试剂a可以是
①四氯化碳 ②苯 ③酒精 ④乙酸
(4)I–和IO3-在酸性条件下生成I2的离子方程式是
(5)上图中,含I2的溶液经3步转化为I2的悬浊液,其目的是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】请分析海水提镁、海带提碘的主要过程,按要求回答下列问题。
(1)海水提镁
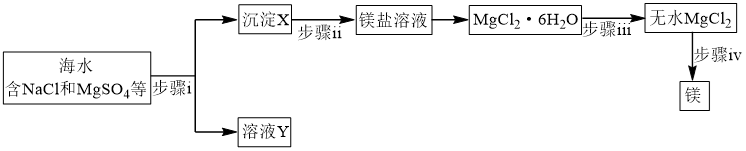
① 在周期表中位于
在周期表中位于_______ 区。
②步骤ⅰ所需试剂属于(填“强酸”、“强碱”或“可溶盐”)_______ 溶液。
③步骤ⅱ反应的离子方程式为_______ 。
④步骤ⅲ系列操作中需在 氛围中进行原因为
氛围中进行原因为_______ 。
⑤步骤ⅳ惰性电极电解熔融 时,在
时,在_______ 极每产生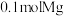 时,电路中转移电子数目为
时,电路中转移电子数目为_______ 。
(2)海带提碘(碘元素在海带中碘化物形式存在,碘为微溶于水的紫黑色固体)
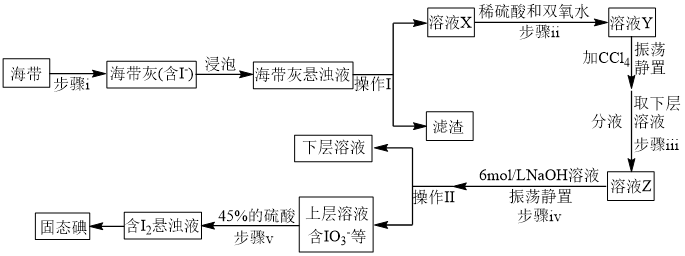
①步骤ⅰ不会用到下列仪器中的_______ (填字母)
a.酒精灯 b.漏斗 c.坩埚 d.泥三角
②操作Ⅰ、Ⅱ的名称依次为_______ 、_______ 。
③步骤ⅱ反应的离子方程式为_______ 。
④步骤ⅲ到步骤Ⅴ的目的是_______ 。
⑤步骤Ⅴ中 参与反应的离子方程式为
参与反应的离子方程式为_______ 。
(1)海水提镁

①
 在周期表中位于
在周期表中位于②步骤ⅰ所需试剂属于(填“强酸”、“强碱”或“可溶盐”)
③步骤ⅱ反应的离子方程式为
④步骤ⅲ系列操作中需在
 氛围中进行原因为
氛围中进行原因为⑤步骤ⅳ惰性电极电解熔融
 时,在
时,在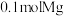 时,电路中转移电子数目为
时,电路中转移电子数目为(2)海带提碘(碘元素在海带中碘化物形式存在,碘为微溶于水的紫黑色固体)

①步骤ⅰ不会用到下列仪器中的
a.酒精灯 b.漏斗 c.坩埚 d.泥三角
②操作Ⅰ、Ⅱ的名称依次为
③步骤ⅱ反应的离子方程式为
④步骤ⅲ到步骤Ⅴ的目的是
⑤步骤Ⅴ中
 参与反应的离子方程式为
参与反应的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行以下实验:

请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是__________ (从下列仪器中选出所需仪器,用标号字母填写在空白处);
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是_____________ ;
(3)写出步骤④的离子反应方程式(已知MnO2生成Mn2+和H2O )__________________ ;
(4)步骤⑤中,某学生选择用苯来提取碘的理由是______________________________ , 还可选用_____________________ (写试剂的化学式)来提取碘,该步骤所用主要玻璃仪器的名称是__________________________ 。
(5)步骤⑥的目的是从含碘苯溶液中分离出单质碘,同时回收苯,该步骤的实验操作名称是__________________ 。

请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是
(3)写出步骤④的离子反应方程式(已知MnO2生成Mn2+和H2O )
(4)步骤⑤中,某学生选择用苯来提取碘的理由是
(5)步骤⑥的目的是从含碘苯溶液中分离出单质碘,同时回收苯,该步骤的实验操作名称是
您最近一年使用:0次



