用NH4Cl溶液浸出氧化锌矿石的过程中主要涉及反应2ZnO+4 +4Cl-=[Zn(NH3)4]2++ZnCl
+4Cl-=[Zn(NH3)4]2++ZnCl +2H2O。与
+2H2O。与 互为等电子体的阴离子为
互为等电子体的阴离子为___________ (写离子符号,写一种即可)。[Zn(NH3)4]2+的结构示意图为___________ 。
 +4Cl-=[Zn(NH3)4]2++ZnCl
+4Cl-=[Zn(NH3)4]2++ZnCl +2H2O。与
+2H2O。与 互为等电子体的阴离子为
互为等电子体的阴离子为
2023高三·全国·专题练习 查看更多[1]
(已下线)03 常考题空3 等电子体、成键方式、晶体类型的判断 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)
更新时间:2023-04-25 13:21:51
|
相似题推荐
填空题
|
较易
(0.85)
名校
【推荐1】甲醛是危害人类的无形杀手,是一种重要的工业原料。
(1)甲醛(H2C O)在Ni的催化作用下加氢可得甲醇(CH3OH)。甲醛与甲醇相比,
O)在Ni的催化作用下加氢可得甲醇(CH3OH)。甲醛与甲醇相比,__________ 的沸点高,主要原因是__________
(2)甲醛分子的空间构型为__________ ,其分子内的O—C — H键角__________ (填“大于”“等于”或“小于”)甲醇分子内的O—C — H键角。
(3)甲醛分子是__________ (填“极性分子”或“非极性分子”),它可由CO与H2在一定条件下反应合成。CO与N2的结构相似,一个CO分子内 键的个数为
键的个数为__________ ,基态氧原子的价电子排布式是__________
(1)甲醛(H2C
 O)在Ni的催化作用下加氢可得甲醇(CH3OH)。甲醛与甲醇相比,
O)在Ni的催化作用下加氢可得甲醇(CH3OH)。甲醛与甲醇相比,(2)甲醛分子的空间构型为
(3)甲醛分子是
 键的个数为
键的个数为
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐2】有如下几种含氮微粒,它们分别是表中各含碳微粒的等电子体,请将序号填入相应的空格内。
A. B.
B.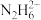 C.
C. D.
D. E.
E.
A.
 B.
B.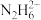 C.
C. D.
D. E.
E.
| 含碳微粒 |  |  |  | 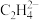 |  |
| 含氮微粒 |
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐3】叠氮化合物是一类重要的化合物,其中氢叠氮酸(HN3)是一种弱酸,其分子结构可表示为H—N=N≡N,肼(N2H4)被亚硝酸氧化时便可得到氢叠氮酸(HN3),发生的反应为N2H4+HNO2=2H2O+HN3。HN3的酸性和醋酸相近,可微弱电离出H+和N3-。试回答下列问题:
(1)下列有关说法正确的是___ (填序号)。
A.HN3中含有5个σ键
B.HN3中的三个氮原子均采用sp2杂化
C.HN3、HNO2、H2O、N2H4都是极性分子
D.HNO2是强酸
(2)叠氮酸根(N3-)能与许多金属离子等形成配合物,如:[Co(N3)(NH3)5]SO4,在该配合物中钴显___ 价,配位数是___ 。
(5)根据价层电子对互斥理论判断N3-的空间构型为___ 。与N3-互为等电子体的分子有___ (写一种即可)。
(1)下列有关说法正确的是
A.HN3中含有5个σ键
B.HN3中的三个氮原子均采用sp2杂化
C.HN3、HNO2、H2O、N2H4都是极性分子
D.HNO2是强酸
(2)叠氮酸根(N3-)能与许多金属离子等形成配合物,如:[Co(N3)(NH3)5]SO4,在该配合物中钴显
(5)根据价层电子对互斥理论判断N3-的空间构型为
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】镍的氨合离子 中存在的化学键有
中存在的化学键有_______ (填字母)。
A.离子键 B.共价键 C.配位键 D.氢键 E. 键 F.
键 F. 键
键
 中存在的化学键有
中存在的化学键有A.离子键 B.共价键 C.配位键 D.氢键 E.
 键 F.
键 F. 键
键
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】有机化学是化学科学中一门重要的分支,请回答下列问题:
(1)分子式为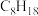 ,核磁共振氢谱只有一组峰的烷烃的结构简式为
,核磁共振氢谱只有一组峰的烷烃的结构简式为_______ 。
(2)某炔烃A与氢气加成后的产物是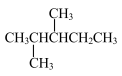 ,则A的系统命名为
,则A的系统命名为_______ 。
(3)下列是分子式为 的4种同分异构体,其中互为碳链异构的是
的4种同分异构体,其中互为碳链异构的是_______ (填序号);③的分子中杂化方式为 的原子有
的原子有_______ 个。
①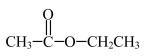 ②
②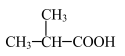
③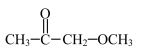 ④
④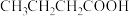
上述4种物质在下列某种表征仪器中显示的信号(或数据)完全相同,则该仪器是_______ (填选项)。
A.质谱仪 B.红外光谱仪 C.元素分析仪 D.核磁共振仪
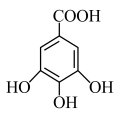
(4)没食子酸是多酚类有机化合物,在食品、医药、化工等领域有广泛应用。 该物质分别与足量
该物质分别与足量 、
、 反应,消耗
反应,消耗 和
和 的物质的量之比为
的物质的量之比为_______ ,没食子酸的同分异构体中,与其具有相同种类及数目官能团的芳香化合物还有_______ 种。
(5) 晶体中含有的化学键类型为
晶体中含有的化学键类型为_______ (填选项),其中 的空间构型为
的空间构型为_______ 。
A.离子键 B.共价键 C.配位键 D.金属键 E.氢键
(1)分子式为
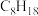 ,核磁共振氢谱只有一组峰的烷烃的结构简式为
,核磁共振氢谱只有一组峰的烷烃的结构简式为(2)某炔烃A与氢气加成后的产物是
 ,则A的系统命名为
,则A的系统命名为(3)下列是分子式为
 的4种同分异构体,其中互为碳链异构的是
的4种同分异构体,其中互为碳链异构的是 的原子有
的原子有①
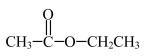 ②
②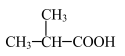
③
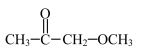 ④
④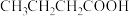
上述4种物质在下列某种表征仪器中显示的信号(或数据)完全相同,则该仪器是
A.质谱仪 B.红外光谱仪 C.元素分析仪 D.核磁共振仪
(4)没食子酸是多酚类有机化合物,在食品、医药、化工等领域有广泛应用。
 该物质分别与足量
该物质分别与足量 、
、 反应,消耗
反应,消耗 和
和 的物质的量之比为
的物质的量之比为
(5)
 晶体中含有的化学键类型为
晶体中含有的化学键类型为 的空间构型为
的空间构型为A.离子键 B.共价键 C.配位键 D.金属键 E.氢键
您最近一年使用:0次




