能源是现代文明的原动力,化学电池在生产生活中有着广泛的应用。
(1)根据构成原电池的本质判断,下列反应方程式正确且能设计成原电池的是___________(填序号)。
(2)反应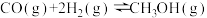 中相关的化学键键能数据如表:
中相关的化学键键能数据如表:
已知:键能指1mol气态分子完全离解成气态原子所吸收的能量;甲醇的结构式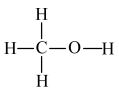 ;CO的结构式为C≡O。
;CO的结构式为C≡O。
若有1mol (g)生成,该反应需要
(g)生成,该反应需要___________ (填“吸收”或“放出”)___________ kJ能量。
(3)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为: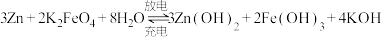 。
。
①放电时负极反应式为___________ ;
②放电时正极附近溶液的碱性___________ (填“增强”或“减弱”或“不变”)。
(4)以 为原理设计燃料电池,装置如图。
为原理设计燃料电池,装置如图。
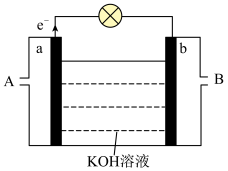
①A处加入的是___________ (写化学式);
②a电极上发生的电极反应式为___________ ;
③当消耗标准状况下3.36L 时,导线上转移的电子的物质的量是
时,导线上转移的电子的物质的量是___________ mol。
(1)根据构成原电池的本质判断,下列反应方程式正确且能设计成原电池的是___________(填序号)。
A.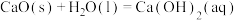 |
B.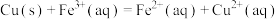 |
C. |
D.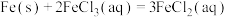 |
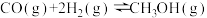 中相关的化学键键能数据如表:
中相关的化学键键能数据如表:| 化学键 | H—H | C—O | C≡O | H—O | C—H |
E( ) ) | 436 | 343 | 1076 | 465 | 413 |
 ;CO的结构式为C≡O。
;CO的结构式为C≡O。若有1mol
 (g)生成,该反应需要
(g)生成,该反应需要(3)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
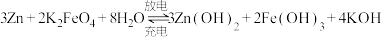 。
。①放电时负极反应式为
②放电时正极附近溶液的碱性
(4)以
 为原理设计燃料电池,装置如图。
为原理设计燃料电池,装置如图。
①A处加入的是
②a电极上发生的电极反应式为
③当消耗标准状况下3.36L
 时,导线上转移的电子的物质的量是
时,导线上转移的电子的物质的量是
更新时间:2023-06-17 06:12:14
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】回答下列问题:
(1)已知键能H-H 436kJ/mol,N-H391kJ/mol,N≡N946 kJ/mol。则N2(g)+3H2(g) 2NH3(g)生成1molNH3
2NH3(g)生成1molNH3___________ (填吸收或放出)___________ kJ热量。
(2)某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
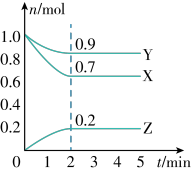
①该反应的化学方程式为___________ 。反应开始至2min,以气体Z表示的平均反应速率为___________ 。平衡时X的转化率为___________ 。
② 2min反应达到平衡,容器内混合气体的平均相对分子质量比起始时___________  填“大”、“小”或“相等”,下同
填“大”、“小”或“相等”,下同 ,混合气体密度比起始时
,混合气体密度比起始时___________ 。
(3)如图所示。

①甲中SO 移向
移向___________ (填“铝片”或“镁片”),转移电子0.5mol时,正极产生气体标况下的体积为___________ 。
②乙中负极为___________ (填“铝片”或“镁片”)写出其电极反应式式:___________ 。
(1)已知键能H-H 436kJ/mol,N-H391kJ/mol,N≡N946 kJ/mol。则N2(g)+3H2(g)
 2NH3(g)生成1molNH3
2NH3(g)生成1molNH3(2)某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:

①该反应的化学方程式为
② 2min反应达到平衡,容器内混合气体的平均相对分子质量比起始时
 填“大”、“小”或“相等”,下同
填“大”、“小”或“相等”,下同 ,混合气体密度比起始时
,混合气体密度比起始时(3)如图所示。

①甲中SO
 移向
移向②乙中负极为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】某温度下,在 2 L 恒容密闭容器中 3 种物质间进行反应,X、Y、Z 的物质的量随时间的变化曲线如图所示,反应在 t1 min 时达到平衡。

(1)请写出该反应的化学方程式:____________________________
(2)若上述反应中X、Y、Z 分别为NH3、H2、N2的一种,在此t1 min 时间内,用H2表示该反应的平均速率υ(H2)为____________________________
(3)拆开 1mol 共价键所需吸收的能量如下表:
1mol N2完全反应生成NH3__________ (填:吸收或放出多少)kJ 能量。但事实上,将 1molN2和3molH2放在反应容器中,使它们充分反应,反应的热量变化总小于计算值,原因是________________________________
(4)下列叙述能判断该反应达到平衡状态的是___________ (填字母代号)。
A.容器内各气体组分的质量分数不再发生改变
B.容器内气体的压强不再发生改变
C.容器内气体的密度不再发生改变
D.混合气体的平均相对分子质量不再发生改变

(1)请写出该反应的化学方程式:
(2)若上述反应中X、Y、Z 分别为NH3、H2、N2的一种,在此t1 min 时间内,用H2表示该反应的平均速率υ(H2)为
(3)拆开 1mol 共价键所需吸收的能量如下表:
| 共价键 | H-H | N≡N | N-H |
| 吸收的能量/kJ | 436 | 946 | 391 |
(4)下列叙述能判断该反应达到平衡状态的是
A.容器内各气体组分的质量分数不再发生改变
B.容器内气体的压强不再发生改变
C.容器内气体的密度不再发生改变
D.混合气体的平均相对分子质量不再发生改变
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】研究氮的氧化物的反应对于减少大气污染有重要意义。回答下列问题:
I.汽车尾气中的NO对人体健康有严重危害,一种新技术用H₂还原NO的反应原理为: △H<0.该反应的能量变化过程如图:
△H<0.该反应的能量变化过程如图:_______  (用图中字母a、b、c、d表示,a、b、c、d均为正值)。该反应在(填“高温”、“低温”或“任意温度”)
(用图中字母a、b、c、d表示,a、b、c、d均为正值)。该反应在(填“高温”、“低温”或“任意温度”)_______ 条件下有利于自发进行。
Ⅱ.汽油燃油车上安装三元催化转化器,可以使CO和NO两种尾气反应生成 ,可有效降低汽车尾气污染。已知反应:
,可有效降低汽车尾气污染。已知反应:
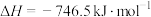 。在密闭容器中充入8molNO和10molCO发生反应,平衡时NO的体积分数与温度、压强的关系如图所示:
。在密闭容器中充入8molNO和10molCO发生反应,平衡时NO的体积分数与温度、压强的关系如图所示:_______ (填标号)。
a.升高温度 b.压缩容器体积 c.恒压充入氦气 d.加入催化剂
(3)反应在D点达到平衡后,若此时升高温度,并保持容器体积不变,在重新达到平衡过程中,D点会向A~G点中的_______ 点方向移动。
(4)E点的压强平衡常数
_______  (保留两位有效数字;用平衡分压代替平衡浓度计算,分压=总压×该组分物质的量分数)。
(保留两位有效数字;用平衡分压代替平衡浓度计算,分压=总压×该组分物质的量分数)。
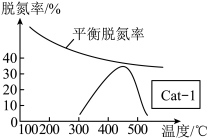
(5)某研究小组探究温度和催化剂对CO、NO转化率的影响。将CO和NO按物质的量之比1∶1以一定的流速通过催化剂(Cat-1)进行反应,一段时间内测量逸出气体中NO的含量,从而确定尾气脱氮率(即NO的转化率),结果如图所示:催化剂Cat-1条件下,450℃后,脱氮率随温度升高而下降的原因是_______ 。
(6)采用“联合脱硫脱氮技术”处理烟气( 、NO)可获得石膏(
、NO)可获得石膏(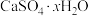 )、
)、 的副产品,为了测定烟气脱硫所得石膏(
的副产品,为了测定烟气脱硫所得石膏(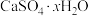 )中的x值,做如下实验:将石膏加热使之脱水,加热过程中固体的质量与时间的变化关系如图所示。数据表明当固体的质量为2.72g后不再改变。x=
)中的x值,做如下实验:将石膏加热使之脱水,加热过程中固体的质量与时间的变化关系如图所示。数据表明当固体的质量为2.72g后不再改变。x=_______ 。
I.汽车尾气中的NO对人体健康有严重危害,一种新技术用H₂还原NO的反应原理为:
 △H<0.该反应的能量变化过程如图:
△H<0.该反应的能量变化过程如图: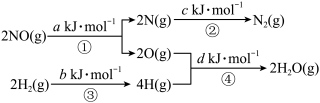
 (用图中字母a、b、c、d表示,a、b、c、d均为正值)。该反应在(填“高温”、“低温”或“任意温度”)
(用图中字母a、b、c、d表示,a、b、c、d均为正值)。该反应在(填“高温”、“低温”或“任意温度”)Ⅱ.汽油燃油车上安装三元催化转化器,可以使CO和NO两种尾气反应生成
 ,可有效降低汽车尾气污染。已知反应:
,可有效降低汽车尾气污染。已知反应:
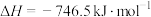 。在密闭容器中充入8molNO和10molCO发生反应,平衡时NO的体积分数与温度、压强的关系如图所示:
。在密闭容器中充入8molNO和10molCO发生反应,平衡时NO的体积分数与温度、压强的关系如图所示: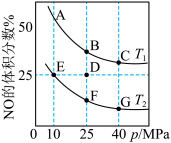
a.升高温度 b.压缩容器体积 c.恒压充入氦气 d.加入催化剂
(3)反应在D点达到平衡后,若此时升高温度,并保持容器体积不变,在重新达到平衡过程中,D点会向A~G点中的
(4)E点的压强平衡常数

 (保留两位有效数字;用平衡分压代替平衡浓度计算,分压=总压×该组分物质的量分数)。
(保留两位有效数字;用平衡分压代替平衡浓度计算,分压=总压×该组分物质的量分数)。(5)某研究小组探究温度和催化剂对CO、NO转化率的影响。将CO和NO按物质的量之比1∶1以一定的流速通过催化剂(Cat-1)进行反应,一段时间内测量逸出气体中NO的含量,从而确定尾气脱氮率(即NO的转化率),结果如图所示:催化剂Cat-1条件下,450℃后,脱氮率随温度升高而下降的原因是
(6)采用“联合脱硫脱氮技术”处理烟气(
 、NO)可获得石膏(
、NO)可获得石膏(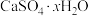 )、
)、 的副产品,为了测定烟气脱硫所得石膏(
的副产品,为了测定烟气脱硫所得石膏(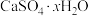 )中的x值,做如下实验:将石膏加热使之脱水,加热过程中固体的质量与时间的变化关系如图所示。数据表明当固体的质量为2.72g后不再改变。x=
)中的x值,做如下实验:将石膏加热使之脱水,加热过程中固体的质量与时间的变化关系如图所示。数据表明当固体的质量为2.72g后不再改变。x=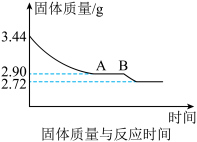
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】根据原电池原理,人们研制出了性能各异的化学电池。
(1)某原电池装置示意图如图1。
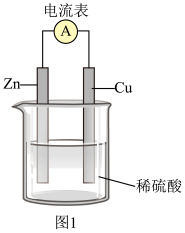
①Zn片作___________ (填“正极”或“负极”)。
②Cu片上发生反应的电极反应式为___________ 。
③电流表指针偏转,说明该装置实现了化学能向___________ 的转化。
④若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和铜片洗净干燥后称重,总质量为47 g。此时产生标准状况下氢气的体积为___________ L,该反应转移的电子的物质的量为___________ mol。
(2)某锂−空气电池的总反应为4Li + O2 + 2H2O = 4LiOH,其工作原理示意图如图2。
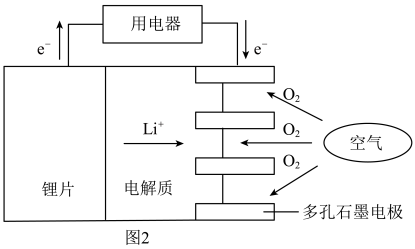
下列说法正确的是___________ (填字母)。
a.锂片作负极 b.O2发生还原反应
c.锂离子向电池负极移动 d.该装置实现了化学能转化为电能
(1)某原电池装置示意图如图1。

①Zn片作
②Cu片上发生反应的电极反应式为
③电流表指针偏转,说明该装置实现了化学能向
④若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和铜片洗净干燥后称重,总质量为47 g。此时产生标准状况下氢气的体积为
(2)某锂−空气电池的总反应为4Li + O2 + 2H2O = 4LiOH,其工作原理示意图如图2。

下列说法正确的是
a.锂片作负极 b.O2发生还原反应
c.锂离子向电池负极移动 d.该装置实现了化学能转化为电能
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】某课外活动小组进行电解饱和食盐水的实验(如图)。请回答下列问题。
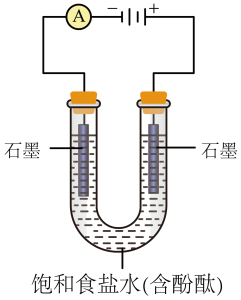
(1)通电一段时间后,可观察到_______ 电极(填“阴极”或“阳极”)附近溶液颜色先变红,该电极上的电极反应式为_______ 。
(2)该溶液电解反应的化学方程式为_______ 。
(3)若开始时改用铁棒做阳极,阳极的电极反应式为_______ 。
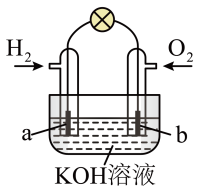
(4)若用H2和O2为反应物,以KOH为电解质溶液,可构成新型燃料电池(如下图),两个电极均由多孔性炭制成,通入的气体由孔隙中逸出,并在电极表面放电,其中a是___ 极(填“正”或“负”),b极的电极反应式为_______ 。
(5)下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是_______(填序号)
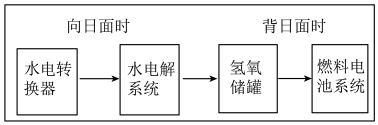

(1)通电一段时间后,可观察到
(2)该溶液电解反应的化学方程式为
(3)若开始时改用铁棒做阳极,阳极的电极反应式为
(4)若用H2和O2为反应物,以KOH为电解质溶液,可构成新型燃料电池(如下图),两个电极均由多孔性炭制成,通入的气体由孔隙中逸出,并在电极表面放电,其中a是

(5)下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是_______(填序号)

| A.该能量转化系统中的水也是可以循环的 |
| B.燃料电池系统产生的能量实际上来自于水 |
| C.燃料电池放电时的正极反应:H2-2e-+2OH-=2H2O |
| D.水电解系统中的阳极反应:4OH--4e-=2H2O+O2↑ |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】能源的开发和利用是当前科学研究的重要课题。
(1)原电池是将_____ 能转化为_____ 能的装置。
(2)下列不能用于设计成原电池的化学反应是_____ ,理由是_____ 。
A.2HCl+CaO=CaCl2+H2O
B.2CH3OH+3O2=2CO2+4H2O
C.4Fe(OH)2+2H2O+O2=4Fe(OH)3
D.2H2+O2=2H2O
(3)甲烷是天然气的主要成分。
①写出CH4燃烧的化学方程式_____ 。
②25℃,100kPa时生成或断裂1mol化学键所放出或吸收的能量称为键能。已知键能数据如下:
计算1mol甲烷完全燃烧放出的热量为_____ kJ。
(4)为提高能量转化效率,常将甲烷设计成燃料电池,装置示意图如图(其中A、B为石墨电极)。
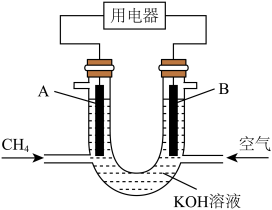
①B是该电池的_____ (填“正”或“负”)极。CH4在该装置中的作用是_____ ,KOH溶液的作用是_____ 。
②已知甲烷与氧气完全氧化时每生成1mol液态水释放能量约为400kJ,又知该甲烷燃料电池每发1kW·h电能生成216g水,则该电池的能量转化率为_____ (1kW·h=3.6×106J)。
(1)原电池是将
(2)下列不能用于设计成原电池的化学反应是
A.2HCl+CaO=CaCl2+H2O
B.2CH3OH+3O2=2CO2+4H2O
C.4Fe(OH)2+2H2O+O2=4Fe(OH)3
D.2H2+O2=2H2O
(3)甲烷是天然气的主要成分。
①写出CH4燃烧的化学方程式
②25℃,100kPa时生成或断裂1mol化学键所放出或吸收的能量称为键能。已知键能数据如下:
| 化学键 | C-H | O=O | C=O | O-H |
| 键能/kJ·mol-1 | 414 | 497 | 803 | 463 |
(4)为提高能量转化效率,常将甲烷设计成燃料电池,装置示意图如图(其中A、B为石墨电极)。

①B是该电池的
②已知甲烷与氧气完全氧化时每生成1mol液态水释放能量约为400kJ,又知该甲烷燃料电池每发1kW·h电能生成216g水,则该电池的能量转化率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】碳、氮及其化合物广泛存在于自然界中。
(1)化学家Gethard Ertl证实了氢气与氮气在固体催化剂表面合成氨的过程,示意如图:
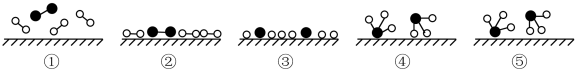
下列说法正确的是_______ (选填字母)。
A.②→③需要吸收能量
B.该过程能提高合成氨的平衡转化率
C.该过程表示了化学变化中包含旧化学键的断裂和新化学键的生成
(2)氨分解反应的热化学方程式为: 2NH3(g) N2(g) + 3H2(g) ∆H。若N≡N键、H-H键和N-H键的键能分别记作a、b和c(单位:kJ/mol),则上述反应的∆H=
N2(g) + 3H2(g) ∆H。若N≡N键、H-H键和N-H键的键能分别记作a、b和c(单位:kJ/mol),则上述反应的∆H=_______ kJ/mol
(3)某种燃料电池的工作原理示意如图所示,a、b均为惰性电极。
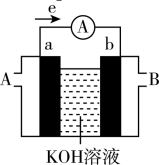
①假设使用的“燃料”是氢气(H2),若电池中氢气(H2)通入量为224mL(标准状况),且反应完全,则理论上通过电流表的电量为_______ C。(已知一个电子所带电量为1.6×10−19C,NA约为6.02×1023mol−1)。
②假设使用的“燃料”是甲醇(CH3OH),则a极的电极反应式为_______ ,如果消耗甲醇160g,假设化学能完全转化为电能,则转移电子的数目为_______ (用NA表示)。
(1)化学家Gethard Ertl证实了氢气与氮气在固体催化剂表面合成氨的过程,示意如图:

下列说法正确的是
A.②→③需要吸收能量
B.该过程能提高合成氨的平衡转化率
C.该过程表示了化学变化中包含旧化学键的断裂和新化学键的生成
(2)氨分解反应的热化学方程式为: 2NH3(g)
 N2(g) + 3H2(g) ∆H。若N≡N键、H-H键和N-H键的键能分别记作a、b和c(单位:kJ/mol),则上述反应的∆H=
N2(g) + 3H2(g) ∆H。若N≡N键、H-H键和N-H键的键能分别记作a、b和c(单位:kJ/mol),则上述反应的∆H=(3)某种燃料电池的工作原理示意如图所示,a、b均为惰性电极。

①假设使用的“燃料”是氢气(H2),若电池中氢气(H2)通入量为224mL(标准状况),且反应完全,则理论上通过电流表的电量为
②假设使用的“燃料”是甲醇(CH3OH),则a极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】近年来,我国许多地区气候异常现象频发,如:云南持续几个月的干旱、北方频发的沙尘暴等,使环境问题再次成为公众的焦点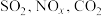 是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径。
是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径。
(1)下列做法中,有利于降低大气中的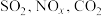 浓度的有
浓度的有__________ (选填字母)。
a. 直接用煤做燃料
b. 开私家车
c. 植树造林以增加绿化面积
d. 研究、开发太阳能使之走进寻常百姓家
(2 )用CO和H2做原料可以合成甲醇,作为液体燃料。已知: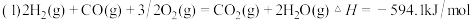
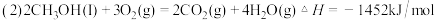
请写出用合成气(CO和H2)合成1mol液态甲醇的热化学反应方程式:__________
(3) 利用电化学原理将CO、SO2化为重要化工原料,装置如图所示:
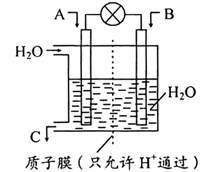
①若A为CO,B为H2,C为CH3OH,则通入CO的一极为_____ 极
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为__________
(4) ①已知:密闭容器中,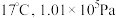 条件下,2NO2(g)
条件下,2NO2(g)  N2O4(g),其平衡常数K=13.3。
N2O4(g),其平衡常数K=13.3。
当此反应达到平衡时,若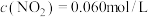 ,则
,则 =
=_______________ (保留两位有效数字)。
②若改变上述体系的某个条件,达到新的平衡后,测得混合气体中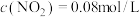 ,
,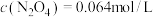 ,则改变的条件是
,则改变的条件是____________________
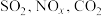 是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径。
是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径。(1)下列做法中,有利于降低大气中的
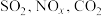 浓度的有
浓度的有a. 直接用煤做燃料
b. 开私家车
c. 植树造林以增加绿化面积
d. 研究、开发太阳能使之走进寻常百姓家
(2 )用CO和H2做原料可以合成甲醇,作为液体燃料。已知:
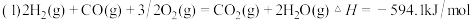
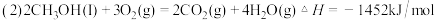
请写出用合成气(CO和H2)合成1mol液态甲醇的热化学反应方程式:
(3) 利用电化学原理将CO、SO2化为重要化工原料,装置如图所示:

①若A为CO,B为H2,C为CH3OH,则通入CO的一极为
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为
(4) ①已知:密闭容器中,
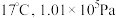 条件下,2NO2(g)
条件下,2NO2(g)  N2O4(g),其平衡常数K=13.3。
N2O4(g),其平衡常数K=13.3。当此反应达到平衡时,若
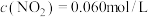 ,则
,则 =
=②若改变上述体系的某个条件,达到新的平衡后,测得混合气体中
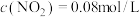 ,
,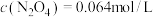 ,则改变的条件是
,则改变的条件是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】I、如图,已知某反应在体积为5L的密闭容器中进行,各物质的量随时间的变化情况如图所示(已知A、B、C均为气体)。
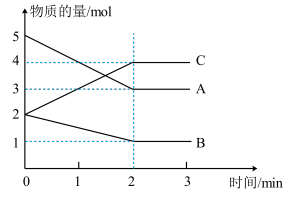
(1)该反应的化学方程式为_______ 。
(2)反应开始至两分钟时,B的平均反应速率为_______ 。
(3)平衡时C的含量(体积分数)为_______ 。该反应达到平衡状态的标志有_______ (填字母)。
a.A和C的物质的量相等 b.B的物质的量保持不变
c.2ν正(A)= ν逆(B) d.容器内压强不变
II、将锌片、铜片通过导线相连,置于硫酸铜溶液中。如图所示:

(4)该装置工作时,外电路中的电子流入_______ 极(填“Cu”或“Zn”);正极的电极反应式为_______ 。当析出128g Cu时,电路中应该有_______ mol电子发生了转移。

(1)该反应的化学方程式为
(2)反应开始至两分钟时,B的平均反应速率为
(3)平衡时C的含量(体积分数)为
a.A和C的物质的量相等 b.B的物质的量保持不变
c.2ν正(A)= ν逆(B) d.容器内压强不变
II、将锌片、铜片通过导线相连,置于硫酸铜溶液中。如图所示:

(4)该装置工作时,外电路中的电子流入
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】氮是化肥工业和化工生产的主要原料,工业上合成氨使用的氢气主要来自合成气(CO、H2混合气体)。请回答下列问题:
(1)工业上合成氨的反应原理为N2(g)+3H2(g) 2NH3(g) ΔH 。 已知:
2NH3(g) ΔH 。 已知:
化学键的键能是形成或断裂1 mol 化学键放出或吸收的能量,单位为kJ/mol。上述反应的ΔH________________ 。
(2)联氨(又称肼,N2H4),试写出联氨的电子式_________ ;联氨又可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH1
N2H4(l)+O2(g)= N2(g)+2H2O(g) ΔH2
则N2(g)+2O2(g)=N2O4 (l) ΔH3=_________
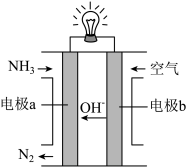
(3)以氨气代替氢气来研发氨燃料电池是当前科研的一个热点。氨燃料电池使用的电解质溶液是KOH溶液,其装置如图所示。a电极反应式为________ 。若该燃料电池消耗标准状况下6.72 L空气(假设空气中O2体积分数为20%),则理论上消耗NH3的质量为_______ g。
(4)甲醇燃料电池在生活应用也很广泛,在温度为650℃的熔融盐燃料电池中用甲醇、空气与CO2的混合气体作反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质。写出该电池的负极反应式______________ 。
(1)工业上合成氨的反应原理为N2(g)+3H2(g)
 2NH3(g) ΔH 。 已知:
2NH3(g) ΔH 。 已知: | 化学键 | H-H | N≡N | N-H |
| 键能/kJ·mol-1 | 436 | 945.6 | 391 |
化学键的键能是形成或断裂1 mol 化学键放出或吸收的能量,单位为kJ/mol。上述反应的ΔH
(2)联氨(又称肼,N2H4),试写出联氨的电子式
已知:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH1
N2H4(l)+O2(g)= N2(g)+2H2O(g) ΔH2
则N2(g)+2O2(g)=N2O4 (l) ΔH3=
(3)以氨气代替氢气来研发氨燃料电池是当前科研的一个热点。氨燃料电池使用的电解质溶液是KOH溶液,其装置如图所示。a电极反应式为

(4)甲醇燃料电池在生活应用也很广泛,在温度为650℃的熔融盐燃料电池中用甲醇、空气与CO2的混合气体作反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质。写出该电池的负极反应式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】为了探究原电池的工作原理,某研究性学习小组进行了如下实验。
(1)分别按图1中甲、乙所示装置进行实验,甲中两个烧杯中的溶液为同浓度的稀硫酸。
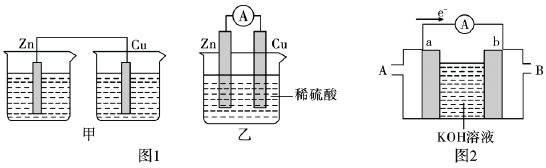
①以下叙述中正确的是_______ (填字母)。
A.甲中锌片是负极,乙中铜片是正极
B.两装置中铜片表面均有气泡产生
C.乙的外电路中电流方向Cu→Zn
D.如果将装置乙中锌片换成铁片,则电路中的电流方向不变
②在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是_______ 。
③在乙实验中,如果把硫酸换成硫酸铜溶液,可观察到正极_______ (填实验现象),其对应的电极反应式为_______ 。
(2)某氢氧燃料电池装置如图2所示,a、b均为惰性电极。
①电池工作时,空气从_______ (填“A”或“B”)口通入。
②正极上的电极反应式为_______ ,当电路中转移0.4mol电子时,理论上负极通入的气体在标准状况下的体积为_______ L。
(1)分别按图1中甲、乙所示装置进行实验,甲中两个烧杯中的溶液为同浓度的稀硫酸。

①以下叙述中正确的是
A.甲中锌片是负极,乙中铜片是正极
B.两装置中铜片表面均有气泡产生
C.乙的外电路中电流方向Cu→Zn
D.如果将装置乙中锌片换成铁片,则电路中的电流方向不变
②在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是
③在乙实验中,如果把硫酸换成硫酸铜溶液,可观察到正极
(2)某氢氧燃料电池装置如图2所示,a、b均为惰性电极。
①电池工作时,空气从
②正极上的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】回答下列问题:
(1)已知2H→H2放出437.6kJ的热量,下列说法正确的是_______。
(2)分别按图甲乙所示装置进行实验,两个烧杯里的溶液为同浓度的稀硫酸,甲中A为电流表。
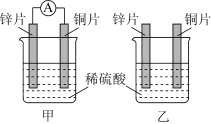
①下列叙述正确的是_______ 。
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片作正极,乙中铜片作负极
C.两烧杯溶液中 浓度均减小
浓度均减小
D.甲产生气泡的速率比乙慢
②在甲装置中,若把稀硫酸换成CuSO4溶液,一段时间后测得某一电极增重12.8g,则该电池反应共转移电子数目_______ 。
③甲装置中,正极的电极反应式_______ 。
(1)已知2H→H2放出437.6kJ的热量,下列说法正确的是_______。
| A.氢气分子内每个氢原子都达到稳定结构 |
| B.一个氢气分子的能量比两个氢原子的能量低 |
| C.1molH2离解成2molH要放出437.6kJ热量 |
| D.氢原子比氢气分子稳定 |
(2)分别按图甲乙所示装置进行实验,两个烧杯里的溶液为同浓度的稀硫酸,甲中A为电流表。

①下列叙述正确的是
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片作正极,乙中铜片作负极
C.两烧杯溶液中
 浓度均减小
浓度均减小D.甲产生气泡的速率比乙慢
②在甲装置中,若把稀硫酸换成CuSO4溶液,一段时间后测得某一电极增重12.8g,则该电池反应共转移电子数目
③甲装置中,正极的电极反应式
您最近一年使用:0次



