环己烯(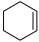 )是重要的化工原料,实验室环己醇(
)是重要的化工原料,实验室环己醇(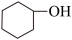 )可在
)可在 催化下制备环己烯。
催化下制备环己烯。
如图所示,将环己醇加入试管A中,再加入
 固体,缓慢加热,在试管C内收集到环己烯粗品。
固体,缓慢加热,在试管C内收集到环己烯粗品。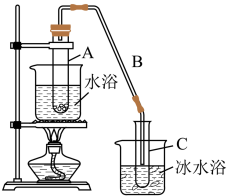
密度( | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
 ,而不选浓硫酸的可能原因是
,而不选浓硫酸的可能原因是(2)实验时水浴温度应高于
(3)环己烯粗品中含少量环己醇和HCl等物质。加入饱和食盐水除去HCl,经振荡、静置、分层后,产品在
Ⅱ.环己烯含量测定
向a g环己烯样品中加入b mol
 ,充分反应后,剩余的
,充分反应后,剩余的 与足量KI溶液反应,用c
与足量KI溶液反应,用c 标准溶液滴定,终点时消耗 V mL。(已知:
标准溶液滴定,终点时消耗 V mL。(已知: )
)(4)样品中环己烯的质量分数为
 标准溶液部分被氧化,会导致测定结果
标准溶液部分被氧化,会导致测定结果
22-23高二下·山东济宁·期中 查看更多[3]
山东省济宁市第一中学2022-2023学年高二下学期期中考试化学试题天津市第三十二中学2021-2022学年高二下学期期末质量检测化学试题(已下线)题型05 有机实验分析-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(天津专用)
更新时间:2023-05-18 06:49:41
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】青蒿素是高效的抗疟药,为无色针状晶体,易溶于有机溶剂,难溶于水,熔点为156~157℃,温度超过60℃完全失去药效(已知:乙醚沸点为35℃)。从青蒿中提取青蒿素的一种工艺如图:

索氏提取装置如图所示。实验时烧瓶中溶剂受热蒸发,蒸汽沿蒸汽导管2上升至装置a,冷凝后滴入滤纸套筒1中,与青蒿粉末接触,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现对青蒿粉末的连续萃取。回答下列问题:
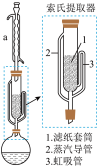
(1)装置a的名称为______ 。
(2)索氏提取装置提取的青蒿素位于_____ (填“圆底烧瓶”或“索氏提取器”)中;与常规的萃取相比,索氏提取的优点是______ 。
(3)提取液蒸馏过程中选用下列哪种装置更好_____ (填“甲”或“乙”),原因是_____ 。

(4)粗品提纯的过程可能是______ (填标号)。
a.加水溶解、蒸发浓缩、冷却结晶
b.加95%的乙醇溶解、水浴加热、冷却结晶、过滤
c.加入乙醚进行萃取分液
(5)青蒿素( )中含有过氧键,与碘化钠反应生成碘单质。为测定产品中青蒿素的纯度,取青蒿素样品8.0g配制成250mL溶液,取25.00mL加入锥形瓶中,再加入足量的KI溶液和几滴淀粉溶液,用0.1mol•L-1Na2S2O3标准液滴定[已知:I2+2S2O
)中含有过氧键,与碘化钠反应生成碘单质。为测定产品中青蒿素的纯度,取青蒿素样品8.0g配制成250mL溶液,取25.00mL加入锥形瓶中,再加入足量的KI溶液和几滴淀粉溶液,用0.1mol•L-1Na2S2O3标准液滴定[已知:I2+2S2O =2I-+S4O
=2I-+S4O ,M(青蒿素)=282g/mol]。
,M(青蒿素)=282g/mol]。
①滴定终点的颜色变化为_____ 。
②三次滴定数据记录如表:
则青蒿素的纯度为______ 。

索氏提取装置如图所示。实验时烧瓶中溶剂受热蒸发,蒸汽沿蒸汽导管2上升至装置a,冷凝后滴入滤纸套筒1中,与青蒿粉末接触,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现对青蒿粉末的连续萃取。回答下列问题:

(1)装置a的名称为
(2)索氏提取装置提取的青蒿素位于
(3)提取液蒸馏过程中选用下列哪种装置更好

(4)粗品提纯的过程可能是
a.加水溶解、蒸发浓缩、冷却结晶
b.加95%的乙醇溶解、水浴加热、冷却结晶、过滤
c.加入乙醚进行萃取分液
(5)青蒿素(
 )中含有过氧键,与碘化钠反应生成碘单质。为测定产品中青蒿素的纯度,取青蒿素样品8.0g配制成250mL溶液,取25.00mL加入锥形瓶中,再加入足量的KI溶液和几滴淀粉溶液,用0.1mol•L-1Na2S2O3标准液滴定[已知:I2+2S2O
)中含有过氧键,与碘化钠反应生成碘单质。为测定产品中青蒿素的纯度,取青蒿素样品8.0g配制成250mL溶液,取25.00mL加入锥形瓶中,再加入足量的KI溶液和几滴淀粉溶液,用0.1mol•L-1Na2S2O3标准液滴定[已知:I2+2S2O =2I-+S4O
=2I-+S4O ,M(青蒿素)=282g/mol]。
,M(青蒿素)=282g/mol]。①滴定终点的颜色变化为
②三次滴定数据记录如表:
| 滴定次数 | 待测液体(mL) | 标准液读数(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 1.50 | 41.52 |
| 第二次 | 25.00 | 3.00 | 42.98 |
| 第三次 | 25.00 | 4.50 | 41.60 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某学习小组研究NaOH与某些酸之间的反应。
Ⅰ.中和热的测定
在25℃、101kPa条件下,强酸与强碱的稀溶液中和热可表示为:H+(aq)+ OH─(aq)= H2O(l) △H =-57.3kJ·mol−1。按照图所示装置进行实验。
(1)仪器A的名称是______ 。
(2)碎泡沫塑料的作用是___________ 。
(3)在25℃、101kPa条件下,取50mL 0.50 mol·L−1 CH3COOH溶液、50mL 0.55 mol·L−1 NaOH溶液进行实验,测得的中和热△H____ -57.3kJ·mol−1(填“>”“=”或“<”)。
Ⅱ.中和滴定
(1)用酸式滴定管量取20.00 mL待测稀盐酸溶液放入锥形瓶中,并滴加1~2滴酚酞作指示剂,用0.20 mol·L—1NaOH标准溶液进行滴定。为了减小实验误差,该同学一共进行了三次实验,假设每次所取稀盐酸体积均为20.00 mL,三次实验结果记录如下:
该盐酸的浓度约为_________ (保留两位有效数字)。滴定达到终点的标志是__________ 。
(2)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______ 。
A. 滴定终点读数时俯视读数
B. 酸式滴定管使用前,水洗后未用待测盐酸润洗
C. 锥形瓶水洗后未干燥
D. 配制NaOH标准溶液时,没有等溶解液降至室温就转移至容量瓶中
E. 配制NaOH标准溶液时,定容时仰视容量瓶的刻度线
F. 碱式滴定管尖嘴部分有气泡,滴定后消失
Ⅰ.中和热的测定
在25℃、101kPa条件下,强酸与强碱的稀溶液中和热可表示为:H+(aq)+ OH─(aq)= H2O(l) △H =-57.3kJ·mol−1。按照图所示装置进行实验。

(1)仪器A的名称是
(2)碎泡沫塑料的作用是
(3)在25℃、101kPa条件下,取50mL 0.50 mol·L−1 CH3COOH溶液、50mL 0.55 mol·L−1 NaOH溶液进行实验,测得的中和热△H
Ⅱ.中和滴定
(1)用酸式滴定管量取20.00 mL待测稀盐酸溶液放入锥形瓶中,并滴加1~2滴酚酞作指示剂,用0.20 mol·L—1NaOH标准溶液进行滴定。为了减小实验误差,该同学一共进行了三次实验,假设每次所取稀盐酸体积均为20.00 mL,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 19.00 | 23.00 | 23.02 |
(2)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有
A. 滴定终点读数时俯视读数
B. 酸式滴定管使用前,水洗后未用待测盐酸润洗
C. 锥形瓶水洗后未干燥
D. 配制NaOH标准溶液时,没有等溶解液降至室温就转移至容量瓶中
E. 配制NaOH标准溶液时,定容时仰视容量瓶的刻度线
F. 碱式滴定管尖嘴部分有气泡,滴定后消失
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】工业上硫化碱法制备Na2S2O2的原理是2Na2S + Na2CO3+4SO2=3Na2S2O3+CO2(该反应的△H<0),某研究小组在实验室用此法制备Na2S2O2的装置与步骤如下,请回答有关问题:
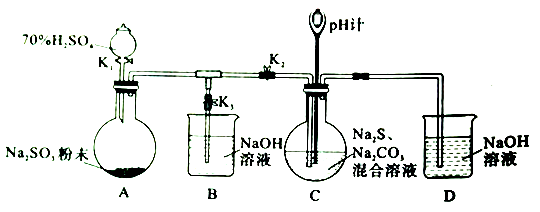
I、制备Na2S2O2实验步骤如下:
步骤1:先组装仪器,然后________。
步骤2:添加药品。关闭K1、K2、K3按图中所示依固体、溶液顺序将所需药品加入各仪器。
步骤3:打开K2,关闭K3,调节K1,使硫酸缓慢匀速滴下,导管口有气泡冒出,pH 计读数逐渐减小。当pH计读数接近7时,打开K3,关闭K1、K2。
步骤4:将C 中所得溶液加热浓缩,冷却析出Na2S2O2,经过滤、洗涤、干燥,得到产品。
(1)步骤1中缺少的操作是___________ 。
(2)装置A 中发生反应的化学方程式为___________ 。
(3) 为了使SO2 尽可能被吸收完全,在不改变装置C中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可以采取的措施有________ (任写一条)。
(4)装置C中Na2S和Na2CO3的物质的量浓度之比约为2:1,若Na2S过量则C中会出现淡黄色的浑浊,用离子方程式解释其原因为____________ 。
(5)实验制得的Na2S2O3 产品中可能含有Na2SO3、Na2SO4等杂质。请设计实验,检测Na2S2O3产品中是否存在Na2SO4 杂质,简要说明实验操作、现象和结论_____________ 。
II.测定产品纯度
准确称取Wg 产品,用适量蒸馏水溶解,以淀粉作指示剂,用浓度为0.1000 mol/L 碘的标准溶液滴定。反应原理为2S2O32- +I2=S4O62-+2I-
(6)滴定至终点时的现象为____________ 。
(7)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为______ mL,计算所得样品的纯度为_________ (用含W的代数式表示)。


I、制备Na2S2O2实验步骤如下:
步骤1:先组装仪器,然后________。
步骤2:添加药品。关闭K1、K2、K3按图中所示依固体、溶液顺序将所需药品加入各仪器。
步骤3:打开K2,关闭K3,调节K1,使硫酸缓慢匀速滴下,导管口有气泡冒出,pH 计读数逐渐减小。当pH计读数接近7时,打开K3,关闭K1、K2。
步骤4:将C 中所得溶液加热浓缩,冷却析出Na2S2O2,经过滤、洗涤、干燥,得到产品。
(1)步骤1中缺少的操作是
(2)装置A 中发生反应的化学方程式为
(3) 为了使SO2 尽可能被吸收完全,在不改变装置C中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可以采取的措施有
(4)装置C中Na2S和Na2CO3的物质的量浓度之比约为2:1,若Na2S过量则C中会出现淡黄色的浑浊,用离子方程式解释其原因为
(5)实验制得的Na2S2O3 产品中可能含有Na2SO3、Na2SO4等杂质。请设计实验,检测Na2S2O3产品中是否存在Na2SO4 杂质,简要说明实验操作、现象和结论
II.测定产品纯度
准确称取Wg 产品,用适量蒸馏水溶解,以淀粉作指示剂,用浓度为0.1000 mol/L 碘的标准溶液滴定。反应原理为2S2O32- +I2=S4O62-+2I-
(6)滴定至终点时的现象为
(7)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为

您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
解题方法
【推荐1】有机物B 是相对分子质量为 28 的气态烃,能使溴水褪色。有关物质的转化关系如图:
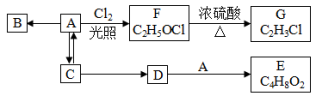
(1)B 分子的空间构型是_______ 。
(2)A→F 的反应类型为_______ ;A→C 的化学方程式为_______ 。
(3)下列说法正确的是_______ 。
a.可用紫色石蕊试液鉴别A 和 D
b.有机物A 和D 都能与Na2CO3 反应
c.等物质的量的A 和B 完全燃烧时消耗等量氧气
(4)物质G 在一定条件下生成的高分子化合物的结构简式是_______ 。
(5)物质E与NaOH 溶液发生反应的化学方程式为_______ 。

(1)B 分子的空间构型是
(2)A→F 的反应类型为
(3)下列说法正确的是
a.可用紫色石蕊试液鉴别A 和 D
b.有机物A 和D 都能与Na2CO3 反应
c.等物质的量的A 和B 完全燃烧时消耗等量氧气
(4)物质G 在一定条件下生成的高分子化合物的结构简式是
(5)物质E与NaOH 溶液发生反应的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】实验室常用的几种气体发生装置如图1所示:
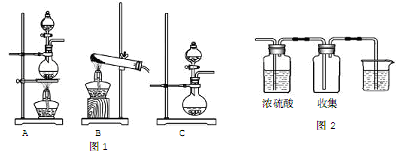
(1)若实验室选用A装置,由乙醇和浓硫酸共热制取乙烯,应该在此装置上作何改进即可完成该实验?__________ 。
(2)实验室可选用B装置,由氯化铵和碱石灰共热制取NH3。若实验室仅有浓氨水与生石灰,可选用__________ 装置来制取氨气,下列叙述与后者制取NH3的原理不相关的是_____________ 。
A.浓氨水易挥发
B.Ca(OH)2随温度上升溶解度降低
C.生石灰与水反应放热
D.气态物质的溶解性随温度的升高而降低
(3)请用两种方法制取氧气,可供选用的药品有:KClO3、H2O2、NaOH、MnO2。若选择B装置,可选用的试剂为______________ ;若选择C装置,可选用的试剂为_____________ 。
(4)若把“图1”中的“A装置”与“图2”相连,可用来制取下列气体中的____________ (填序号)。
①H2②Cl2③CO2④NH3写出实验室制取该气体的化学方程式:___________ ,烧杯中应盛放___________ 溶液,为了获得较纯净的产物,应在A与“图2”间增加____________ 装置。

(1)若实验室选用A装置,由乙醇和浓硫酸共热制取乙烯,应该在此装置上作何改进即可完成该实验?
(2)实验室可选用B装置,由氯化铵和碱石灰共热制取NH3。若实验室仅有浓氨水与生石灰,可选用
A.浓氨水易挥发
B.Ca(OH)2随温度上升溶解度降低
C.生石灰与水反应放热
D.气态物质的溶解性随温度的升高而降低
(3)请用两种方法制取氧气,可供选用的药品有:KClO3、H2O2、NaOH、MnO2。若选择B装置,可选用的试剂为
(4)若把“图1”中的“A装置”与“图2”相连,可用来制取下列气体中的
①H2②Cl2③CO2④NH3写出实验室制取该气体的化学方程式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
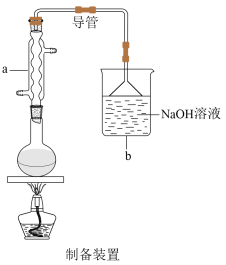
【推荐3】在医药工业中,2—氯乙醇(ClCH2CH2OH)可用于生产磷酸哌嗪、呋喃唑酮、四咪唑、驱蛔灵和普鲁卡因等。制备2—氯乙醇的装置如图所示。已知: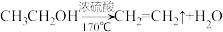 ,在制备乙烯过程中会产生
,在制备乙烯过程中会产生 和
和 气体。
气体。
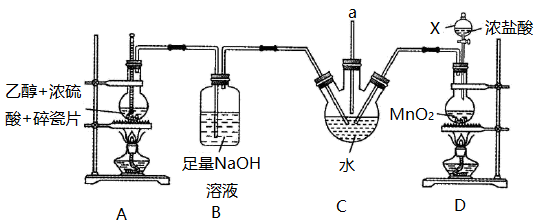
请回答下列问题:
(1)仪器X的名称是___________ ,装置A中碎瓷片的作用是___________ 。
(2)装置B中NaOH溶液的作用是___________ 。
(3)装置C中发生反应的化学方程式为___________ 。
(4)装置D中发生反应的离子方程式为___________ 。
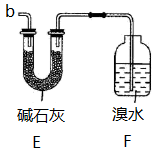
(5)下列装置中的导管b与装置C中的导管a相连用来处理尾气,则装置E用来处理尾气___________ (填化学式),装置F中的现象是___________ 。
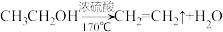 ,在制备乙烯过程中会产生
,在制备乙烯过程中会产生 和
和 气体。
气体。
请回答下列问题:
(1)仪器X的名称是
(2)装置B中NaOH溶液的作用是
(3)装置C中发生反应的化学方程式为
(4)装置D中发生反应的离子方程式为
(5)下列装置中的导管b与装置C中的导管a相连用来处理尾气,则装置E用来处理尾气

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】已知下列数据:
学生在实验室制取乙酸乙酯的主要步骤如下:
①在30mL的大试管A中按体积比1∶4∶4的比例配制浓硫酸、乙醇和乙酸的混合溶液;
②按下图连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10min;

③待试管B收集到一定量的产物后停止加热,撤去试管B并用力振荡,然后静置待分层;
④分离出乙酸乙酯层、洗涤、干燥。
请根据题目要求回答下列问题:
(1)配制该混合溶液的加液顺序为_______ 。写出制取乙酸乙酯的化学方程式:_______ 。
(2)上述实验中饱和碳酸钠溶液的作用是(填字母)_______。
(3)长的玻璃导管的作用是_______ 。
(4)步骤②中需要小火均匀加热操作,其主要理由是_______ 。
(5)分离出乙酸乙酯后,为了干燥乙酸乙酯可选用的干燥剂为(填字母)_______。
| 物质 | 熔点(℃) | 沸点(℃) | 密度(g·cm-3) |
| 乙醇 | -117.0 | 78.0 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | — | 338.0 | 1.84 |
①在30mL的大试管A中按体积比1∶4∶4的比例配制浓硫酸、乙醇和乙酸的混合溶液;
②按下图连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10min;

③待试管B收集到一定量的产物后停止加热,撤去试管B并用力振荡,然后静置待分层;
④分离出乙酸乙酯层、洗涤、干燥。
请根据题目要求回答下列问题:
(1)配制该混合溶液的加液顺序为
(2)上述实验中饱和碳酸钠溶液的作用是(填字母)_______。
| A.中和乙酸和乙醇 |
| B.中和乙酸并吸收部分乙醇 |
| C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出 |
| D.加速酯的生成,提高其产率 |
(4)步骤②中需要小火均匀加热操作,其主要理由是
(5)分离出乙酸乙酯后,为了干燥乙酸乙酯可选用的干燥剂为(填字母)_______。
| A.P2O5 | B.无水Na2SO4 | C.碱石灰 | D.NaOH固体 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】1-溴丁烷可用于合成麻醉药盐酸丁卡因,也用于生产染料和香料,是稀有元素萃取的溶剂及有机合成的中间体,其制备如图(夹持装置略): (浓)
(浓)
ⅱ.
ⅲ. (浓)
(浓)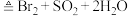
请回答下列问题:
(1)在反应时,若选用较浓的硫酸作为反应物,得到的产品会呈黄色,为除去颜色,最好选择下列的_______ (填标号)溶液来洗涤产品。
A.四氯化碳 B.硫酸钠 C.氢氧化钠 D.亚硫酸钠
产品选择上述溶液洗涤后,还需要用蒸馏水洗涤一次,洗涤液与产品分离的操作是_______ (填操作名称)。
(2)分离得到的有机层依次用适量的水、饱和 溶液、水洗涤、用无水
溶液、水洗涤、用无水 干燥,蒸馏,得到最终产品。若投入正丁醇
干燥,蒸馏,得到最终产品。若投入正丁醇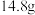 ,得到产物
,得到产物 ,则1-溴丁烷的产率为
,则1-溴丁烷的产率为______ %(保留一位小数)。
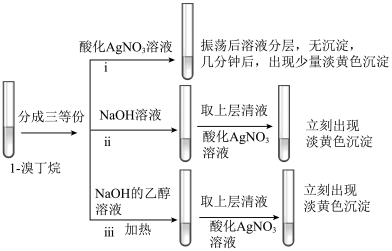
(3)探究小组为研究1-溴丁烷的水解反应和消去反应,设计如下探究实验:_______ 。
②实验ⅲ的有机化学反应方程式是_______ 。
③为深入研究1-溴丁烷与 溶液是否能发生消去反应,小组设计如图装置探究(加热和夹持装置略去):
溶液是否能发生消去反应,小组设计如图装置探究(加热和夹持装置略去):
Ⅰ.甲同学认为不能依据酸性高锰酸钾溶液褪色,判断A中发生消去反应,理由是_______ 。
Ⅱ.乙同学对实验进行了改进,依据实验现象可判断是否发生消去反应,改进的方案是_______ 。
 (浓)
(浓)
ⅱ.

ⅲ.
 (浓)
(浓)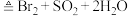
请回答下列问题:
(1)在反应时,若选用较浓的硫酸作为反应物,得到的产品会呈黄色,为除去颜色,最好选择下列的
A.四氯化碳 B.硫酸钠 C.氢氧化钠 D.亚硫酸钠
产品选择上述溶液洗涤后,还需要用蒸馏水洗涤一次,洗涤液与产品分离的操作是
(2)分离得到的有机层依次用适量的水、饱和
 溶液、水洗涤、用无水
溶液、水洗涤、用无水 干燥,蒸馏,得到最终产品。若投入正丁醇
干燥,蒸馏,得到最终产品。若投入正丁醇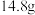 ,得到产物
,得到产物 ,则1-溴丁烷的产率为
,则1-溴丁烷的产率为(3)探究小组为研究1-溴丁烷的水解反应和消去反应,设计如下探究实验:
②实验ⅲ的有机化学反应方程式是
③为深入研究1-溴丁烷与
 溶液是否能发生消去反应,小组设计如图装置探究(加热和夹持装置略去):
溶液是否能发生消去反应,小组设计如图装置探究(加热和夹持装置略去):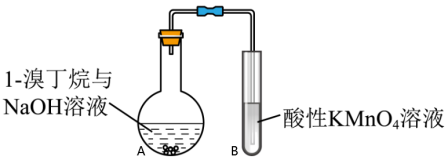
Ⅰ.甲同学认为不能依据酸性高锰酸钾溶液褪色,判断A中发生消去反应,理由是
Ⅱ.乙同学对实验进行了改进,依据实验现象可判断是否发生消去反应,改进的方案是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】硼酸三甲酯用作柠檬类水果的熏蒸剂。实验室合成硼酸三甲酯的原理及装置如下:
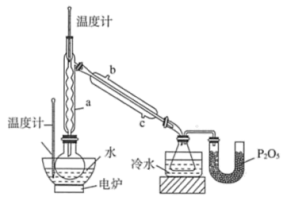
Na2B4O7·10H2O+2H2SO4+16CH3OH 2NaHSO4+4[(CH3O)3B+CH3OH]+17H2O
2NaHSO4+4[(CH3O)3B+CH3OH]+17H2O
实验步骤如下:
①在圆底烧瓶中加入44.8g甲醇和19.1gNa2B4O7·10H2O(硼砂,式量为382),然后缓慢加入浓H2SO4并振荡;加热烧瓶中的液体,通过分馏柱回流一段时间。
②先接收51~55℃的馏分,再接收55~60℃的馏分。
③将两次馏分合并,加入氯化钙进行盐析分层,上层为硼酸三甲酯,分离。
④精馏得高纯硼酸三甲酯19.2g。
回答下列问题:
(1)图中仪器a的名称为____________ ;直形冷凝管冷却水应从____________ (填“b”或“c”)接口进入。
(2)本实验加热方式为____________ ,优点是____________ 。
(3)加入氯化钙盐析分层的主要目的是____________ 。
(4)U型管中P2O5的作用是_____________________________________ 。
(5)步骤④的仪器选择及安装都正确的是____________ (填标号),应收集____________ ℃的馏分。
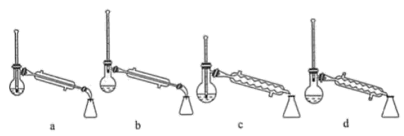
(6)本次实验的产率是____________ 。

| 硼酸三甲酯 | 甲醇 | |
| 溶解性 | 与乙醚、甲醇混溶,能水解 | 与水混溶 |
| 沸点/℃ | 68 | 64 |
| 硼酸三甲酯与甲醇混合物的共沸点为54℃ | ||
 2NaHSO4+4[(CH3O)3B+CH3OH]+17H2O
2NaHSO4+4[(CH3O)3B+CH3OH]+17H2O实验步骤如下:
①在圆底烧瓶中加入44.8g甲醇和19.1gNa2B4O7·10H2O(硼砂,式量为382),然后缓慢加入浓H2SO4并振荡;加热烧瓶中的液体,通过分馏柱回流一段时间。
②先接收51~55℃的馏分,再接收55~60℃的馏分。
③将两次馏分合并,加入氯化钙进行盐析分层,上层为硼酸三甲酯,分离。
④精馏得高纯硼酸三甲酯19.2g。
回答下列问题:
(1)图中仪器a的名称为
(2)本实验加热方式为
(3)加入氯化钙盐析分层的主要目的是
(4)U型管中P2O5的作用是
(5)步骤④的仪器选择及安装都正确的是

(6)本次实验的产率是
您最近一年使用:0次

 )
)

