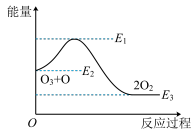假定反应体系的始态为s,终态为l,它们之间变化如图所示:s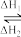 l,则下列说法不正确的是
l,则下列说法不正确的是
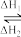 l,则下列说法不正确的是
l,则下列说法不正确的是| A.若ΔH1<0,则ΔH2>0 | B.若ΔH1<0,则ΔH2<0 |
| C.ΔH1和ΔH2的绝对值相等 | D.ΔH1+ΔH2=0 |
23-24高二上·全国·课时练习 查看更多[1]
更新时间:2023-08-27 10:46:22
|
相似题推荐
单选题
|
容易
(0.94)
名校
【推荐1】钛被称为“第三金属”,其制取原料为金红石( ),制取步骤如下:
),制取步骤如下:
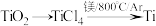
已知:①

②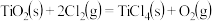

则反应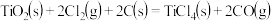 的ΔH为
的ΔH为
 ),制取步骤如下:
),制取步骤如下: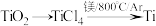
已知:①


②
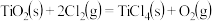

则反应
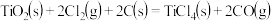 的ΔH为
的ΔH为| A.2ΔH1+2ΔH2 | B.2ΔH1+ΔH2 |
| C.2ΔH1-ΔH2 | D.2ΔH1-2ΔH2 |
您最近一年使用:0次
单选题
|
容易
(0.94)
解题方法
【推荐2】研究表明,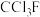 可在强烈紫外光作用下分解
可在强烈紫外光作用下分解 ,自由基
,自由基 会对臭氧层产生长久的破坏作用,反应历程可表示为
会对臭氧层产生长久的破坏作用,反应历程可表示为
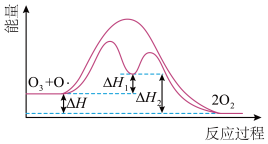
①
②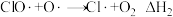
下列说法错误的是
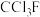 可在强烈紫外光作用下分解
可在强烈紫外光作用下分解 ,自由基
,自由基 会对臭氧层产生长久的破坏作用,反应历程可表示为
会对臭氧层产生长久的破坏作用,反应历程可表示为
①

②
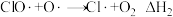
下列说法错误的是
A.臭氧层破坏的总反应为: | B. 在臭氧层破坏中起催化作用 在臭氧层破坏中起催化作用 |
| C.反应历程①为吸热反应 | D.催化剂降低了反应的活化能和 |
您最近一年使用:0次