已知肼(N2H4)是一种用于火箭或燃料电池的原料,已知①2H2O(l)+O2(g)=2H2O2(l) △H1=+108.3kJ/mol②N2H4(l)+O2(g)=N2(g)+2H2O(l) △H2=-534.0kJ/mol。则有反应:N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)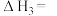 ,则ΔH3为
,则ΔH3为
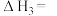 ,则ΔH3为
,则ΔH3为| A.+425.7kJ·mol-1 | B.-425.7kJ·mol-1 | C.+642.3kJ·mol-1 | D.-642.3kJ·mol-1 |
22-23高一下·陕西宝鸡·期末 查看更多[2]
更新时间:2023-08-04 14:39:35
|
【知识点】 盖斯定律与热化学方程式解读
相似题推荐
单选题
|
容易
(0.94)
名校
【推荐1】燃料气(CO、H2)是有机化工中的常见原料,工业上制取方法之一为高温下甲醇分解,反应原理为CH3OH(g) CO(g)+2H2(g) ∆H,能量变化情况如图。下列叙述正确的是
CO(g)+2H2(g) ∆H,能量变化情况如图。下列叙述正确的是
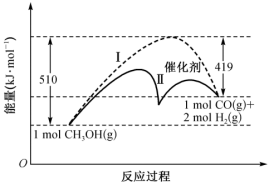
 CO(g)+2H2(g) ∆H,能量变化情况如图。下列叙述正确的是
CO(g)+2H2(g) ∆H,能量变化情况如图。下列叙述正确的是
| A.∆H为-91 kJ·mol-1 | B.I:正反应的活化能为419 kJ·mol-1 |
| C.II:催化剂增加了活化分子数 | D.其他条件相同时I比II先达到平衡 |
您最近一年使用:0次
单选题
|
容易
(0.94)
名校
解题方法
【推荐2】在25℃、101kPa条件下,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ·mol-1、285.8kJ·mol-1、870.3kJ·mol-1,则2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为( )
| A.-488.3kJ·mol-1 | B.+488.3kJ·mol-1 |
| C.-191kJ·mol-1 | D.+191kJ·mol-1 |
您最近一年使用:0次
单选题
|
容易
(0.94)
名校
解题方法
【推荐3】已知下列热化学方程式:
H2O(g)=H2O(l) △H=Q1kJ•mol-1;
C2H5OH(g)=C2H5OH(l) △H=Q2kJ•mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H=Q3kJ•mol-1
则C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)的△H=
H2O(g)=H2O(l) △H=Q1kJ•mol-1;
C2H5OH(g)=C2H5OH(l) △H=Q2kJ•mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H=Q3kJ•mol-1
则C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)的△H=
| A.(3Q1+Q2+Q3)kJ•mol-1 | B.-(3Q1+Q2+Q3)kJ•mol-1 |
| C.-(3Q1+Q2-Q3)kJ•mol-1 | D.(3Q1-Q2+Q3)kJ•mol-1 |
您最近一年使用:0次



