六氟化硫分子空间结构呈正八面体形,其中心原子的价层电子对数为4。(_____)
2023高三·全国·专题练习 查看更多[1]
(已下线)第4讲 空间构型
更新时间:2023-09-30 06:23:36
|
相似题推荐
判断题
|
适中
(0.65)
【推荐1】PhB(OH)2和 中B原子的价层电子对数相等(−Ph 代表苯基,−Pr 代表异丙基)。(_____)
中B原子的价层电子对数相等(−Ph 代表苯基,−Pr 代表异丙基)。(_____)
 中B原子的价层电子对数相等(−Ph 代表苯基,−Pr 代表异丙基)。(_____)
中B原子的价层电子对数相等(−Ph 代表苯基,−Pr 代表异丙基)。(_____)
您最近一年使用:0次
判断题
|
适中
(0.65)
解题方法
【推荐2】判断正误
(1)杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对____________
(2)分子中中心原子若通过sp3杂化轨道成键,则该分子一定为正四面体结构____________
(3)NH3分子为三角锥形,N原子发生sp2杂化___________
(4)只要分子构型为平面三角形,中心原子均为sp2杂化___________
(5)中心原子是sp杂化的,其分子构型不一定为直线形___________
(6)价层电子对互斥理论中,π键电子对数不计入中心原子的价层电子对数___________
(7)PCl3分子是三角锥形,这是因为P原子是以sp2杂化的结果___________
(8)sp3杂化轨道是由任意的1个s轨道和3个p轨道混合形成的四个sp3杂化轨道___________
(9)凡中心原子采取sp3杂化的分子,其VSEPR模型都是(正)四面体___________
(10)AB3型的分子空间构型必为平面三角形___________
(11)分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构___________
(12)杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对___________
(13)NH3和CH4两个分子中中心原子N和C都是通过sp3杂化轨道成键___________
(14)杂化轨道理论与VSEPR模型分析分子的空间构型结果常常相互矛盾___________
(15)配位键也是一种静电作用___________
(16)形成配位键的电子对由成键双方原子提供___________
(1)杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对
(2)分子中中心原子若通过sp3杂化轨道成键,则该分子一定为正四面体结构
(3)NH3分子为三角锥形,N原子发生sp2杂化
(4)只要分子构型为平面三角形,中心原子均为sp2杂化
(5)中心原子是sp杂化的,其分子构型不一定为直线形
(6)价层电子对互斥理论中,π键电子对数不计入中心原子的价层电子对数
(7)PCl3分子是三角锥形,这是因为P原子是以sp2杂化的结果
(8)sp3杂化轨道是由任意的1个s轨道和3个p轨道混合形成的四个sp3杂化轨道
(9)凡中心原子采取sp3杂化的分子,其VSEPR模型都是(正)四面体
(10)AB3型的分子空间构型必为平面三角形
(11)分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构
(12)杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对
(13)NH3和CH4两个分子中中心原子N和C都是通过sp3杂化轨道成键
(14)杂化轨道理论与VSEPR模型分析分子的空间构型结果常常相互矛盾
(15)配位键也是一种静电作用
(16)形成配位键的电子对由成键双方原子提供
您最近一年使用:0次
判断题
|
适中
(0.65)
解题方法
【推荐2】由价层电子对互斥模型可知SnBr2分子中Sn—Br的键角小于180°。( )
您最近一年使用:0次

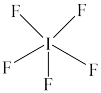 为四角锥结构,中心原子I没有孤电子对。(_____)
为四角锥结构,中心原子I没有孤电子对。(_____)


