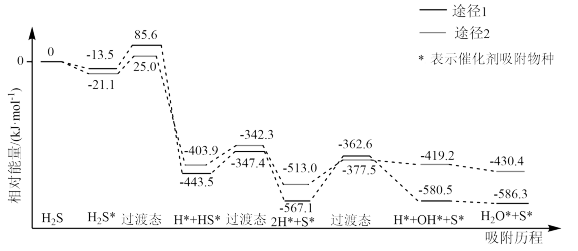
下列各组热化学方程式中,化学反应的ΔH前者大于后者的是
①C(s)+ O2(g)=CO(g) ΔH1;C(s)+O2(g)=CO2(g) ΔH2
O2(g)=CO(g) ΔH1;C(s)+O2(g)=CO2(g) ΔH2
②S(s)+O2(g)=SO2(g) ΔH3;S(g)+O2(g)=SO2(g) ΔH4
③H2(g)+ O2(g)=H2O(l) ΔH5;2H2(g)+O2(g)=2H2O(l) ΔH6
O2(g)=H2O(l) ΔH5;2H2(g)+O2(g)=2H2O(l) ΔH6
④CaCO3(s)=CaO(s)+CO2(g) ΔH7;CaO(s)+H2O(l)=Ca(OH)2(s) ΔH8
①C(s)+
 O2(g)=CO(g) ΔH1;C(s)+O2(g)=CO2(g) ΔH2
O2(g)=CO(g) ΔH1;C(s)+O2(g)=CO2(g) ΔH2②S(s)+O2(g)=SO2(g) ΔH3;S(g)+O2(g)=SO2(g) ΔH4
③H2(g)+
 O2(g)=H2O(l) ΔH5;2H2(g)+O2(g)=2H2O(l) ΔH6
O2(g)=H2O(l) ΔH5;2H2(g)+O2(g)=2H2O(l) ΔH6④CaCO3(s)=CaO(s)+CO2(g) ΔH7;CaO(s)+H2O(l)=Ca(OH)2(s) ΔH8
| A.①②③ | B.①③④ | C.②③④ | D.①②③④ |
更新时间:2023-10-12 22:27:35
|
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】已知化学反应的热效应只与反应物的初始状态和生成物的最终状态有关,例如图(Ⅰ)所示:△H1=△H2+△H3,根据上述原理和图(Ⅱ)所示,判断各对应的反应热关系中不正确的是( )
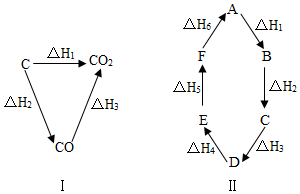

| A.A→F △H=﹣△H6 |
| B.A→D △H=△H1+△H2+△H3 |
| C.△H1+△H2+△H3+△H4+△H5+△H6=0 |
| D.△H1+△H6=△H2+△H3+△H4+△H6 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】下列有关热化学方程式的叙述正确的是
| A.已知S(正交,s) = S(单斜,s) ΔH=+0.33 kJ/mol, 则单斜硫比正交硫稳定 |
| B.H2(g)的燃烧热是285.8 kJ/mol,则2H2O(g) = 2H2(g)+O2(g)反应的ΔH=-(2×285.8) kJ/mol |
| C.已知中和热为ΔH = -57.3 kJ/mol,则1mol稀硫酸和足量稀NaOH溶液反应的反应热就是中和热 |
| D.已知乙醇的燃烧热为1366.8 kJ/mol,则乙醇燃烧的热化学方程式可表示为:C2H5OH(l)+3O2(g) =2CO2(g)+3H2O(l) ΔH = -1366.8 kJ/mol |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】下列关于热化学反应的描述正确的是
A.已知  ,用含20.0gNaOH的稀溶液与稀盐酸反应测出的中和反应的反应热 ,用含20.0gNaOH的稀溶液与稀盐酸反应测出的中和反应的反应热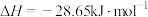 |
B.已知  ,则在一定条件下将 ,则在一定条件下将 和 和 置于一密闭容器中充分反应,放出的热量小于184.8kJ 置于一密闭容器中充分反应,放出的热量小于184.8kJ |
C.已知  , ,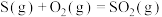  ,则 ,则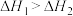 |
| D.测定中和热时,若用铜丝代替玻璃棒搅拌,会使测定的中和热的数值偏大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】下列各组热化学方程式中,化学反应的ΔH前者大于后者的是
①C(s)+O2(g)=CO2(g);C(s)+ O2(g)=CO(g)
O2(g)=CO(g)
②S(s)+O2(g)=SO2(g);S(g)+O2(g)=SO2(g)
③H2(g)+ O2(g)=H2O(l);2H2(g)+O2(g)=2H2O(l)
O2(g)=H2O(l);2H2(g)+O2(g)=2H2O(l)
④2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O(l);2KOH(aq)+H2SO4(浓)=K2SO4(aq)+2H2O(l)
⑤NaOH(aq)+HCl (aq)=NaCl (aq)+H2O(l);NaOH(aq)+CH3COOH(aq)=CH3COONa (aq)+H2O(l)
①C(s)+O2(g)=CO2(g);C(s)+
 O2(g)=CO(g)
O2(g)=CO(g)②S(s)+O2(g)=SO2(g);S(g)+O2(g)=SO2(g)
③H2(g)+
 O2(g)=H2O(l);2H2(g)+O2(g)=2H2O(l)
O2(g)=H2O(l);2H2(g)+O2(g)=2H2O(l)④2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O(l);2KOH(aq)+H2SO4(浓)=K2SO4(aq)+2H2O(l)
⑤NaOH(aq)+HCl (aq)=NaCl (aq)+H2O(l);NaOH(aq)+CH3COOH(aq)=CH3COONa (aq)+H2O(l)
| A.①③⑤ | B.②④⑤ | C.②③④ | D.①②③ |
您最近一年使用:0次