甘氨酸亚铁[ ]是新一代畜禽饲料补铁添加剂。某实验小组以碳酸亚铁和甘氨酸反应制备甘氨酸亚铁的装置如下:
]是新一代畜禽饲料补铁添加剂。某实验小组以碳酸亚铁和甘氨酸反应制备甘氨酸亚铁的装置如下:
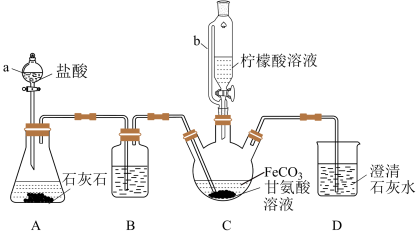
已知:①反应原理为 。
。
②甘氨酸易溶于水,微溶于乙醇;甘氨酸亚铁易溶于水,难溶于乙醇。
③柠檬酸易溶于水和乙醇,具有较强的还原性和酸性。
实验过程:
Ⅰ.装置C中盛有过量的 和
和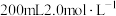 甘氨酸溶液。实验时,先打开仪器a的活塞,待装置C中的空气排净后,加热并不断搅拌,然后向三颈烧瓶中滴加柠檬酸溶液。
甘氨酸溶液。实验时,先打开仪器a的活塞,待装置C中的空气排净后,加热并不断搅拌,然后向三颈烧瓶中滴加柠檬酸溶液。
Ⅱ.反应结束后过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
(1)装置B的作用为___________ 。
(2)为了防止 被氧化,本实验采用的措施有
被氧化,本实验采用的措施有___________ 。
(3)实验室制取碳酸亚铁晶体(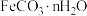 )过程中,可能有少量碳酸亚铁晶体被氧化为FeOOH,该反应的化学方程式为
)过程中,可能有少量碳酸亚铁晶体被氧化为FeOOH,该反应的化学方程式为___________ 。
(4)过程I加入柠檬酸溶液可调节溶液的pH,溶液pH与甘氨酸亚铁产率的关系如图所示。
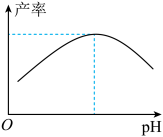
pH过低或过高均导致产率下降,原因是___________ 。
(5)过程Ⅱ中加入无水乙醇的目的是___________ 。
(6)产品中 含量的测定:准确称取5.60g产品,用蒸馏水配制成100mL溶液。取出25.00mL溶液于锥形瓶中,稀硫酸酸化后,用
含量的测定:准确称取5.60g产品,用蒸馏水配制成100mL溶液。取出25.00mL溶液于锥形瓶中,稀硫酸酸化后,用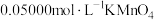 标准溶液滴定至终点(已知滴定过程中只有
标准溶液滴定至终点(已知滴定过程中只有 被氧化),消耗
被氧化),消耗 标准溶液的体积为20.00mL。判断达到滴定终点的依据是
标准溶液的体积为20.00mL。判断达到滴定终点的依据是___________ ,计算可得,产品中 的质量分数为
的质量分数为___________ %。
 ]是新一代畜禽饲料补铁添加剂。某实验小组以碳酸亚铁和甘氨酸反应制备甘氨酸亚铁的装置如下:
]是新一代畜禽饲料补铁添加剂。某实验小组以碳酸亚铁和甘氨酸反应制备甘氨酸亚铁的装置如下:
已知:①反应原理为
 。
。②甘氨酸易溶于水,微溶于乙醇;甘氨酸亚铁易溶于水,难溶于乙醇。
③柠檬酸易溶于水和乙醇,具有较强的还原性和酸性。
实验过程:
Ⅰ.装置C中盛有过量的
 和
和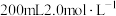 甘氨酸溶液。实验时,先打开仪器a的活塞,待装置C中的空气排净后,加热并不断搅拌,然后向三颈烧瓶中滴加柠檬酸溶液。
甘氨酸溶液。实验时,先打开仪器a的活塞,待装置C中的空气排净后,加热并不断搅拌,然后向三颈烧瓶中滴加柠檬酸溶液。Ⅱ.反应结束后过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
(1)装置B的作用为
(2)为了防止
 被氧化,本实验采用的措施有
被氧化,本实验采用的措施有(3)实验室制取碳酸亚铁晶体(
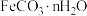 )过程中,可能有少量碳酸亚铁晶体被氧化为FeOOH,该反应的化学方程式为
)过程中,可能有少量碳酸亚铁晶体被氧化为FeOOH,该反应的化学方程式为(4)过程I加入柠檬酸溶液可调节溶液的pH,溶液pH与甘氨酸亚铁产率的关系如图所示。

pH过低或过高均导致产率下降,原因是
(5)过程Ⅱ中加入无水乙醇的目的是
(6)产品中
 含量的测定:准确称取5.60g产品,用蒸馏水配制成100mL溶液。取出25.00mL溶液于锥形瓶中,稀硫酸酸化后,用
含量的测定:准确称取5.60g产品,用蒸馏水配制成100mL溶液。取出25.00mL溶液于锥形瓶中,稀硫酸酸化后,用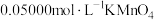 标准溶液滴定至终点(已知滴定过程中只有
标准溶液滴定至终点(已知滴定过程中只有 被氧化),消耗
被氧化),消耗 标准溶液的体积为20.00mL。判断达到滴定终点的依据是
标准溶液的体积为20.00mL。判断达到滴定终点的依据是 的质量分数为
的质量分数为
更新时间:2023-10-30 14:28:37
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】已知:I2+2 S2O32- S4O62-+2I-。相关物质的溶度积常数见下表:
S4O62-+2I-。相关物质的溶度积常数见下表:
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2•2H2O晶体,加入________ ;调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_____________ ;过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体。
(2)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,原因是________________ 。(用化学方程式表示)。由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是_______________ 。
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性质杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。已知:CuCl2溶液与KI反应的离子方程式为Cu2+ + 4I- = 2CuI↓ + I2
①可选用___________ 作滴定指示剂,滴定终点的现象是_________________ 。
②该试样中CuCl2•2H2O的质量百分数为___________________________ 。
 S4O62-+2I-。相关物质的溶度积常数见下表:
S4O62-+2I-。相关物质的溶度积常数见下表:| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(2)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,原因是
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性质杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。已知:CuCl2溶液与KI反应的离子方程式为Cu2+ + 4I- = 2CuI↓ + I2
①可选用
②该试样中CuCl2•2H2O的质量百分数为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】氟化工产业被称为“黄金产业”,我国是世界最大氟化工初级产品生产国和出口国。用工业副产品氟硅酸(H2SiF6)制备氟化铵(NH4F)联产氟化镁的流程如下:
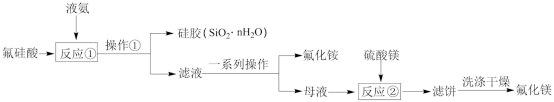
回答下列问题:
(1)氟化铵阳离子的VSEPR模型名称为:_______ 。
(2)写出反应①的化学方程式_______ 。
(3)工业生产中“反应①”的最佳温度为80℃,除考虑温度对速率的影响,请结合已有知识分析温度不宜过高的原因:_______ 。
(4)从滤液获得晶体的“一系列操作”是_______ 、降温结晶、过滤、洗涤、干燥。
(5)氟化铵含量的测定;称取mg样品于塑料烧杯中加水溶解,加入足量甲醛溶液,摇匀静置,滴加2~3滴酚酞指示剂,用0.5mol•L-1的氢氧化钠标准液滴定至终点,消耗氢氧化钠体积VmL,同时做空白对照实验消耗氢氧化钠体积为V0mL。
(已知:4 +6HCHO→(CH2)6N4H++3H++6H2O,1mol(CH2)6N4H+消耗1molNaOH)
+6HCHO→(CH2)6N4H++3H++6H2O,1mol(CH2)6N4H+消耗1molNaOH)
①滴定终点的现象为:_______ 。
②滴定近滴定终点时,过长时间振摇,红色消失,可能原因是_______ 。
③计算样品中氟化铵的含量为_______ 。

回答下列问题:
(1)氟化铵阳离子的VSEPR模型名称为:
(2)写出反应①的化学方程式
(3)工业生产中“反应①”的最佳温度为80℃,除考虑温度对速率的影响,请结合已有知识分析温度不宜过高的原因:
(4)从滤液获得晶体的“一系列操作”是
(5)氟化铵含量的测定;称取mg样品于塑料烧杯中加水溶解,加入足量甲醛溶液,摇匀静置,滴加2~3滴酚酞指示剂,用0.5mol•L-1的氢氧化钠标准液滴定至终点,消耗氢氧化钠体积VmL,同时做空白对照实验消耗氢氧化钠体积为V0mL。
(已知:4
 +6HCHO→(CH2)6N4H++3H++6H2O,1mol(CH2)6N4H+消耗1molNaOH)
+6HCHO→(CH2)6N4H++3H++6H2O,1mol(CH2)6N4H+消耗1molNaOH)①滴定终点的现象为:
②滴定近滴定终点时,过长时间振摇,红色消失,可能原因是
③计算样品中氟化铵的含量为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】实验室利用废铜屑制备硫酸铜晶体(CuSO4·5H2O)的一般流程为:

已知:(①)制备CuSO4的装置如图。

②某些氢氧化物沉淀的对应pH如下表。
请回答:
(1)仪器X的名称为___________ ,装置Y的作用是___________ 。
(2)下列有关操作及说法不正确的是___________。
(3)产品分析:称取硫酸铜晶体mg,加适量稀硫酸和水配成100mL溶液,每次取20.00mL,加入过量的KI溶液(杂质不参与反应),再加几滴淀粉溶液,用cmol·L-1Na2S2O3溶液滴定至终点。已知:2Cu2++4I-=2CuI↓+I2,I2+2 +2I-。
+2I-。
①滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):___________
检漏→蒸馏水洗涤→( )→( )→( )→( )→( )→开始滴定。
A烘干
B.装入滴定液至零刻度以上
C.调整滴定液液面至零刻度或零刻度以下
D.用洗耳球吹出润洗液
E.排除气泡
F.用滴定液润洗2至3次
G.记录起始读数
②滴定终点时的现象为___________ 。
③若平均消耗Na2S2O3溶液VmL,则所得样品中CuSO4·5H2O的纯度为___________ ×100%(用含字母的表达式表示)。

已知:(①)制备CuSO4的装置如图。

②某些氢氧化物沉淀的对应pH如下表。
| 氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Cu(OH)2 | 4.2 | 6.7 |
(1)仪器X的名称为
(2)下列有关操作及说法不正确的是___________。
| A.流程中的双氧水可用稀硝酸替换 |
| B.实验中可使用NaOH等碱溶液调整溶液pH至3.7~4.2的合适范围 |
| C.实验需有效控制n(HNO3)与n(Cu)的比值,过大影响产品纯度,过小则产率偏低 |
| D.自然冷却比用冰水冷却获得的胆矾晶体颗粒大 |
 +2I-。
+2I-。①滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):
检漏→蒸馏水洗涤→( )→( )→( )→( )→( )→开始滴定。
A烘干
B.装入滴定液至零刻度以上
C.调整滴定液液面至零刻度或零刻度以下
D.用洗耳球吹出润洗液
E.排除气泡
F.用滴定液润洗2至3次
G.记录起始读数
②滴定终点时的现象为
③若平均消耗Na2S2O3溶液VmL,则所得样品中CuSO4·5H2O的纯度为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐1】碳酸镧La2(CO3)3用于高磷酸症的治疗,难溶于水。实验室利用NH3、CO2和LaCl3溶液制备La2(CO3)3xH2O,所用装置如图所示(夹持装置略)。
(1)仪器A的名称是__ ;装置的连接顺序是a→__ ,__ ←b(填接口字母)。仪器B的作用是__ 。
(2)A中生成La2(CO3)3xH2O的化学方程式为__ 。
(3)测量La2(CO3)3xH2O的x值,有关实验装置和数据如下:
①加热前后均要通入一段时间的N2,加热前通入N2的操作是__ 目的是__ 。
②x=__ (用含ml、m2、m3、m4的代数式表示)。

(1)仪器A的名称是
(2)A中生成La2(CO3)3xH2O的化学方程式为
(3)测量La2(CO3)3xH2O的x值,有关实验装置和数据如下:

| C | E | |
| 实验前仪器与试剂总质量/g | m1 | m3 |
| 实验后仪器与试剂总质量/g | m2 | m4 |
②x=
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】已知木炭在一定条件下与浓硝酸反应生成两种+4价的氧化物,为了探究一氧化氮(NO)能否与过氧化钠反应,以及反应后的产物中是否有亚硝酸钠(NaNO2),某小组同学设计了如图所示装置(夹持仪器和连接用的胶管已经省略)。
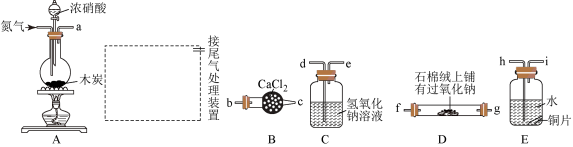
(1)为了完成该实验,虚线框内还需要连接B~E四套装置,按气流方向连接的顺序为: a→( )( )→( )( )→( )( )→ ( )( )____________ (填仪器接口的字母编号)。连接好仪器,检查气密性,装入药品后,要通入一段时间的氮气,再滴加浓硝酸,点燃酒精灯,通入氮气的主要目的是______ 。
(2)装置E中观察到的主要实验现象有_______________ 。
(3)装置C的作用是_____________________________________ 。
(4)某同学经查阅资料后发现亚硝酸是弱酸,性质不稳定,室温下易分解生成一氧化氮,装置D中充分反应后,设计实验证明D中是否有亚硝酸钠生成:____________________ 。(写出检验步骤及现象)。
(5)亚硝酸钠在酸性条件下可将I-氧化为I2,同时生成NO,该反应常用于亚硝酸钠含量的测定,请写出该反应的离子方程式:_______ 。

(1)为了完成该实验,虚线框内还需要连接B~E四套装置,按气流方向连接的顺序为: a→( )( )→( )( )→( )( )→ ( )( )
(2)装置E中观察到的主要实验现象有
(3)装置C的作用是
(4)某同学经查阅资料后发现亚硝酸是弱酸,性质不稳定,室温下易分解生成一氧化氮,装置D中充分反应后,设计实验证明D中是否有亚硝酸钠生成:
(5)亚硝酸钠在酸性条件下可将I-氧化为I2,同时生成NO,该反应常用于亚硝酸钠含量的测定,请写出该反应的离子方程式:
您最近一年使用:0次
【推荐3】硫酸锆[Zr(SO4)2•4H2O],是制取原子能级锆及其它锆化合物的中间原料,并大量用作皮革鞣剂、羊毛处理剂、催化剂等。下面是以锆英砂(主要成分为ZrO2,伴有杂质SiO2)为原料,利用碱熔法再进行酸浸制备硫酸锆的工艺过程。

已知:①Na2ZrO3、ZrOCl2、Zr(SO4)2均易溶于水,难溶于酒精及其他有机溶剂
②ZrOCl2 ZrO2++2Cl-;ZrO2++SO
ZrO2++2Cl-;ZrO2++SO
 ZrOSO4
ZrOSO4
③ZrO2++2H2O ZrO(OH)2+2H+
ZrO(OH)2+2H+
(1)步骤1中用到的仪器有泥三角、____ (填“铁”或“瓷”)坩埚、坩埚钳等。
(2)下列说法正确的是____ 。
(3)如图装置,经过一系列操作完成操作2中的抽滤和洗涤。
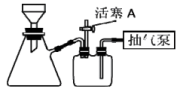
请选择合适的编号,按正确的操作顺序补充完整:____ 。
开抽气泵→a→d→b→_____→_____→_____→_____→b→e→关抽气泵。
a.转移固液混合物;b.确认抽干;c.加浓盐酸洗涤;d.关闭活塞A;e.打开活塞A;f.加无水乙醇洗涤
(4)ZrOCl2•8H2O洗涤后,在800℃下灼烧可得一种用于制备压电陶瓷的原料ZrO2,写出该灼烧过程的化学方程式____ 。
(5)实验室可以用络合滴定法测定锆含量。已知:ZrO2+与二甲酚橙生成红色络合物,ZrO2+能与EDTA发生络合反应(1∶1)生成无色络合物,且络合能力更强。

①样品溶解时,需要加入盐酸溶解,原因是:____ 。

②产品中锆的含量是____ (用含c、V、m的代数式表达)
③下列有关上述滴定操作的说法正确的是____ 。
A.滴定管活塞涂凡士林:用手指蘸取少量凡士林涂抹一薄层在活塞a、c(如图)处的四周,平行插入活塞槽中,然后朝同一个方向转动
B.滴定开始时可以将液体成线状快速流下,接近终点时减慢滴加速度,必要时采用半滴操作
C.读数时可将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
D.第一次滴定终点时,若测得消耗标准液体积小于5.00mL,则第二次滴定时可稀释待测液后重新滴定来减小误差

已知:①Na2ZrO3、ZrOCl2、Zr(SO4)2均易溶于水,难溶于酒精及其他有机溶剂
②ZrOCl2
 ZrO2++2Cl-;ZrO2++SO
ZrO2++2Cl-;ZrO2++SO
 ZrOSO4
ZrOSO4③ZrO2++2H2O
 ZrO(OH)2+2H+
ZrO(OH)2+2H+(1)步骤1中用到的仪器有泥三角、
(2)下列说法正确的是
| A.副产物1为H2SiO3、副产物2为NaCl、副产物3为HClO |
| B.步骤3加入HCl作用是与Na2ZrO3反应生成ZrOCl2,还能降低ZrOCl2的溶解度 |
| C.操作1为蒸发结晶、趁热过滤;操作2为重结晶 |
| D.制备的Zr(SO4)2•4H2O溶于水溶液呈酸性 |

请选择合适的编号,按正确的操作顺序补充完整:
开抽气泵→a→d→b→_____→_____→_____→_____→b→e→关抽气泵。
a.转移固液混合物;b.确认抽干;c.加浓盐酸洗涤;d.关闭活塞A;e.打开活塞A;f.加无水乙醇洗涤
(4)ZrOCl2•8H2O洗涤后,在800℃下灼烧可得一种用于制备压电陶瓷的原料ZrO2,写出该灼烧过程的化学方程式
(5)实验室可以用络合滴定法测定锆含量。已知:ZrO2+与二甲酚橙生成红色络合物,ZrO2+能与EDTA发生络合反应(1∶1)生成无色络合物,且络合能力更强。

①样品溶解时,需要加入盐酸溶解,原因是:

②产品中锆的含量是
③下列有关上述滴定操作的说法正确的是
A.滴定管活塞涂凡士林:用手指蘸取少量凡士林涂抹一薄层在活塞a、c(如图)处的四周,平行插入活塞槽中,然后朝同一个方向转动
B.滴定开始时可以将液体成线状快速流下,接近终点时减慢滴加速度,必要时采用半滴操作
C.读数时可将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
D.第一次滴定终点时,若测得消耗标准液体积小于5.00mL,则第二次滴定时可稀释待测液后重新滴定来减小误差
您最近一年使用:0次



