在初中化学“金属的性质”中有如下实验:将无锈铁钉没入 溶液,观察到铁钉表面出现红色物质。研究性学习小组对其展开了进一步探究。
溶液,观察到铁钉表面出现红色物质。研究性学习小组对其展开了进一步探究。
【提出问题】Al和 溶液也能发生化学反应吗?
溶液也能发生化学反应吗?
(1)预测Al能和
 溶液反应,理由是
溶液反应,理由是___________ 。
【进行实验】将一端缠绕的铝丝浸入 溶液(如图),观察现象。
溶液(如图),观察现象。
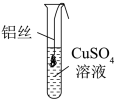
(2)铝丝表面未出现红色物质,原因是___________ (用化学方程式解释)。
【实验改进】用砂纸将铝丝表面打磨光亮,将其浸入 溶液,观察现象。
溶液,观察现象。
(3)填写实验报告单:
【深入探究】为研究上述异常现象,同学们查阅了相关资料,继续开展探究。
资料:①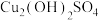 呈蓝绿色,不溶于水;②
呈蓝绿色,不溶于水;② 可加快铝丝和其他物质的反应速率。
可加快铝丝和其他物质的反应速率。
(4)取出铝丝,将试管中的混合物分离得到蓝绿色固体。加入稀硫酸,固体溶解形成蓝色溶液,该反应的化学方程式为___________ 。
(5)欲加快Al和
 溶液的反应,可加入的物质是
溶液的反应,可加入的物质是___________ (填一种即可)。
【拓展应用】通过探究,同学们提出了铝制品使用的注意事项。
(6)下列食品不能长时间用铝制炊具盛放的是___________(填序号)。
 溶液,观察到铁钉表面出现红色物质。研究性学习小组对其展开了进一步探究。
溶液,观察到铁钉表面出现红色物质。研究性学习小组对其展开了进一步探究。【提出问题】Al和
 溶液也能发生化学反应吗?
溶液也能发生化学反应吗?(1)预测Al能和
 溶液反应,理由是
溶液反应,理由是【进行实验】将一端缠绕的铝丝浸入
 溶液(如图),观察现象。
溶液(如图),观察现象。
(2)铝丝表面未出现红色物质,原因是
【实验改进】用砂纸将铝丝表面打磨光亮,将其浸入
 溶液,观察现象。
溶液,观察现象。(3)填写实验报告单:
| 序号 | 实验现象 | 结论与解释 |
| ① | 铝丝表面有少量气泡;铝丝周围出现蓝绿色物质 |  溶液呈弱酸性,与Al反应产生的气体是 溶液呈弱酸性,与Al反应产生的气体是 |
| ② |  后,铝丝仍光亮; 后,铝丝仍光亮; 后,铝丝表面出现少量红色物质 后,铝丝表面出现少量红色物质 | 红色物质是 溶液反应,但反应较慢 溶液反应,但反应较慢 |
| ③ | 铝丝周围溶液逐渐变成无色,铝丝以下溶液仍为蓝色;两层溶液界面清晰 | 反应生成的 为无色; 为无色; 溶液的密度小于 溶液的密度小于 溶液 溶液 |
【深入探究】为研究上述异常现象,同学们查阅了相关资料,继续开展探究。
资料:①
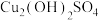 呈蓝绿色,不溶于水;②
呈蓝绿色,不溶于水;② 可加快铝丝和其他物质的反应速率。
可加快铝丝和其他物质的反应速率。(4)取出铝丝,将试管中的混合物分离得到蓝绿色固体。加入稀硫酸,固体溶解形成蓝色溶液,该反应的化学方程式为
(5)欲加快Al和
 溶液的反应,可加入的物质是
溶液的反应,可加入的物质是【拓展应用】通过探究,同学们提出了铝制品使用的注意事项。
(6)下列食品不能长时间用铝制炊具盛放的是___________(填序号)。
| A.食醋 | B.食用油 | C.面粉 | D.咸菜 |
更新时间:2023-11-03 14:05:37
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】立足教材实验是掌握高中化学实验的基础,是理解化学科学的实验原理、实验方法和实验思路,提高学生实验能力的基本途径:
(1)实验1:取一块金属钠,在玻璃片上用滤纸吸干表面的煤油后,用小刀切去一端的外皮,观察钠的颜色,这个实验中还需用到的一种仪器是_________ ;
(2)实验2:向一个盛有水的小烧杯里滴入几滴酚酞试液,然后把一小块钠投入小烧杯,把反应的现象和相应结论填入空格,“浮”--钠的密度比水小;“红”--反应生成了氢氧化钠;“熔”——______________ ;
(3)实验3:用坩埚钳夹住一小块用砂纸仔细打磨过的铝,在酒精灯上加热至熔化,发现熔化的铝并不滴落。下列关于上述实验现象的解释正确的是_________
A.火焰温度太低不能使铝燃烧 B.铝在空气中能很快形成氧化膜
C.氧化铝的熔点比铝的熔点高 D.用砂纸打磨不能除去表面的氧化膜
(4)实验4:把少量水滴入盛有Na2O2固体的试管中,立即用带火星的木条放在试管口,检验生成的气体,向反应后的溶液中加入酚酞试液,溶液中可以看到__________________________________________
(5)实验5:在玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,该氧化还原反应的氧化剂是__________ ,该反应每消耗1mol铁,转移电子的物质的量为_________ 。
(6)实验6:在试管中注入少量新制备的FeSO4溶液,用胶头滴管吸取NaOH溶液,将滴管尖端插入试管里溶液底部,慢慢挤出NaOH溶液,可以看到开始时析出一种白色的絮状沉淀,并迅速变成灰绿色,最后变成红褐色,发生这种颜色变化的原因是(用化学方程式表示):________________________________ 。
(1)实验1:取一块金属钠,在玻璃片上用滤纸吸干表面的煤油后,用小刀切去一端的外皮,观察钠的颜色,这个实验中还需用到的一种仪器是
(2)实验2:向一个盛有水的小烧杯里滴入几滴酚酞试液,然后把一小块钠投入小烧杯,把反应的现象和相应结论填入空格,“浮”--钠的密度比水小;“红”--反应生成了氢氧化钠;“熔”——
(3)实验3:用坩埚钳夹住一小块用砂纸仔细打磨过的铝,在酒精灯上加热至熔化,发现熔化的铝并不滴落。下列关于上述实验现象的解释正确的是
A.火焰温度太低不能使铝燃烧 B.铝在空气中能很快形成氧化膜
C.氧化铝的熔点比铝的熔点高 D.用砂纸打磨不能除去表面的氧化膜
(4)实验4:把少量水滴入盛有Na2O2固体的试管中,立即用带火星的木条放在试管口,检验生成的气体,向反应后的溶液中加入酚酞试液,溶液中可以看到
(5)实验5:在玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,该氧化还原反应的氧化剂是
(6)实验6:在试管中注入少量新制备的FeSO4溶液,用胶头滴管吸取NaOH溶液,将滴管尖端插入试管里溶液底部,慢慢挤出NaOH溶液,可以看到开始时析出一种白色的絮状沉淀,并迅速变成灰绿色,最后变成红褐色,发生这种颜色变化的原因是(用化学方程式表示):
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】金属钛( )因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。一种由钛铁矿[主要成分是钛酸亚铁
)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。一种由钛铁矿[主要成分是钛酸亚铁 ,还含有少量
,还含有少量 、
、 等杂质]为主要原料冶炼金属钛同时获得副产品绿砜
等杂质]为主要原料冶炼金属钛同时获得副产品绿砜 的工业生产流程如下图所示。
的工业生产流程如下图所示。

已知:① 易水解为
易水解为 。②
。② 在
在 时生成沉淀,
时生成沉淀, 时沉淀完全。③高温下钛易与
时沉淀完全。③高温下钛易与 等反应.
等反应.
(1)钛的性质比铁活泼,但金属钛具有较强的抗腐蚀性,原因可能是______________ 。
(2)“酸浸”后钛主要以 存在,写出相应反应的离子方程式
存在,写出相应反应的离子方程式______________ 。
(3)某实验小组为探究混合液中加入铁粉的最佳反应条件,进行了下列有关实验。
①在其它条件不变的情况下,体系中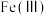 [指
[指 和
和 等含正三价铁元素的微粒]含量随
等含正三价铁元素的微粒]含量随 变化如图1,由图可知,还原体系中
变化如图1,由图可知,还原体系中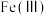 的最佳
的最佳 范围为
范围为______________ ,试分析,在 介于
介于 之间时,
之间时,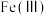 量基本保持不变的原因:
量基本保持不变的原因:______________ 。
②保持其它条件不变,体系中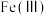 含量随温度变化如图2,由图可知,还原体系中
含量随温度变化如图2,由图可知,还原体系中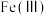 的最佳反应温度为
的最佳反应温度为______________  。
。

(4)“高温氯化”时生成 和一种可燃性气体,反应的化学方程式为
和一种可燃性气体,反应的化学方程式为______________ ;“高温氯化”反应理论计算结果显示,在 条件下达到平衡时,
条件下达到平衡时, 几乎完全转化为
几乎完全转化为 ,但实际生产中反应温度却远高于
,但实际生产中反应温度却远高于 ,其原因是
,其原因是______________ (写一种)。
(5)经处理后,流程中可循环利用的物质除 外,还有
外,还有______________ (填化学式)。
(6)镁高温下冶炼制取钛时需加保护气,下列可作为保护气的是______________ (填标号)。
a. b.Ar c.
b.Ar c. d.
d.
 )因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。一种由钛铁矿[主要成分是钛酸亚铁
)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。一种由钛铁矿[主要成分是钛酸亚铁 ,还含有少量
,还含有少量 、
、 等杂质]为主要原料冶炼金属钛同时获得副产品绿砜
等杂质]为主要原料冶炼金属钛同时获得副产品绿砜 的工业生产流程如下图所示。
的工业生产流程如下图所示。
已知:①
 易水解为
易水解为 。②
。② 在
在 时生成沉淀,
时生成沉淀, 时沉淀完全。③高温下钛易与
时沉淀完全。③高温下钛易与 等反应.
等反应.(1)钛的性质比铁活泼,但金属钛具有较强的抗腐蚀性,原因可能是
(2)“酸浸”后钛主要以
 存在,写出相应反应的离子方程式
存在,写出相应反应的离子方程式(3)某实验小组为探究混合液中加入铁粉的最佳反应条件,进行了下列有关实验。
①在其它条件不变的情况下,体系中
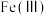 [指
[指 和
和 等含正三价铁元素的微粒]含量随
等含正三价铁元素的微粒]含量随 变化如图1,由图可知,还原体系中
变化如图1,由图可知,还原体系中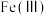 的最佳
的最佳 范围为
范围为 介于
介于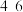 之间时,
之间时,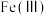 量基本保持不变的原因:
量基本保持不变的原因:②保持其它条件不变,体系中
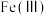 含量随温度变化如图2,由图可知,还原体系中
含量随温度变化如图2,由图可知,还原体系中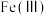 的最佳反应温度为
的最佳反应温度为 。
。
(4)“高温氯化”时生成
 和一种可燃性气体,反应的化学方程式为
和一种可燃性气体,反应的化学方程式为 条件下达到平衡时,
条件下达到平衡时, 几乎完全转化为
几乎完全转化为 ,但实际生产中反应温度却远高于
,但实际生产中反应温度却远高于 ,其原因是
,其原因是(5)经处理后,流程中可循环利用的物质除
 外,还有
外,还有(6)镁高温下冶炼制取钛时需加保护气,下列可作为保护气的是
a.
 b.Ar c.
b.Ar c. d.
d.
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】人类的生产和生活都离不开金属。
(一)金属材料的使用作为一个时代的标志,见证了人类文明发展的过程。历史上人类冶炼不同金属的大致年代如图所示:
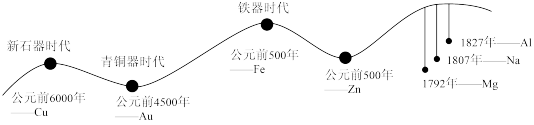
(1)由图可知人类最早使用的合金是___________ ;通过敲打可将金属材料打制成不同的形状,是利用了金属的___________ 性。
(2)北宋沈插在《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧,挹其水熬之则成胆矾(硫酸铜晶体),熬胆矾铁釜,久之亦化为铜”。下列叙述正确的是___________ (填序号)
A.“苦泉”的溶质之一——CuSO4
B.“挹其水之”——蒸发溶剂
C.“熬胆矾铁釜,久之亦化为铜”——发生置换反应
(3)铝的利用距今100多年,现在铝的年产量得到大幅度的提高。铝虽然较活泼,但抗腐蚀性能好,原因是________ (用化学方程式表示)
(二)实验室探究铜的冶炼
已知: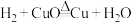 。有文献报道:在氢气还原氧化铜的一些实验中,得到的固体产物是铜和氧化亚铜(Cu2O)组成的混合物。氧化亚铜为红色固体,在空气中溶于氨水得到蓝色溶液,某兴趣小组对此开展如下探究。
。有文献报道:在氢气还原氧化铜的一些实验中,得到的固体产物是铜和氧化亚铜(Cu2O)组成的混合物。氧化亚铜为红色固体,在空气中溶于氨水得到蓝色溶液,某兴趣小组对此开展如下探究。
I、设计如图1实验装置,开展氢气还原氧化铜实验并检验固体产物。

(4)图1中制取氢气的化学反应方程式为____________________________________________ 。
(5)实验开始时,___________ (填序号)
A.先向长颈漏斗中加稀硫酸后点酒精灯 B.先点燃酒精灯加热后向长颈漏斗中加稀硫酸
(6)取反应后的红色固体于烧杯中,加入氨水并搅拌,观察到___________ ,证明固体产物有Cu2O。
II、探究反应生成Cu2O的变化情况。
称取若干份质量均为0.6000g的CuO,在相同条件下分别用氢气还原不同时间(t),检测所得固体中Cu2O的质量(m),结果如图2。
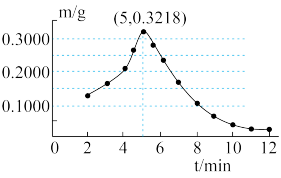
(7)由图2可知,在氢气还原氧化铜反应过程中,Cu2O质量的变化趋势是____________ 。
(8)为确保氢气还原氧化铜所得固体产物不含Cu2O,应采取的措施是___________ 。
III、探究反应生成Cu2O的原因。
为解释实验结果,兴趣小组对氢气还原氧化铜的反应过程提出如下假设:
假设1:经历 ,
, 两个反应,且在同一条件下两个反应同时进行。
两个反应,且在同一条件下两个反应同时进行。
假设2:依次经历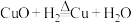 、
、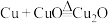 、
、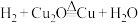 三个反应。
三个反应。
(9)结合探究II的结果,通过计算分析,假设1中“在同一条件下两个反应能同时进行”合理的依据是___________________ 。(写出合理的推理过程)
(三)用废铜屑生产硫酸铜晶体(CuSO4∙5H2O)的流程如下:
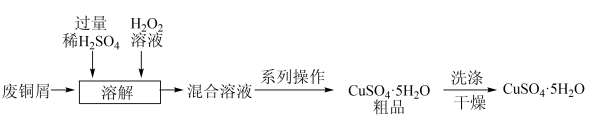
(10)“溶解”时发生的化学反应方程式为___________________ 。
(11)“洗涤、干燥”过程中常用95%的酒精做洗涤剂,优点是_________ 。
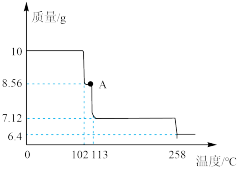
(12)取10g CuSO4∙5H2O,其受热脱水过程的热重曲线(剩余固体质量随温度变化的曲线)如图所示。则晶体CuSO4∙3H2O存在的最高温度约为___________ 。
(一)金属材料的使用作为一个时代的标志,见证了人类文明发展的过程。历史上人类冶炼不同金属的大致年代如图所示:

(1)由图可知人类最早使用的合金是
(2)北宋沈插在《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧,挹其水熬之则成胆矾(硫酸铜晶体),熬胆矾铁釜,久之亦化为铜”。下列叙述正确的是
A.“苦泉”的溶质之一——CuSO4
B.“挹其水之”——蒸发溶剂
C.“熬胆矾铁釜,久之亦化为铜”——发生置换反应
(3)铝的利用距今100多年,现在铝的年产量得到大幅度的提高。铝虽然较活泼,但抗腐蚀性能好,原因是
(二)实验室探究铜的冶炼
已知:
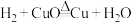 。有文献报道:在氢气还原氧化铜的一些实验中,得到的固体产物是铜和氧化亚铜(Cu2O)组成的混合物。氧化亚铜为红色固体,在空气中溶于氨水得到蓝色溶液,某兴趣小组对此开展如下探究。
。有文献报道:在氢气还原氧化铜的一些实验中,得到的固体产物是铜和氧化亚铜(Cu2O)组成的混合物。氧化亚铜为红色固体,在空气中溶于氨水得到蓝色溶液,某兴趣小组对此开展如下探究。I、设计如图1实验装置,开展氢气还原氧化铜实验并检验固体产物。

(4)图1中制取氢气的化学反应方程式为
(5)实验开始时,
A.先向长颈漏斗中加稀硫酸后点酒精灯 B.先点燃酒精灯加热后向长颈漏斗中加稀硫酸
(6)取反应后的红色固体于烧杯中,加入氨水并搅拌,观察到
II、探究反应生成Cu2O的变化情况。
称取若干份质量均为0.6000g的CuO,在相同条件下分别用氢气还原不同时间(t),检测所得固体中Cu2O的质量(m),结果如图2。

(7)由图2可知,在氢气还原氧化铜反应过程中,Cu2O质量的变化趋势是
(8)为确保氢气还原氧化铜所得固体产物不含Cu2O,应采取的措施是
III、探究反应生成Cu2O的原因。
为解释实验结果,兴趣小组对氢气还原氧化铜的反应过程提出如下假设:
假设1:经历
 ,
, 两个反应,且在同一条件下两个反应同时进行。
两个反应,且在同一条件下两个反应同时进行。假设2:依次经历
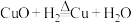 、
、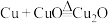 、
、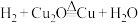 三个反应。
三个反应。(9)结合探究II的结果,通过计算分析,假设1中“在同一条件下两个反应能同时进行”合理的依据是
(三)用废铜屑生产硫酸铜晶体(CuSO4∙5H2O)的流程如下:

(10)“溶解”时发生的化学反应方程式为
(11)“洗涤、干燥”过程中常用95%的酒精做洗涤剂,优点是
(12)取10g CuSO4∙5H2O,其受热脱水过程的热重曲线(剩余固体质量随温度变化的曲线)如图所示。则晶体CuSO4∙3H2O存在的最高温度约为

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】废旧金属可回收利用,某化学兴趣小组用合金废料(含Fe、Cu和Al)制取FeSO4溶液和回收金属铜,实验流程如图所示(部分生成物已略去)。已知:2Al+2NaOH+2H2O=2NaAlO2+3H2↑。

(1)单质铁的金属活动性比铜________ (填“强”或“弱”)。
(2)操作Ⅰ的名称___________ ,操作Ⅱ用到的玻璃仪器有烧杯、玻璃棒和___________ (填仪器名称)。
(3)若取FeSO4溶液适量,滴入BaCl2溶液,发生反应的化学方程式为___________________________ ,该反应属于基本反应类型中的________ 反应。
(4)步骤B的化学方程式为_________________________________________ 。
(5)铝制品在空气中耐腐蚀的原因是_____________________________________________________ 。

(1)单质铁的金属活动性比铜
(2)操作Ⅰ的名称
(3)若取FeSO4溶液适量,滴入BaCl2溶液,发生反应的化学方程式为
(4)步骤B的化学方程式为
(5)铝制品在空气中耐腐蚀的原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】Na2S2O3·5H2O在化学定量分析中常用作基准物质,实验室制备原理为:2Na2S+Na2CO3+4SO2 3Na2S2O3+CO2。设计如下装置(夹持仪器省略)进行实验。
3Na2S2O3+CO2。设计如下装置(夹持仪器省略)进行实验。
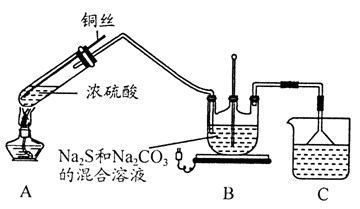
(1)A中发生的化学反应方程式为____________ 。
(2)C中所盛试剂可能是______ ;若要停止A中的化学反应,除取下酒精灯停止加热外,还可以采取的操作是_______ 。
(3)学生乙在加热A后,发现液面下的铜丝变黑。对黑色生成物该学生提出如下假设:
①可能是CuO ②可能是Cu2O ③可能是CuS
学生丙提出假设②一定不成立,依据是___________ ;该生用如下实验进一步验证黑色物质的组成:
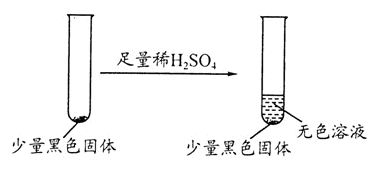
基于上述假设分析,黑色物质的组成为_____________ (填化学式)。
(4)实验室用Na2S2O3标液测量废水Ba2+的浓度,过程如下:
(已知:2 S2O32一+I2=S4O62—+2 I-)

①写出BaCrO4沉淀与过量HI、HCl溶液反应的离子方程式______________ ;
②以淀粉为指示剂,则到达滴定终点的现象是_______________ ;
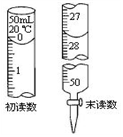
③若标液Na2S2O3的浓度0.0030mol·L-1,消耗该Na2S2O3溶液体积如图,则废水Ba2+的浓度为___ 。
 3Na2S2O3+CO2。设计如下装置(夹持仪器省略)进行实验。
3Na2S2O3+CO2。设计如下装置(夹持仪器省略)进行实验。
(1)A中发生的化学反应方程式为
(2)C中所盛试剂可能是
(3)学生乙在加热A后,发现液面下的铜丝变黑。对黑色生成物该学生提出如下假设:
①可能是CuO ②可能是Cu2O ③可能是CuS
学生丙提出假设②一定不成立,依据是

基于上述假设分析,黑色物质的组成为
(4)实验室用Na2S2O3标液测量废水Ba2+的浓度,过程如下:
(已知:2 S2O32一+I2=S4O62—+2 I-)

①写出BaCrO4沉淀与过量HI、HCl溶液反应的离子方程式
②以淀粉为指示剂,则到达滴定终点的现象是
③若标液Na2S2O3的浓度0.0030mol·L-1,消耗该Na2S2O3溶液体积如图,则废水Ba2+的浓度为

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。

供选试剂:30%H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体
(1)小组同学设计甲、乙、丙三组实验,记录如下
(2)丙实验中O2与KI溶液反应的离子方程式是____ 。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是___ 。为进一步探究该条件对反应速率的影响,可采取的实验措施是___ 。
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列_____ (填字母)溶液,证明了白雾中含有H2O2。
A.酸性KMnO4 B.FeC12 C.Na2S D.品红

供选试剂:30%H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体
(1)小组同学设计甲、乙、丙三组实验,记录如下
| 操作 | 现象 | |
| 甲 | 向I的锥形瓶中加入 | I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
| 乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
| 丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1mol/LH2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列
A.酸性KMnO4 B.FeC12 C.Na2S D.品红
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】已知:乙炔是无色无味的气体,实验室制的乙炔因电石中含有  、
、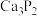 等,与水反应产生
等,与水反应产生 、
、 等气体,所以所制乙炔气体会有难闻的臭味。如图是某课外小组制取乙炔并测定乙炔的某些性质的实验。
等气体,所以所制乙炔气体会有难闻的臭味。如图是某课外小组制取乙炔并测定乙炔的某些性质的实验。
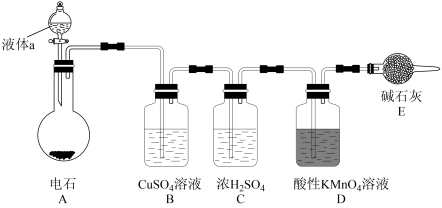
(1)写出实验室制取乙炔的化学方程式:_______
(2)实验室制取乙炔时,分液漏斗中的液体a通常是(填名称):_______
(3)①CuSO4溶液的作用是:_______
②装置D中的现象是:_______
(4)若将乙炔气体通入足量的溴水溶液中,溴水褪色,其反应的化学反应方程式为:_______
(5)装置E的作用是_______ 。
(6)乙炔可通过下列合成路线合成聚氯乙烯:乙炔→A→聚氯乙烯,由制A取聚氯乙烯的化学方程式为_______ 。
 、
、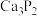 等,与水反应产生
等,与水反应产生 、
、 等气体,所以所制乙炔气体会有难闻的臭味。如图是某课外小组制取乙炔并测定乙炔的某些性质的实验。
等气体,所以所制乙炔气体会有难闻的臭味。如图是某课外小组制取乙炔并测定乙炔的某些性质的实验。
(1)写出实验室制取乙炔的化学方程式:
(2)实验室制取乙炔时,分液漏斗中的液体a通常是(填名称):
(3)①CuSO4溶液的作用是:
②装置D中的现象是:
(4)若将乙炔气体通入足量的溴水溶液中,溴水褪色,其反应的化学反应方程式为:
(5)装置E的作用是
(6)乙炔可通过下列合成路线合成聚氯乙烯:乙炔→A→聚氯乙烯,由制A取聚氯乙烯的化学方程式为
您最近一年使用:0次



