化学反应过程中释放或吸收的热量在生活、生产、科技及科研中应用广泛。
(1)下列有关化学变化中能量变化的说法中,正确的是___________。
(2)甲烷可用于生产合成气,其反应为CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.4kJ/mol,已知断裂1 mol相关化学键所需的能量如下表:
则a=__________ ,若加入催化剂改变上述反应历程,上述反应的 ΔH___________ (填“变大”、“变小”或“不变”)
(3)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。
① 联氨分子的电子式为___________ 。
② 试写出联氨与过量HCl反应的化学方程式__________ 。
③ 已知:N2(g)+2O2(g)=2NO2(g) ΔH=+66.4kJ/mol
N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH=-534kJ/mol
H2O(g)=H2O(l) ΔH=-44.0kJ/mol
则2N2H4(l)+2NO2(g)=3N2(g)+4H2O(l) ΔH=___________ kJ/mol。
(1)下列有关化学变化中能量变化的说法中,正确的是___________。
| A.需要加热才能发生的反应也可能是放热反应 |
| B.化学键断裂时通常放出能量 |
| C.反应物的总能量高于生成物的总能量表现为吸热反应 |
| D.反应物的总键能高于生成物的总键能表现为吸热反应 |
| 化学键 | H-H | O-H | C-H | C=O |
| 键能/(kJ·mol-¹) | 436 | a | 415.1 | 1076 |
(3)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。
① 联氨分子的电子式为
② 试写出联氨与过量HCl反应的化学方程式
③ 已知:N2(g)+2O2(g)=2NO2(g) ΔH=+66.4kJ/mol
N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH=-534kJ/mol
H2O(g)=H2O(l) ΔH=-44.0kJ/mol
则2N2H4(l)+2NO2(g)=3N2(g)+4H2O(l) ΔH=
更新时间:2023-11-05 18:53:41
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】(一)碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质,请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:

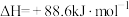
则M、N相比,较稳定的是___________ 。
(2)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,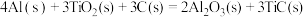
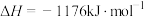 ,则反应过程中,每转移
,则反应过程中,每转移 电子放出的热量为
电子放出的热量为___________ kJ。
(3) 、
、 、C都是优质的能源物质,它们燃烧的热化学方程式分别为
、C都是优质的能源物质,它们燃烧的热化学方程式分别为
①
 ;
;
②
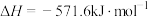 ;
;
③
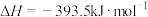 ;
;
 、
、 组成的混合气体
组成的混合气体 ,完全燃烧后放出热量1297.0kJ能量,该混合气体中
,完全燃烧后放出热量1297.0kJ能量,该混合气体中 与
与 的物质的量之比
的物质的量之比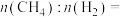
___________ ;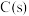 与
与 不反应,所以
不反应,所以 的反应热无法直接测量,但通过上述反应可求出其反应热
的反应热无法直接测量,但通过上述反应可求出其反应热
___________  。
。
(二) 的盐酸与
的盐酸与 的
的 溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应反应热,回答下列问题:
溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应反应热,回答下列问题: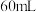
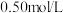 的盐酸与
的盐酸与
 的氢氧化钠溶液进行反应,若实验操作均正确,则所求中和热
的氢氧化钠溶液进行反应,若实验操作均正确,则所求中和热___________ (填“相等”或“不相等”)。
(5)下列说法正确的是___________ (填字母)。
a.向内筒中加入稀碱时,应当缓慢而匀速地加入
b.将用量筒量取好的稀盐酸如入内筒后,应当快速用水冲洗量筒内壁剩余的稀盐酸至内筒中,以免造成测量误差
c.用量筒量取稀酸或碱时,眼睛必须与液体凹面最低处相平
d.内筒洗净后,未及时烘干,直接用该内筒进行实验,对生成
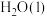 时所测得的中和反应的反应热(
时所测得的中和反应的反应热( )有影响,
)有影响, 会偏大
会偏大
(1)有机物M经过太阳光光照可转化成N,转化过程如下:

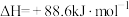
则M、N相比,较稳定的是
(2)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,
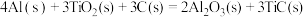
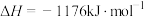 ,则反应过程中,每转移
,则反应过程中,每转移 电子放出的热量为
电子放出的热量为(3)
 、
、 、C都是优质的能源物质,它们燃烧的热化学方程式分别为
、C都是优质的能源物质,它们燃烧的热化学方程式分别为①

 ;
;②

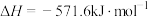 ;
;③

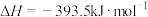 ;
; 、
、 组成的混合气体
组成的混合气体 ,完全燃烧后放出热量1297.0kJ能量,该混合气体中
,完全燃烧后放出热量1297.0kJ能量,该混合气体中 与
与 的物质的量之比
的物质的量之比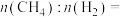
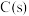 与
与 不反应,所以
不反应,所以 的反应热无法直接测量,但通过上述反应可求出其反应热
的反应热无法直接测量,但通过上述反应可求出其反应热
 。
。(二)
 的盐酸与
的盐酸与 的
的 溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应反应热,回答下列问题:
溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应反应热,回答下列问题: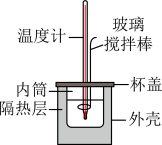
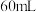
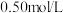 的盐酸与
的盐酸与
 的氢氧化钠溶液进行反应,若实验操作均正确,则所求中和热
的氢氧化钠溶液进行反应,若实验操作均正确,则所求中和热(5)下列说法正确的是
a.向内筒中加入稀碱时,应当缓慢而匀速地加入
b.将用量筒量取好的稀盐酸如入内筒后,应当快速用水冲洗量筒内壁剩余的稀盐酸至内筒中,以免造成测量误差
c.用量筒量取稀酸或碱时,眼睛必须与液体凹面最低处相平
d.内筒洗净后,未及时烘干,直接用该内筒进行实验,对生成

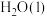 时所测得的中和反应的反应热(
时所测得的中和反应的反应热( )有影响,
)有影响, 会偏大
会偏大
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】2022年6月5日10时44分,搭载神舟十四号载人飞船的长征二号F遥十四运载火箭在酒泉卫星发射中心点火发射,成功将飞船运送到预定轨道。肼(N2H4)是一种良好的火箭推进剂,其与适当的氧化剂(如过氧化氢、氧气等)配合,可组成比冲最高的可贮存液体推进剂。_______ ;消耗16g液态肼放出的热量为_______ 。
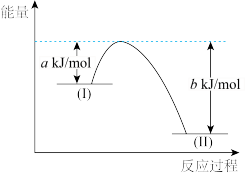
(2)已知:N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-544kJ/mol,用如下图示表示该反应时:_______ (填“I”或“II”)处物质,(b-a)kJ/mol表示该反应的_______ 。使用合适的催化剂,_______ (填“能"或“不能")改变该反应的焓变。
(3)已知:N2(g)+2O2(g)=2NO2(g) ΔH=+68kJ·mol-1,则肼(g)和二氧化氮(g)反应生成氮气和水蒸气的热化学方程式为_______ 。
(4)火箭如果用压缩NO2作氧化剂,发射时尾部有大量的红棕色气体产生,此颜色比压缩NO2颜色更深,原因是_______ (用化学方程式表示)。


(2)已知:N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-544kJ/mol,用如下图示表示该反应时:
(3)已知:N2(g)+2O2(g)=2NO2(g) ΔH=+68kJ·mol-1,则肼(g)和二氧化氮(g)反应生成氮气和水蒸气的热化学方程式为
(4)火箭如果用压缩NO2作氧化剂,发射时尾部有大量的红棕色气体产生,此颜色比压缩NO2颜色更深,原因是
您最近一年使用:0次
【推荐3】甲醇作为燃料,在化石能源和可再生能源时期均有广泛的应用前景。
Ⅰ.甲醇可以替代汽油和柴油作为内燃机燃料
(1)汽油的主要成分之一是辛烷[C8H18(l)]。已知:25℃,101KPa时,0.2mol辛烷完全燃烧生成气态二氧化碳和液态水,放出1103.6kJ热量。该反应的热化学方程式为___ 。25℃,101KPa时CH3OH(l)+ O2(g)=CO2(g)+2H2O(l)ΔH=-726.5kJ·mol-1,相同质量的甲醇和辛烷分别燃烧时释放的热量用于煅烧石灰石制备CaO,则得到CaO多的是
O2(g)=CO2(g)+2H2O(l)ΔH=-726.5kJ·mol-1,相同质量的甲醇和辛烷分别燃烧时释放的热量用于煅烧石灰石制备CaO,则得到CaO多的是___ (填“甲醇”或“辛烷”)。
(2)CH3OH(l)+O2(g)=CO(g)+2H2O(g)ΔH=-393kJ·mol-1,该反应相关化学键键能数据如下表:则X=___ 。
Ⅱ.甲醇的合成
(3)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如图所示。___ 。
②该反应需要加入铜-锌基催化剂。加入催化剂后,该反应ΔH___ (填“变大”、“变小”或“不变”)。
③已知:CO(g)+ O2(g)=CO2(g) ΔH1=-283kJ·mol-1
O2(g)=CO2(g) ΔH1=-283kJ·mol-1
H2(g)+ O2(g)=H2O(g) ΔH2=-242kJ·mol-1
O2(g)=H2O(g) ΔH2=-242kJ·mol-1
CH3OH(g)+ O2(g)=CO2(g)+2H2O(g) ΔH3=-676kJ·mol-1
O2(g)=CO2(g)+2H2O(g) ΔH3=-676kJ·mol-1
以CO(g)和H2(g)为原料合成甲醇的热化学方程式为___ 。
Ⅰ.甲醇可以替代汽油和柴油作为内燃机燃料
(1)汽油的主要成分之一是辛烷[C8H18(l)]。已知:25℃,101KPa时,0.2mol辛烷完全燃烧生成气态二氧化碳和液态水,放出1103.6kJ热量。该反应的热化学方程式为
 O2(g)=CO2(g)+2H2O(l)ΔH=-726.5kJ·mol-1,相同质量的甲醇和辛烷分别燃烧时释放的热量用于煅烧石灰石制备CaO,则得到CaO多的是
O2(g)=CO2(g)+2H2O(l)ΔH=-726.5kJ·mol-1,相同质量的甲醇和辛烷分别燃烧时释放的热量用于煅烧石灰石制备CaO,则得到CaO多的是(2)CH3OH(l)+O2(g)=CO(g)+2H2O(g)ΔH=-393kJ·mol-1,该反应相关化学键键能数据如下表:则X=
| 化学键 | O=O | C-O | C≡O | H-O | C-H |
| E/(kJ·mol-1) | 496 | 343 | 1076 | X | 413 |
(3)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如图所示。

②该反应需要加入铜-锌基催化剂。加入催化剂后,该反应ΔH
③已知:CO(g)+
 O2(g)=CO2(g) ΔH1=-283kJ·mol-1
O2(g)=CO2(g) ΔH1=-283kJ·mol-1H2(g)+
 O2(g)=H2O(g) ΔH2=-242kJ·mol-1
O2(g)=H2O(g) ΔH2=-242kJ·mol-1CH3OH(g)+
 O2(g)=CO2(g)+2H2O(g) ΔH3=-676kJ·mol-1
O2(g)=CO2(g)+2H2O(g) ΔH3=-676kJ·mol-1以CO(g)和H2(g)为原料合成甲醇的热化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】氢气是未来最理想的能源之一,科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术:2H2O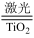 2H2↑+O2↑。制得的氢气可用于燃料电池。试回答下列问题:
2H2↑+O2↑。制得的氢气可用于燃料电池。试回答下列问题:
(1)海水分解生成的氢气用于燃料电池时,实现____ 能转变为____ 能。水分解时,断裂的化学键为____ 键,(填极性共价,非极性共价或离子)分解海水的反应属于_____ 反应(填“放热”或“吸热”)。
(2)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为:A极:2H2+2O2--4e-===2H2O;B极:O2+4e-===2O2-,则A极是电池的____ 极;电子从该极_____ (填“流入”或“流出”)。电流从该电极_____ (填“流入”或“流出”)
(3)有人以化学反应:2Zn+O2+4H+===2Zn2++2H2O为基础设计出一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作。则原电池的负极材料是____ ,正极上发生反应的电极反应式为____ 。
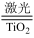 2H2↑+O2↑。制得的氢气可用于燃料电池。试回答下列问题:
2H2↑+O2↑。制得的氢气可用于燃料电池。试回答下列问题:(1)海水分解生成的氢气用于燃料电池时,实现
(2)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为:A极:2H2+2O2--4e-===2H2O;B极:O2+4e-===2O2-,则A极是电池的
(3)有人以化学反应:2Zn+O2+4H+===2Zn2++2H2O为基础设计出一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作。则原电池的负极材料是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】合成氨技术的创立开辟了人工固氮的重要途径。
(1)我国科学家研究了在铁掺杂W18O19纳米反应器催化剂表面上实现常温低电位合成氨,反应历程如图,其中吸附在催化剂表面的物种用*标注。需要吸收能量最大的能垒E=___________ eV。

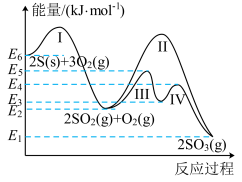
一定条件下,在体积为5L的密闭容器中,ABC三种气体的物质的量n(mol)随时间t(min)的变化如图1所示。已知达到平衡后,降低温度,A的体积分数将减小。
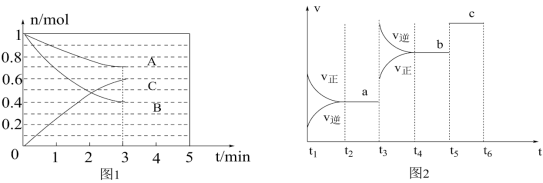
(2)该反应的化学方程式为___________ 。
(3)该反应的反应速率v随时间t的变化关系如图2所示,根据图判断,在t3时刻改变的外界条件是___________ 。
(1)我国科学家研究了在铁掺杂W18O19纳米反应器催化剂表面上实现常温低电位合成氨,反应历程如图,其中吸附在催化剂表面的物种用*标注。需要吸收能量最大的能垒E=

一定条件下,在体积为5L的密闭容器中,ABC三种气体的物质的量n(mol)随时间t(min)的变化如图1所示。已知达到平衡后,降低温度,A的体积分数将减小。

(2)该反应的化学方程式为
(3)该反应的反应速率v随时间t的变化关系如图2所示,根据图判断,在t3时刻改变的外界条件是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】根据要求回答下列问题:
(1)工业上利用镍与CO形成化合物Ni(CO)4分离提纯镍。C原子能量最高的电子为_______ 轨道上的电子,该轨道呈_______ 形。CO的结构式为_______ ,WgCO中含 键数目为
键数目为_______ 。
(2)硅是重要的半导体材料,构成了现代电子工业的基础。基态Si原子中,电子占据的最高能层的符号为_______ ,核外电子的运动状态有_______ 种,有_______ 种能量不同的电子。
(3)有关碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是_______ 。
(4)按要求写出由第二周期元素为中心原子,通过sp3杂化形成中性分子的化学式(各写一种):正四面体形分子_______ ,三角锥形分子_______ ,V形分子_______ 。
(5)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从原子核外电子结构角度来看,Fe2+易被氧化成Fe3+的原因是_______ 。
(1)工业上利用镍与CO形成化合物Ni(CO)4分离提纯镍。C原子能量最高的电子为
 键数目为
键数目为(2)硅是重要的半导体材料,构成了现代电子工业的基础。基态Si原子中,电子占据的最高能层的符号为
(3)有关碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能/(KJ/mol) | 356 | 413 | 336 | 226 | 318 | 452 |
(4)按要求写出由第二周期元素为中心原子,通过sp3杂化形成中性分子的化学式(各写一种):正四面体形分子
(5)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从原子核外电子结构角度来看,Fe2+易被氧化成Fe3+的原因是
您最近一年使用:0次
【推荐1】煤和石油通常都含有硫的化合物,燃烧生成的二氧化硫为大气主要污染物之一、二氧化硫的治理已成为当前研究的课题。硫与硫的氧化物在转化过程中的能量变化如图所示。
已知: 。回答下列问题:
。回答下列问题:
(1)图中的I、II、III、IV中属于放热反应的是_______ 。
(2)写出表示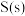 的燃烧热的热化学方程式:
的燃烧热的热化学方程式:_______ 。
(3)从图中可看出将SO2氧化成SO3有两条途径:
①SO2经过程III、过程IV转化成SO3;②SO2经过程II转化成SO3。已知过程IV的化学方程式为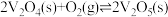 ,则过程III的热化学方程式为
,则过程III的热化学方程式为_______ 。
(4) 和
和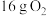 在一定条件下连续发生过程I和过程II的反应,充分反应后无固体剩余,测得放出的热量为
在一定条件下连续发生过程I和过程II的反应,充分反应后无固体剩余,测得放出的热量为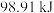 。则反应后的体系中各组分的物质的量分别为
。则反应后的体系中各组分的物质的量分别为_______ 。
(5)已知: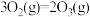
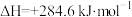 ,则相同条件下,
,则相同条件下,_______ (填“ ”或“
”或“ ”)更稳定,
”)更稳定,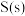 在
在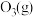 中能直接生成
中能直接生成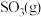 ,该反应的热化学方程式为
,该反应的热化学方程式为_______ 。

已知:
 。回答下列问题:
。回答下列问题:(1)图中的I、II、III、IV中属于放热反应的是
(2)写出表示
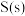 的燃烧热的热化学方程式:
的燃烧热的热化学方程式:(3)从图中可看出将SO2氧化成SO3有两条途径:
①SO2经过程III、过程IV转化成SO3;②SO2经过程II转化成SO3。已知过程IV的化学方程式为
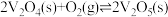 ,则过程III的热化学方程式为
,则过程III的热化学方程式为(4)
 和
和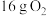 在一定条件下连续发生过程I和过程II的反应,充分反应后无固体剩余,测得放出的热量为
在一定条件下连续发生过程I和过程II的反应,充分反应后无固体剩余,测得放出的热量为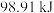 。则反应后的体系中各组分的物质的量分别为
。则反应后的体系中各组分的物质的量分别为(5)已知:
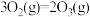
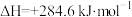 ,则相同条件下,
,则相同条件下, ”或“
”或“ ”)更稳定,
”)更稳定,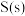 在
在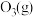 中能直接生成
中能直接生成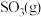 ,该反应的热化学方程式为
,该反应的热化学方程式为
您最近一年使用:0次
【推荐2】氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g)===2H2O(1) ΔH=-572kJ·mol-1。请回答下列问题:
(1)生成物能量总和_____ (填“大于”“小于”或“等于”)反应物能量总和。
(2)若2 mol氢气燃烧生成水蒸气,则放出的热量______ (填“大于”“小于”或“等于”)572kJ。
(3)H2的标准燃烧热ΔH=_____ 。
(4)反应2H2+O2 2H2O的能量变化如图所示。
2H2O的能量变化如图所示。

已知拆开1molH2、1molO2和1 mol H—O中的化学键分别需要消耗436kJ、496kJ和463kJ的能量。则反应过程(Ⅱ)_____ (填“吸收”或“放出”)_____ kJ。
(1)生成物能量总和
(2)若2 mol氢气燃烧生成水蒸气,则放出的热量
(3)H2的标准燃烧热ΔH=
(4)反应2H2+O2
 2H2O的能量变化如图所示。
2H2O的能量变化如图所示。
已知拆开1molH2、1molO2和1 mol H—O中的化学键分别需要消耗436kJ、496kJ和463kJ的能量。则反应过程(Ⅱ)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ•mol﹣1表示.请认真观察如图,然后回答问题.

(1)图中反应是__________ (填“吸热”或“放热”)反应,该反应________ (填“需要”或“不需要”)环境先提供能量,该反应的△H=__________ (用含E1、E2的代数式表示).
(2)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能__________ ,因此反应速率___________ ,你认为改变的条件是:_______________ .
(3)已知常温下拆开1mol H﹣H键,1molN﹣H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为:__________________ 。

(1)图中反应是
(2)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能
(3)已知常温下拆开1mol H﹣H键,1molN﹣H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】回答下列问题。
(1)利用 超干重整
超干重整 技术,可以得到富含CO和
技术,可以得到富含CO和 的化工原料气,反应如下:①
的化工原料气,反应如下:①
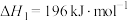
已知部分化学键的键能如下:
(CO中可近似认为是碳氧三键):
由此计算H—H键的键能约为___________  (保留整数)。
(保留整数)。
(2)已知:②

③
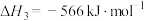
结合反应①,计算 的
的
___________ 。
(1)利用
 超干重整
超干重整 技术,可以得到富含CO和
技术,可以得到富含CO和 的化工原料气,反应如下:①
的化工原料气,反应如下:①
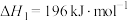
已知部分化学键的键能如下:
| 共价键 | C—H | H—O | C≡O |
键能( ) ) | 414 | 464 | 1072 |
由此计算H—H键的键能约为
 (保留整数)。
(保留整数)。(2)已知:②


③

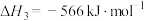
结合反应①,计算
 的
的
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】(1)在微生物作用的条件下, 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
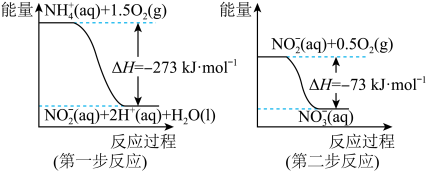
(1)第一步反应是________ (填“放热”或“吸热”)反应,判断依据是_______________________ 。
(2)已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·mol-1①
Na2O2(s)+CO2(g)=Na2CO3(s)+ O2(g) ΔH=-226kJ·mol-1②
O2(g) ΔH=-226kJ·mol-1②
则CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数目为__________ 。
(3)已知H2(g)+Br2(l)=2HBr(g) ΔH=-72kJ·mol-1,蒸发1molBr2(l)需要吸收的能量为30kJ,其他相关数据如下表:
则表中a=______________ 。
 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
(1)第一步反应是
(2)已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·mol-1①
Na2O2(s)+CO2(g)=Na2CO3(s)+
 O2(g) ΔH=-226kJ·mol-1②
O2(g) ΔH=-226kJ·mol-1②则CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数目为
(3)已知H2(g)+Br2(l)=2HBr(g) ΔH=-72kJ·mol-1,蒸发1molBr2(l)需要吸收的能量为30kJ,其他相关数据如下表:
| 物质 | H2(g) | Br2(g) | HBr(g) |
| 1mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | 200 | a |
则表中a=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】氮的化合物广泛应用于工业、航天、医药等领域。
(1)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+ 4NH3(g) 5N2(g)+6H2O(g)。该反应已达到平衡状态的标志是
5N2(g)+6H2O(g)。该反应已达到平衡状态的标志是__________ 。
a 反应速率v(NO)= v(H2O)
b 容器内压强不再变化
c 容器内 N2的物质的量分数不再变化
d 容器内 n(NO)∶n(NH3)∶n(N2)∶n(H2O)= 6∶4∶5∶6
e 12 mol N-H 键断裂的同时生成 5 mol N≡N 键
f 混合气体的平均相对分子质量不再改变
(2)肼(N2H4)是火箭的高能燃料,该物质燃烧时生成水蒸气和氮气,已知某些化学键的键能如下:
则1 mol N2H4在氧气中完全燃烧的过程中_____ (填“吸收”或“放出”)的能量为_______ kJ。
(3)一定条件下,在 5 L密闭容器内,反应 2NO2(g) N2O4(g),NO2的物质的量随时间变化如下表:
N2O4(g),NO2的物质的量随时间变化如下表:
①用 N2O4 表示 0~2 s 内该反应的平均速率为_____ mol•L-1•s-1。在第 5s 时,NO2的转化率为_____ 。
②为加快反应速率,可以采取的措施是_______
a 升高温度 b 恒容时充入He(g)
c 恒压时充入He(g) d 恒容时充入NO2
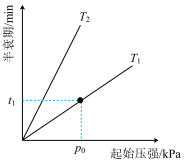
(4)已知:2N2O = 2N2+O2。不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1_____ T2(填“>”、 “=”或“<”)。当温度为T1、起始压强为p0,反应至t1min时,此时体系压强p=________ (用p0表示)。
(1)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+ 4NH3(g)
 5N2(g)+6H2O(g)。该反应已达到平衡状态的标志是
5N2(g)+6H2O(g)。该反应已达到平衡状态的标志是a 反应速率v(NO)= v(H2O)
b 容器内压强不再变化
c 容器内 N2的物质的量分数不再变化
d 容器内 n(NO)∶n(NH3)∶n(N2)∶n(H2O)= 6∶4∶5∶6
e 12 mol N-H 键断裂的同时生成 5 mol N≡N 键
f 混合气体的平均相对分子质量不再改变
(2)肼(N2H4)是火箭的高能燃料,该物质燃烧时生成水蒸气和氮气,已知某些化学键的键能如下:
| 化学键 | O—H | N—N | N—H | O=O | N≡N |
| 键能kJ•mol-1 | 467 | 160 | 391 | 498 | 945 |
(3)一定条件下,在 5 L密闭容器内,反应 2NO2(g)
 N2O4(g),NO2的物质的量随时间变化如下表:
N2O4(g),NO2的物质的量随时间变化如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
②为加快反应速率,可以采取的措施是
a 升高温度 b 恒容时充入He(g)
c 恒压时充入He(g) d 恒容时充入NO2
(4)已知:2N2O = 2N2+O2。不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1

您最近一年使用:0次



