下列变化过程,属于放热反应的是___________ (填写序号)。
①浓 稀释 ②酸碱中和反应 ③
稀释 ②酸碱中和反应 ③ 在
在 中燃烧 ④固体
中燃烧 ④固体 溶于水 ⑤液态水变成水蒸气 ⑥碳在高温条件下还原
溶于水 ⑤液态水变成水蒸气 ⑥碳在高温条件下还原
①浓
 稀释 ②酸碱中和反应 ③
稀释 ②酸碱中和反应 ③ 在
在 中燃烧 ④固体
中燃烧 ④固体 溶于水 ⑤液态水变成水蒸气 ⑥碳在高温条件下还原
溶于水 ⑤液态水变成水蒸气 ⑥碳在高温条件下还原
更新时间:2023-10-27 20:36:35
|
相似题推荐
填空题
|
较易
(0.85)
解题方法
【推荐1】舍勒发现氯气是在1774年,当时他正在研究软锰矿(二氧化锰),当他使软锰矿与浓盐酸混合并加热时,产生了一种黄绿色的气体,发生反应的方程式为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。舍勒制备出氯气以后,把它溶解在水里,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属、非金属、碱等发生化学反应。
MnCl2+Cl2↑+2H2O,这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。舍勒制备出氯气以后,把它溶解在水里,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属、非金属、碱等发生化学反应。
舍勒发现氯气是在1774年,当时他正在研究软锰矿(二氧化锰),当他使软锰矿与浓盐酸混合并加热时,产生了一种黄绿色的气体,发生反应的方程式为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。舍勒制备出氯气以后,把它溶解在水里,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属、非金属、碱等发生化学反应。
MnCl2+Cl2↑+2H2O,这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。舍勒制备出氯气以后,把它溶解在水里,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属、非金属、碱等发生化学反应。
(1)氯气和氢气的反应的属于____________
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
(2)对于反应MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,下列说法正确的是
MnCl2+Cl2↑+2H2O,下列说法正确的是_____________
A.MnO2是还原剂 B.MnCl2是氧化产物
C.Cl2是氧化产物 D.H2O是还原产物
(3)下列反应条件的改变对实验室制备氯气速率的影响正确的是_____________
A.增大盐酸的浓度能加快反应速率
B.若用稀盐酸与二氧化锰反应则反应速率较慢
C.升高温度能减慢反应速率
D.增加MnO2的质量可显著加快反应速率
(4)氢气在氯气中燃烧为放热反应,下列说法正确的是________________
A.断开Cl—Cl键放出能量 B.形成H—Cl键吸收能量
C.燃烧都是放热反应 D.反应物的总能量小于生成物的总能量
 MnCl2+Cl2↑+2H2O,这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。舍勒制备出氯气以后,把它溶解在水里,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属、非金属、碱等发生化学反应。
MnCl2+Cl2↑+2H2O,这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。舍勒制备出氯气以后,把它溶解在水里,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属、非金属、碱等发生化学反应。舍勒发现氯气是在1774年,当时他正在研究软锰矿(二氧化锰),当他使软锰矿与浓盐酸混合并加热时,产生了一种黄绿色的气体,发生反应的方程式为MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O,这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。舍勒制备出氯气以后,把它溶解在水里,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属、非金属、碱等发生化学反应。
MnCl2+Cl2↑+2H2O,这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。舍勒制备出氯气以后,把它溶解在水里,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属、非金属、碱等发生化学反应。(1)氯气和氢气的反应的属于
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
(2)对于反应MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O,下列说法正确的是
MnCl2+Cl2↑+2H2O,下列说法正确的是A.MnO2是还原剂 B.MnCl2是氧化产物
C.Cl2是氧化产物 D.H2O是还原产物
(3)下列反应条件的改变对实验室制备氯气速率的影响正确的是
A.增大盐酸的浓度能加快反应速率
B.若用稀盐酸与二氧化锰反应则反应速率较慢
C.升高温度能减慢反应速率
D.增加MnO2的质量可显著加快反应速率
(4)氢气在氯气中燃烧为放热反应,下列说法正确的是
A.断开Cl—Cl键放出能量 B.形成H—Cl键吸收能量
C.燃烧都是放热反应 D.反应物的总能量小于生成物的总能量
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐2】利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:
已知:
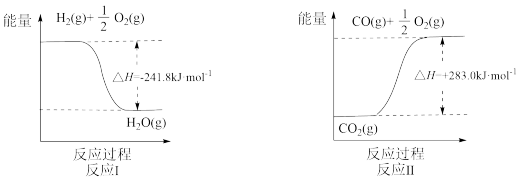
(1)反应Ⅱ是___________ 反应(填“吸热”或“放热”),其原因是___________ 。
(2)反应A的热化学方程式是___________ 。
反应A:

已知:

(1)反应Ⅱ是
(2)反应A的热化学方程式是
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐3】生产生活中的化学反应都伴随着能量的变化,请根据有关知识回答下列问题:
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等多种用途。冷敷袋的作用原理可以是______。
(2)以下是三种常见冷敷袋所盛装的主要物质,请从(1)的选项中找出其对应的主要工作原理。
①冰 ②硝酸铵+水 ③硝酸铵+水合碳酸钠
①②③对应的主要工作原理依次是______ [对应填(1)中选项的标号]。
(3)冬天使用的“热敷袋”是利用原电池原理产生热量,主要成分是铁屑、碳粉和少量的NaCl、水等。“热敷袋”在启用前用塑料袋使之与空气隔绝;启用时打开塑料袋轻轻揉搓,就会放出热量。碳粉的作用是____________ ,负极的电极方程式为____________ 。
(4)某化学兴趣小组的同学为了探究铝电极在电池中的作用,设计并进行了以下一组实验,实验结果记录如下:
实验1中正极反应式为______ ;实验2中负极材料为______ 。
(5)
美国阿波罗宇宙飞船上使用了一种新型装置,其构造如上图所示。A、B两个电极均由多孔的碳块组成。该电池的正极反应式为______ 。
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等多种用途。冷敷袋的作用原理可以是______。
| A.放热的化学变化 | B.吸热的化学变化 | C.放热的物理变化 | D.吸热的物理变化 |
(2)以下是三种常见冷敷袋所盛装的主要物质,请从(1)的选项中找出其对应的主要工作原理。
①冰 ②硝酸铵+水 ③硝酸铵+水合碳酸钠
①②③对应的主要工作原理依次是
(3)冬天使用的“热敷袋”是利用原电池原理产生热量,主要成分是铁屑、碳粉和少量的NaCl、水等。“热敷袋”在启用前用塑料袋使之与空气隔绝;启用时打开塑料袋轻轻揉搓,就会放出热量。碳粉的作用是
(4)某化学兴趣小组的同学为了探究铝电极在电池中的作用,设计并进行了以下一组实验,实验结果记录如下:
编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
1 | Mg、Al | 稀盐酸 | 偏向Al |
2 | Mg、Al | NaOH溶液 | 偏向Mg |
(5)

美国阿波罗宇宙飞船上使用了一种新型装置,其构造如上图所示。A、B两个电极均由多孔的碳块组成。该电池的正极反应式为
您最近一年使用:0次



