某课外活动小组设计了下列装置,验证二氧化碳跟过氧化的反应时需要与水接触。
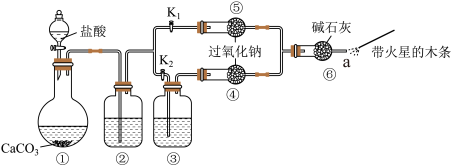
【装置分析】
(1)装置②中的试剂是___________ (填序号);装置③中的试剂是___________ (填序号)。
a.饱和NaHCO3溶液 b.饱和Na2CO3溶液 c.浓H2SO4
【进行实验】
步骤1:打开弹簧夹K2,关闭K1,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处;
步骤2:打开弹簧夹K1,关闭K2,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
(2)步骤1和步骤2中,a处带火星的木条产生的实验现象分别是________ 、________ 。
(3)用双线桥表示过氧化钠与二氧化碳反应的电子转移情况___________ 。
【实验反思】
(4)有同学提出质疑:“上述实验不足以证明有水存在时过氧化钠与二氧化碳发生了化学反应。”其理由是___________ 。
(5)需要补充的实验操作是:取⑤中反应后的少量固体后,___________ 。
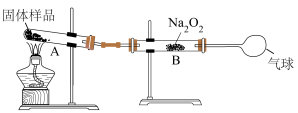
(6)侯氏制碱得到的碳酸钠产品中会含少量碳酸氢钠。某兴趣小组称量10.0g固体样品,利用下图装置测定产品纯度,装置A中生成的CO2和H2O被B中的Na2O2全部吸收后,测得Na2O2增重0.3g,该碳酸钠产品的纯度为___________ %。

【装置分析】
(1)装置②中的试剂是
a.饱和NaHCO3溶液 b.饱和Na2CO3溶液 c.浓H2SO4
【进行实验】
步骤1:打开弹簧夹K2,关闭K1,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处;
步骤2:打开弹簧夹K1,关闭K2,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
(2)步骤1和步骤2中,a处带火星的木条产生的实验现象分别是
(3)用双线桥表示过氧化钠与二氧化碳反应的电子转移情况
【实验反思】
(4)有同学提出质疑:“上述实验不足以证明有水存在时过氧化钠与二氧化碳发生了化学反应。”其理由是
(5)需要补充的实验操作是:取⑤中反应后的少量固体后,
(6)侯氏制碱得到的碳酸钠产品中会含少量碳酸氢钠。某兴趣小组称量10.0g固体样品,利用下图装置测定产品纯度,装置A中生成的CO2和H2O被B中的Na2O2全部吸收后,测得Na2O2增重0.3g,该碳酸钠产品的纯度为

更新时间:2023-11-30 17:24:41
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】菠菜具有丰富的营养。民间流传:菠菜与豆腐不宜同时食用。
资料:(1)菠菜中含有可溶性草酸盐、碳酸盐等
(2)醋酸不与草酸钙反应
(3)某草酸钙晶体(CaC2O4·xH2O)的相对分子质量为128+18x
【实验一】菠菜中部分成分分析

(1)用开水煮沸菠菜样品碎末2~3 min的目的是_________________________ 。
(2)溶液M中含有的主要阴离子有______________________________________ 。
(3)已知C能使澄清石灰水变浑浊。A与醋酸生成C的化学方程式是__________________________________________ 。
(4)B的化学式可能是__________________________________________ 。
(5)草酸比碳酸的酸性_________________________ (填“强”或“弱”)。
【实验二】对某草酸钙晶体进行热分解研究,得到相关数据如图所示。

(1)800℃时得到的固体只含钙元素和氧元素,质量比为5:2,其化学式是__________ 。
(2)固体质量由12.8 g变为10.0 g的过程中发生反应的化学方程式是_______________ 。
(3)x=_______________ 。
资料:(1)菠菜中含有可溶性草酸盐、碳酸盐等
(2)醋酸不与草酸钙反应
(3)某草酸钙晶体(CaC2O4·xH2O)的相对分子质量为128+18x
【实验一】菠菜中部分成分分析

(1)用开水煮沸菠菜样品碎末2~3 min的目的是
(2)溶液M中含有的主要阴离子有
(3)已知C能使澄清石灰水变浑浊。A与醋酸生成C的化学方程式是
(4)B的化学式可能是
(5)草酸比碳酸的酸性
【实验二】对某草酸钙晶体进行热分解研究,得到相关数据如图所示。

(1)800℃时得到的固体只含钙元素和氧元素,质量比为5:2,其化学式是
(2)固体质量由12.8 g变为10.0 g的过程中发生反应的化学方程式是
(3)x=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某课外小组研究铝土矿中Al2O3的含量。已知铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
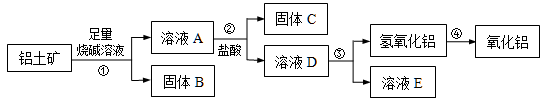
(1)固体B的主要用途有(写出1条即可)________________。
(2)第①步,向铝土矿中加入足量烧碱溶液后,发生反应的离子方程式是 ; ;
第③步中,生成氢氧化铝的化学方程式是 。
(3)将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是_______。(保留一位小数)
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5 mol碳单质,转移1mol电子,反应的化学方程式是 。

(1)固体B的主要用途有(写出1条即可)________________。
(2)第①步,向铝土矿中加入足量烧碱溶液后,发生反应的离子方程式是 ; ;
第③步中,生成氢氧化铝的化学方程式是 。
(3)将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是_______。(保留一位小数)
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5 mol碳单质,转移1mol电子,反应的化学方程式是 。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】一种湿化学氧化法合成高铁酸钾(K2FeO4)的工艺流程如下:

实验室可利用如图所示装置制取K2FeO4 (夹持装置略):
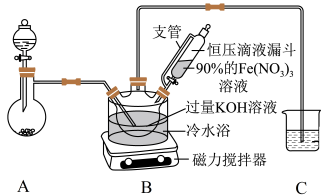
已知:K2FeO4可溶于水,在0~5℃的强碱性溶液中较稳定,酸性、弱碱性时易与水反应。
回答下列问题:
(1)用高锰酸钾固体与浓盐酸通过装置A制氯气时,盛放高锰酸钾的仪器名称为_______ ,装置C中的试剂为_______ 。
(2)上述装置存在一处缺陷,会导致K2FeO4产率降低,改进的方法是_______ 。
(3)装置B中首先制备KClO,然后在剧烈搅拌下将90%的Fe(NO3)3分批加入装置B中,充分反应可得K2FeO4溶液,该反应的化学方程式为_______ ;为了更好地析出K2FeO4,“冷却结晶”时继续补加适量的KOH,作用是_______ 。
(4)流程中“洗涤、干燥”时用无水乙醇洗涤,主要原因是_______ 。
(5)对制得的产品进行定量分析时发生的反应有:



称取2.0g制得的K2FeO4产品溶于适量KOH溶液中,加入足量KCrO2,充分反应后过滤,将滤液转移到250mL容量瓶定容。取25.00mL定容后的溶液于锥形瓶,加入稀硫酸酸化,滴加几滴二苯胺磺酸钠做指示剂,用0.1mol∙L-1 (NH4)2FeSO4标准溶液滴定,终点由紫色变为绿色,重复操作2次,平均消耗(NH4)2FeSO4溶液的体积为26.00mL。则标准液应选用_______ (填“酸式”或“碱式”)滴定管盛放,该K2FeO4样品的纯度为_______ %。

实验室可利用如图所示装置制取K2FeO4 (夹持装置略):

已知:K2FeO4可溶于水,在0~5℃的强碱性溶液中较稳定,酸性、弱碱性时易与水反应。
回答下列问题:
(1)用高锰酸钾固体与浓盐酸通过装置A制氯气时,盛放高锰酸钾的仪器名称为
(2)上述装置存在一处缺陷,会导致K2FeO4产率降低,改进的方法是
(3)装置B中首先制备KClO,然后在剧烈搅拌下将90%的Fe(NO3)3分批加入装置B中,充分反应可得K2FeO4溶液,该反应的化学方程式为
(4)流程中“洗涤、干燥”时用无水乙醇洗涤,主要原因是
(5)对制得的产品进行定量分析时发生的反应有:



称取2.0g制得的K2FeO4产品溶于适量KOH溶液中,加入足量KCrO2,充分反应后过滤,将滤液转移到250mL容量瓶定容。取25.00mL定容后的溶液于锥形瓶,加入稀硫酸酸化,滴加几滴二苯胺磺酸钠做指示剂,用0.1mol∙L-1 (NH4)2FeSO4标准溶液滴定,终点由紫色变为绿色,重复操作2次,平均消耗(NH4)2FeSO4溶液的体积为26.00mL。则标准液应选用
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
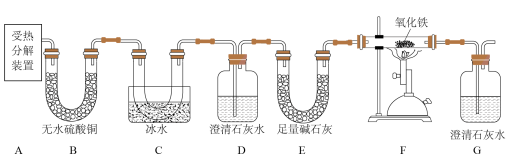
【推荐1】草酸是生产、生活中常用的漂白剂,可用于生产抗菌素,可作为提炼稀有气体的溶剂。兴趣小组对草酸受热分解的产物进行如下探究:
【查阅资料】
①草酸( )是一种酸,熔点为101.5℃,易溶于水,易升华,170℃以上分解。
)是一种酸,熔点为101.5℃,易溶于水,易升华,170℃以上分解。
②草酸钙难溶于水。
③无水硫酸铜遇水变蓝。
③碱石灰是生石灰与烧碱的混合固体,能吸收 和
和
【实验过程】
同学们在老师的指导下设计了如图所示装置,并进行实验(部分夹持仪器已略去)。
(1)草酸受热分解,应选择图中的______ (填“甲”或“乙”)装置。
(2)实验过程中应该先点燃______ (填“酒精灯”或“酒精喷灯”)。
(3)F装置中反应的化学方程式为______ 。
(4)实验过程中观察到B中白色固体变成蓝色,D中澄清石灰水变浑浊,______ ,则可以证明草酸分解产物为 、
、 和CO。
和CO。
(5)从环保角度考虑,该套装置的明显缺陷是______ 。
【查阅资料】
①草酸(
 )是一种酸,熔点为101.5℃,易溶于水,易升华,170℃以上分解。
)是一种酸,熔点为101.5℃,易溶于水,易升华,170℃以上分解。②草酸钙难溶于水。
③无水硫酸铜遇水变蓝。
③碱石灰是生石灰与烧碱的混合固体,能吸收
 和
和
【实验过程】
同学们在老师的指导下设计了如图所示装置,并进行实验(部分夹持仪器已略去)。
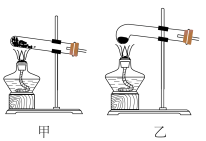
(1)草酸受热分解,应选择图中的
(2)实验过程中应该先点燃
(3)F装置中反应的化学方程式为
(4)实验过程中观察到B中白色固体变成蓝色,D中澄清石灰水变浑浊,
 、
、 和CO。
和CO。(5)从环保角度考虑,该套装置的明显缺陷是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】某化学兴趣小组为探究铜跟浓硫酸的反应,如图所示装置进行有关实验。请回答下列问题:
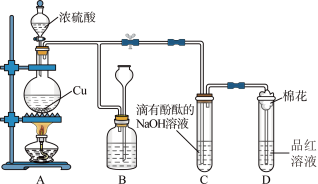
(1)A中盛放浓硫酸的仪器名称是___________ 。装置A中发生的化学反应的化学方程式为___________ ;
(2)装置B的作用是贮存多余的气体,B中广口瓶内应盛放的液体是___________ (填序号)
①水 ②酸性KMnO4③Na2SO3溶液 ④饱和的NaHSO3溶液
(3)装置C和D中产生的现象相同,但原因却不同。C中反应的离子方程式为___________ ,而D中则是由于SO2具有___________ 。
(4)装置D中试管口塞一团棉花,棉花中应浸有一种液体,这种液体是___________ ,其作用是___________ 。
(5)若实验中用7.2g铜片和12.5mL18.5mol/L的浓硫酸在加热条件下充分反应,最终铜片仍有剩余。下列试剂中能够证明反应结束后烧瓶中确有余酸的是___________。(填序号)

(1)A中盛放浓硫酸的仪器名称是
(2)装置B的作用是贮存多余的气体,B中广口瓶内应盛放的液体是
①水 ②酸性KMnO4③Na2SO3溶液 ④饱和的NaHSO3溶液
(3)装置C和D中产生的现象相同,但原因却不同。C中反应的离子方程式为
(4)装置D中试管口塞一团棉花,棉花中应浸有一种液体,这种液体是
(5)若实验中用7.2g铜片和12.5mL18.5mol/L的浓硫酸在加热条件下充分反应,最终铜片仍有剩余。下列试剂中能够证明反应结束后烧瓶中确有余酸的是___________。(填序号)
| A.铁粉 | B.BaCl2溶液 | C.银粉 | D.Na2CO3溶液 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】某化学兴趣小组,拟探究和比较SO2和C12的化学性质,设计如图所示的实验装置二套。请你参与探究并回答下列问题。
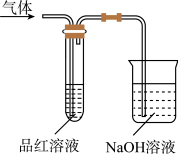
(1)向第一套装置中通入一段时间的SO2,观察到试管中的品红溶液________ (填“褪色”或“不褪色”),然后再加热试管,溶液________ (填“恢复”或“不恢复”)红色;
(2)向第二套装置中通入一段时间的C12,观察到试管中的品红溶液也褪色,然后再加热试管,溶液_________ ,(填“恢复”或“不恢复”)红色;
(3)由以上两个实验可以说明SO2和C12的漂白原理________ (填“相同”或“不相同”)。 完成化学方程式C12 + H2O ==_______________________ 。

(1)向第一套装置中通入一段时间的SO2,观察到试管中的品红溶液
(2)向第二套装置中通入一段时间的C12,观察到试管中的品红溶液也褪色,然后再加热试管,溶液
(3)由以上两个实验可以说明SO2和C12的漂白原理
您最近一年使用:0次



