Ⅰ.现用 固体配制100mL 0.1mol/L
固体配制100mL 0.1mol/L 溶液,可供选择的仪器有:玻璃棒、烧杯、电子天平、药匙、量筒、胶头滴管。回答下列问题:
溶液,可供选择的仪器有:玻璃棒、烧杯、电子天平、药匙、量筒、胶头滴管。回答下列问题:
(1)上述仪器中,还缺少的定量仪器是___________ 。
(2)经计算,需称取 固体质量为
固体质量为___________ g.
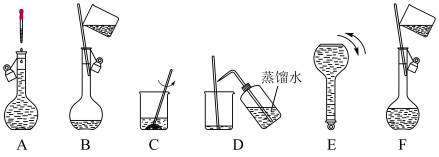
(3)将图中的实验步骤A~F按实验过程先后次序排列___→B→___→F→__→___;___________ 。
(4)将所配制的 溶液进行测定,发现浓度偏大,可能的原因是
溶液进行测定,发现浓度偏大,可能的原因是___________ 。
a.称量的 固体有杂质
固体有杂质
b.称量的 固体已经部分失去结晶水
固体已经部分失去结晶水
c.转移时没有洗涤烧杯和玻璃棒
d.定容时,加蒸馏水未到刻度线就停止滴加蒸馏水
(5)下列溶液中,与100mL 0.1mol/L 溶液中的
溶液中的 物质的量浓度相同的是
物质的量浓度相同的是______ 。
a.200mL 0.05mol/L 溶液 b.200mL 0.1mol/L NaCl溶液
溶液 b.200mL 0.1mol/L NaCl溶液
c.300mL 0.1mol/L 溶液 d.100mL 0.2mol/L NaOH溶液
溶液 d.100mL 0.2mol/L NaOH溶液
Ⅱ.回答下列问题:
(6)标准状况下,88g 的体积为
的体积为___________ L。
(7)___________ g 中的H原子数目与3mol
中的H原子数目与3mol 中的H原子数目相同。
中的H原子数目相同。
 固体配制100mL 0.1mol/L
固体配制100mL 0.1mol/L 溶液,可供选择的仪器有:玻璃棒、烧杯、电子天平、药匙、量筒、胶头滴管。回答下列问题:
溶液,可供选择的仪器有:玻璃棒、烧杯、电子天平、药匙、量筒、胶头滴管。回答下列问题:(1)上述仪器中,还缺少的定量仪器是
(2)经计算,需称取
 固体质量为
固体质量为(3)将图中的实验步骤A~F按实验过程先后次序排列___→B→___→F→__→___;

(4)将所配制的
 溶液进行测定,发现浓度偏大,可能的原因是
溶液进行测定,发现浓度偏大,可能的原因是a.称量的
 固体有杂质
固体有杂质b.称量的
 固体已经部分失去结晶水
固体已经部分失去结晶水c.转移时没有洗涤烧杯和玻璃棒
d.定容时,加蒸馏水未到刻度线就停止滴加蒸馏水
(5)下列溶液中,与100mL 0.1mol/L
 溶液中的
溶液中的 物质的量浓度相同的是
物质的量浓度相同的是a.200mL 0.05mol/L
 溶液 b.200mL 0.1mol/L NaCl溶液
溶液 b.200mL 0.1mol/L NaCl溶液c.300mL 0.1mol/L
 溶液 d.100mL 0.2mol/L NaOH溶液
溶液 d.100mL 0.2mol/L NaOH溶液Ⅱ.回答下列问题:
(6)标准状况下,88g
 的体积为
的体积为(7)
 中的H原子数目与3mol
中的H原子数目与3mol 中的H原子数目相同。
中的H原子数目相同。
更新时间:2023-12-04 22:29:18
|
相似题推荐
计算题
|
适中
(0.65)
名校
解题方法
【推荐1】今年我国多个城市遭遇雾霾天气,这表明污染严重,空气质量下降。因此研究NO2、SO2、CO等大气污染气体的处理具有重要现实意义。
(1)NO2可用水吸收,相应的化学反应方程式为___________ 。
(2)利用反应6NO2+8NH3 7N2+12H2O也可处理NO2,当转移2.4 mol电子时,消耗的NO2在标准状况下的体积是
7N2+12H2O也可处理NO2,当转移2.4 mol电子时,消耗的NO2在标准状况下的体积是___________ L。
(3)3.2 g Cu与30 mL8 mol·L-1HNO3反应,硝酸的还原产物为NO,NO2,反应后溶液中所含H+为0.1 mol,则:
①溶液中n( )为
)为___________ mol。
②所生成的NO在标准状况下体积为___________ L。
(4)有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是3 mol·L-1和1 mol·L-1,取100 mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的气体的体积为___________ L(设反应中HNO3被还原成NO)。
(1)NO2可用水吸收,相应的化学反应方程式为
(2)利用反应6NO2+8NH3
 7N2+12H2O也可处理NO2,当转移2.4 mol电子时,消耗的NO2在标准状况下的体积是
7N2+12H2O也可处理NO2,当转移2.4 mol电子时,消耗的NO2在标准状况下的体积是(3)3.2 g Cu与30 mL8 mol·L-1HNO3反应,硝酸的还原产物为NO,NO2,反应后溶液中所含H+为0.1 mol,则:
①溶液中n(
 )为
)为②所生成的NO在标准状况下体积为
(4)有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是3 mol·L-1和1 mol·L-1,取100 mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的气体的体积为
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐2】社会实践活动中,课外兴趣小组对某钢铁厂的铁矿石样品和钢样进行实验、分析、计算,了解了该钢铁厂生产原料、产品的相关信息。下面请你根据他们的实验帮助计算回答:
取该厂的某钢样粉末28.36 g(假设只含Fe和C),在氧气流中充分反应,将产生的气体通入足量的澄清石灰水中,得到3 g白色沉淀。
(1)计算此钢样粉末中铁和碳的质量之比。
(2)再取三份不同质量的钢样粉末分别加到50 g质量分数相同的硫酸中,充分反应后,测得的实验数据如下表所示:(标准状况下,2 g H2的体积为22.4 L)
请根据表中数据计算硫酸中H2SO4的质量分数。
(3)若在实验Ⅱ中继续加入m g钢样粉末,计算反应结束后剩余的固体质量为多少? (用含m的代数式表示)
取该厂的某钢样粉末28.36 g(假设只含Fe和C),在氧气流中充分反应,将产生的气体通入足量的澄清石灰水中,得到3 g白色沉淀。
(1)计算此钢样粉末中铁和碳的质量之比。
(2)再取三份不同质量的钢样粉末分别加到50 g质量分数相同的硫酸中,充分反应后,测得的实验数据如下表所示:(标准状况下,2 g H2的体积为22.4 L)
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入钢样粉末的质量 / g | 2.836 | 5.672 | 8.508 |
| 生成气体的体积(标准状况)/ L | 1.12 | 2.24 | 2.80 |
请根据表中数据计算硫酸中H2SO4的质量分数。
(3)若在实验Ⅱ中继续加入m g钢样粉末,计算反应结束后剩余的固体质量为多少? (用含m的代数式表示)
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐1】现从固体KOH出发配制0.1mol/L 的KOH溶液 500mL,回答下列问题:
(1)配制过程中需要用到的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、___________
(2)如果在定容时仰视操作,则所配得溶液的浓度_______ 0.1mol/L(填> , =" ," <)
(3)若所用的固体KOH中混有NaOH,则所配得溶液的OH-浓度___ 0.1mol/L(填> , =" ," <)
(4)若用250mL的H2SO4溶液恰好能将此500mL 0.1mol/L 的KOH溶液中和,则该硫酸的物质的量浓度为________ mol/L
(1)配制过程中需要用到的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、
(2)如果在定容时仰视操作,则所配得溶液的浓度
(3)若所用的固体KOH中混有NaOH,则所配得溶液的OH-浓度
(4)若用250mL的H2SO4溶液恰好能将此500mL 0.1mol/L 的KOH溶液中和,则该硫酸的物质的量浓度为
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐2】回答下列问题:
(1)19 g某二价金属氯化物(ACl2)中含有0.4 molCl−,则ACl2的摩尔质量是____ g/mol;ACl2的化学式是_____ 。
(2)配制480 mL 0.1mol/L的硫酸铜溶液,需用托盘天平称取CuSO4·5H2O____ g;在配制过程中,若其它操作均正确,则下列操作会使所配溶液物质的量浓度偏低的是_________ (填字母序号)。
A.溶解后小烧杯、玻璃棒没有洗涤
B.所用容量瓶中,已有少量蒸馏水
C.定容、加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度线
D.定容时俯视刻度线
(3)将适量铁粉加到三氯化铁溶液中,完全反应后,溶液中的Fe3+和Fe2+浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是______ 。
(1)19 g某二价金属氯化物(ACl2)中含有0.4 molCl−,则ACl2的摩尔质量是
(2)配制480 mL 0.1mol/L的硫酸铜溶液,需用托盘天平称取CuSO4·5H2O
A.溶解后小烧杯、玻璃棒没有洗涤
B.所用容量瓶中,已有少量蒸馏水
C.定容、加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度线
D.定容时俯视刻度线
(3)将适量铁粉加到三氯化铁溶液中,完全反应后,溶液中的Fe3+和Fe2+浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐1】在花瓶中加入“鲜花保鲜剂”可延长鲜花的寿命。下表是1 L“鲜花保鲜剂”的成分,阅读后回答下列问题:
(1)阿司匹林的相对分子质量为______ 。蔗糖的物质的量为______ mol。
(2)1 L“鲜花保鲜剂”中K+的物质的量浓度为(蔗糖、阿司匹林中不含K+)______ mol·L-1。
(3)使用时应将“鲜花保鲜剂”稀释至20倍后使用,稀释后c(AgNO3)=______ mol·L-1(用科学记数法表示)。
(4)配制1 L上述“鲜花保鲜剂”过程中,下列操作使配制浓度偏低的是______ 。
A.容量瓶在使用前未干燥,里面有少量蒸馏水
B.定容时仰视
C.用蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液倒入废液缸中,防止污染环境
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(5)高锰酸钾的作用除了做钾肥外,还有消毒杀菌的作用,说明高锰酸钾具有______ 性。已知氯气也是常用消毒剂,“鲜花保鲜剂”中高锰酸钾的消毒效率(消毒效率是指单位质量的消毒剂得电子数的多少,KMnO4被还原为Mn2+)相当于氯气的______ 倍。(保留1位小数)
| 成分 | 质量/g | 摩尔质量/(g·mol-1) |
| 蔗糖 | 85.50 | 342 |
| 硫酸钾 | 0.87 | 174 |
| 阿司匹林 | 0.35 | 180 |
| 高锰酸钾 | 1.58 | 158 |
| 硝酸银 | 0.034 | 170 |
(2)1 L“鲜花保鲜剂”中K+的物质的量浓度为(蔗糖、阿司匹林中不含K+)
(3)使用时应将“鲜花保鲜剂”稀释至20倍后使用,稀释后c(AgNO3)=
(4)配制1 L上述“鲜花保鲜剂”过程中,下列操作使配制浓度偏低的是
A.容量瓶在使用前未干燥,里面有少量蒸馏水
B.定容时仰视
C.用蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液倒入废液缸中,防止污染环境
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(5)高锰酸钾的作用除了做钾肥外,还有消毒杀菌的作用,说明高锰酸钾具有
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐2】每年10月23日上午6∶02到晚上6∶02被誉为“摩尔日”(MoleDay),这个时间的美式写法为6:0210/23,外观与阿伏加德罗常数相似。
(1)amol H2SO4中含有b个氧原子,则阿伏加德罗常数可以表示为___________  。
。
(2)某固体A在一定条件下加热分解,产物全是气体,A的分解反应为: 。现测得分解产生的混合气体对氢气的相对密度为8,则A的摩尔质量为
。现测得分解产生的混合气体对氢气的相对密度为8,则A的摩尔质量为___________  。
。
(3)由CH4和O2组成的混合气体在同温、同压下与CO的密度相同,则混合气体中CH4的体积分数为___________ 。
(4)在某温度时,一定量的元素A的氢化物AH3,在恒温恒压的密闭容器中完全分解为两种气态单质,此时容器的体积变为原来的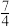 ,则A单质的分子式为
,则A单质的分子式为___________ 。
(5)实验室需配制 溶液,下列叙述中正确的是___________。
溶液,下列叙述中正确的是___________。
(6)某溶液中只含有 、
、 、
、 、
、 等四种离子,它们的物质的量之比为1:6:3:2,该溶液所含的溶质可能是___________。
等四种离子,它们的物质的量之比为1:6:3:2,该溶液所含的溶质可能是___________。
(7)4g下列金属混合物与氯气反应后质量增加7.1g,这种元素是___________。
(1)amol H2SO4中含有b个氧原子,则阿伏加德罗常数可以表示为
 。
。(2)某固体A在一定条件下加热分解,产物全是气体,A的分解反应为:
 。现测得分解产生的混合气体对氢气的相对密度为8,则A的摩尔质量为
。现测得分解产生的混合气体对氢气的相对密度为8,则A的摩尔质量为 。
。(3)由CH4和O2组成的混合气体在同温、同压下与CO的密度相同,则混合气体中CH4的体积分数为
(4)在某温度时,一定量的元素A的氢化物AH3,在恒温恒压的密闭容器中完全分解为两种气态单质,此时容器的体积变为原来的
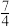 ,则A单质的分子式为
,则A单质的分子式为(5)实验室需配制
 溶液,下列叙述中正确的是___________。
溶液,下列叙述中正确的是___________。| A.容量瓶上标有温度、容积和浓度 |
| B.定容时若俯视刻度线观察液面,会使所配制的NaOH溶液的浓度偏高 |
| C.转移液体时,玻璃棒应紧靠容量瓶口 |
| D.用电子天平称量20gNaOH固体 |
 、
、 、
、 、
、 等四种离子,它们的物质的量之比为1:6:3:2,该溶液所含的溶质可能是___________。
等四种离子,它们的物质的量之比为1:6:3:2,该溶液所含的溶质可能是___________。| A.KNO3、Na2SO4 | B.K2SO4、NaNO3、KNO3 |
| C.KNO3、Na2SO4、NaNO3 | D.K2SO4、Na2SO4、KNO3 |
| A.Na和Fe | B.Mg和Fe | C.Al和Cu | D.Zn和Cu |
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐3】按要求完成。
(1)19.6克硫酸是___________ molH2SO4,含有___________ 个原子,1.7克NH3在同温同压下与___________ 克H2S气体含有的氢原子数相同。
(2)标准状况下,密度为0.75g/L的NH3与CH4组成的混合气体中,NH3的体积分数___________ ,混合气体的平均摩尔质量为___________ 该气体对氢气的相对密度为___________ 。
(3)已知Wg气体A含有a个分子,那么在标准状况下,bg气体A所占的体积是___________ (其中阿伏加德罗常数用NA表示)。
(4)将MgCl2·xH2O的晶体4.06g溶于水配成100mL溶液,取出50mL溶液正好与0.02moL的AgNO3溶液完全作用,4.06g的MgCl2·xH2O物质的量为___________ 式中x的数值___________ 。
(5)配制100mL1mol·L-1的稀H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84g·mL-1,质量分数为98%)的体积为___________ mL。
(6)现要配制1mol·L-1Na2CO3溶液250mL
①需要含结晶水的碳酸钠晶体(Na2CO3·10H2O)___________ g;
②在配制上述溶液的过程中,可能导致配制溶液浓度偏小的有___________
A.固体Na2CO3·10H2O放在右盘(1g以下用游码);
B.容量瓶用碳酸钠溶液先润洗;
C.转移溶液时未洗涤烧杯
D.定容时溶液未冷却;
E.定容时视线仰视;
F.摇匀时,发现液面低于容量瓶刻度线,但未补加水;
G.容量瓶未干燥。
(1)19.6克硫酸是
(2)标准状况下,密度为0.75g/L的NH3与CH4组成的混合气体中,NH3的体积分数
(3)已知Wg气体A含有a个分子,那么在标准状况下,bg气体A所占的体积是
(4)将MgCl2·xH2O的晶体4.06g溶于水配成100mL溶液,取出50mL溶液正好与0.02moL的AgNO3溶液完全作用,4.06g的MgCl2·xH2O物质的量为
(5)配制100mL1mol·L-1的稀H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84g·mL-1,质量分数为98%)的体积为
(6)现要配制1mol·L-1Na2CO3溶液250mL
①需要含结晶水的碳酸钠晶体(Na2CO3·10H2O)
②在配制上述溶液的过程中,可能导致配制溶液浓度偏小的有
A.固体Na2CO3·10H2O放在右盘(1g以下用游码);
B.容量瓶用碳酸钠溶液先润洗;
C.转移溶液时未洗涤烧杯
D.定容时溶液未冷却;
E.定容时视线仰视;
F.摇匀时,发现液面低于容量瓶刻度线,但未补加水;
G.容量瓶未干燥。
您最近一年使用:0次



