甲醇是一种重要的化工原料,具有开发和应用的广阔前景。工业上使用水煤气(CO与 的混合气体)转化成甲醇
的混合气体)转化成甲醇 。
。
(1)CO的平衡转化率与温度、压强的关系如图所示。
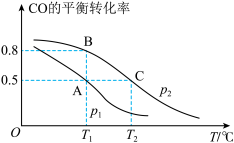
①当CO气体与 生成
生成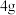 甲醇气体时,放出的
甲醇气体时,放出的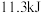 的热量,写出该反应的热化学反应方程式
的热量,写出该反应的热化学反应方程式___________ 。该反应在___________ (“高温”“低温”、任何温度)自发进行。
② 、
、 的大小关系是
的大小关系是
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③A、B、C三点的平衡常数 、
、 、
、 的大小关系是
的大小关系是___________ 。
④下列叙述能说明上述反应能达到化学平衡状态的是___________ (填字母)。
a.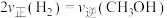
b. 的体积分数不再改变
的体积分数不再改变
c.混合气体的平均摩尔质量不再改变
d.同一时间内,消耗 ,生成
,生成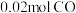
(2)在 ℃、
℃、 压强时,往一容积为
压强时,往一容积为 的密闭容器内,充入
的密闭容器内,充入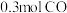 与
与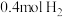 发生反应。
发生反应。
①平衡时 的体积分数是
的体积分数是___________ 。
②若 压强恒定为p,则平衡常数
压强恒定为p,则平衡常数
___________ ( 用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,整理出含p的最简表达式)。
用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,整理出含p的最简表达式)。
 的混合气体)转化成甲醇
的混合气体)转化成甲醇 。
。(1)CO的平衡转化率与温度、压强的关系如图所示。

①当CO气体与
 生成
生成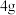 甲醇气体时,放出的
甲醇气体时,放出的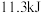 的热量,写出该反应的热化学反应方程式
的热量,写出该反应的热化学反应方程式②
 、
、 的大小关系是
的大小关系是
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。③A、B、C三点的平衡常数
 、
、 、
、 的大小关系是
的大小关系是④下列叙述能说明上述反应能达到化学平衡状态的是
a.
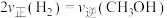
b.
 的体积分数不再改变
的体积分数不再改变c.混合气体的平均摩尔质量不再改变
d.同一时间内,消耗
 ,生成
,生成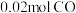
(2)在
 ℃、
℃、 压强时,往一容积为
压强时,往一容积为 的密闭容器内,充入
的密闭容器内,充入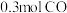 与
与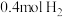 发生反应。
发生反应。①平衡时
 的体积分数是
的体积分数是②若
 压强恒定为p,则平衡常数
压强恒定为p,则平衡常数
 用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,整理出含p的最简表达式)。
用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,整理出含p的最简表达式)。
更新时间:2023-12-28 20:43:30
|
相似题推荐
解答题-工业流程题
|
较易
(0.85)
名校
解题方法
【推荐1】完成下列问题。
(1)节能减排是当今社会的热门话题,研发混合动力汽车对于中国汽车业的未来具有重要的战略意义。混合动力汽车持续工作时间长,动力性好的优点,无污染、低噪声的好处,汽车的热效率可提高10%以上,废气排放可改善30%以上,某种混合动力汽车的动力系统由“1.6L汽油机+自动变速器+20kW+200V镍氢电池”组成。
①混合动力汽车所用的燃料之一是乙醇,lg乙醇完全燃烧生成CO2气体和液态H2O放出30.0kJ热量,写出乙醇燃烧的燃烧热的热化学方程式_______ 。
②镍氢电池的使用可以减少对环境的污染,它采用储氢金属为负极,碱液NaOH为电解液,镍氢电池充电时发生反应Ni(OH)2=NiO(OH)+ H2。其放电时的正极的电极反应方程式为
H2。其放电时的正极的电极反应方程式为_______ 。
(2)二氧化锰、锌是制备干电池的重要原料,工业上用软锰矿(含MnO2)和闪锌矿(含ZnS)联合生产二氧化锰、锌的工艺如下:
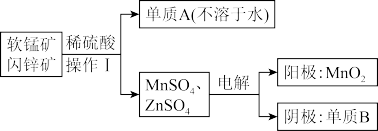
①操作I需要的玻璃仪器是_______ 。
②软锰矿(含MnO2)和闪锌矿与硫酸反应的化学方程式为_______ ,上述电解过程中,当阴极生成6.5gB时,阳极生成的MnO2的质量为_______ 。
③利用铝热反应原理,可以从软锰矿中提取锰,发生的化学方程式为_______ 。
(1)节能减排是当今社会的热门话题,研发混合动力汽车对于中国汽车业的未来具有重要的战略意义。混合动力汽车持续工作时间长,动力性好的优点,无污染、低噪声的好处,汽车的热效率可提高10%以上,废气排放可改善30%以上,某种混合动力汽车的动力系统由“1.6L汽油机+自动变速器+20kW+200V镍氢电池”组成。
①混合动力汽车所用的燃料之一是乙醇,lg乙醇完全燃烧生成CO2气体和液态H2O放出30.0kJ热量,写出乙醇燃烧的燃烧热的热化学方程式
②镍氢电池的使用可以减少对环境的污染,它采用储氢金属为负极,碱液NaOH为电解液,镍氢电池充电时发生反应Ni(OH)2=NiO(OH)+
 H2。其放电时的正极的电极反应方程式为
H2。其放电时的正极的电极反应方程式为(2)二氧化锰、锌是制备干电池的重要原料,工业上用软锰矿(含MnO2)和闪锌矿(含ZnS)联合生产二氧化锰、锌的工艺如下:

①操作I需要的玻璃仪器是
②软锰矿(含MnO2)和闪锌矿与硫酸反应的化学方程式为
③利用铝热反应原理,可以从软锰矿中提取锰,发生的化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐2】氨是人科学技术发史上的一项重大突,目前工业上用氢气和氨气直接合成氨。
(1)固氮一直是科学家致力研究的要课题,有关热力学数据如下:
常温下,大气固氮的倾向_______ 工业固氮(填“大于”或“小于”)
(2)N2(g)与H2(g) 反应的能量变化如图所示,则N2(g)与H2(g) 反应制备NH3(g) 的热化学方程式为:_______ ;

(3)T℃时,在2L恒容密闭容器中加入1.2mol N2和2mol H2模拟一定条件下工业固氮[N2(g)+3H2(g) 2NH3(g)],体系中n(NH3)随时间的变化如图所示;
2NH3(g)],体系中n(NH3)随时间的变化如图所示;

①前2分钟内的平均反应速率v(NH3)=_______ mol·L-1·min-1;
②有关工业固氮的说法正确的是_______ (选填序号) 。
A.使用化剂可提高反应物的转化率
B.循环使用N2、H2可提高NH3的产率
C.温度控制在500℃左右有利于反应向正方向行
D.增大压强有利于加快反应速率,所以压强大越好
③T℃时,该反应的平衡常数为_______ ;
(4)研究表明某些过渡金属催化剂可以加速氨气的分解,某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解的初始速率(单位: mmol/min)与化剂的对应关系如表所示。
在不同催化剂的催化作用下,氨气分解反应中的活化能最大的催化剂是 _______ (填化学式)
(1)固氮一直是科学家致力研究的要课题,有关热力学数据如下:
| 反应 | 大气固氮N2(g)+O2(g)  2NO(g) 2NO(g) | 工业固氮N2(g)+3H2(g)  2NH3(g) 2NH3(g) | ||||
| 温度/℃ | 25 | 2000 | 25 | 350 | 400 | 450 |
| 平衡常数K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.504 | 0.152 |
(2)N2(g)与H2(g) 反应的能量变化如图所示,则N2(g)与H2(g) 反应制备NH3(g) 的热化学方程式为:

(3)T℃时,在2L恒容密闭容器中加入1.2mol N2和2mol H2模拟一定条件下工业固氮[N2(g)+3H2(g)
 2NH3(g)],体系中n(NH3)随时间的变化如图所示;
2NH3(g)],体系中n(NH3)随时间的变化如图所示;
①前2分钟内的平均反应速率v(NH3)=
②有关工业固氮的说法正确的是
A.使用化剂可提高反应物的转化率
B.循环使用N2、H2可提高NH3的产率
C.温度控制在500℃左右有利于反应向正方向行
D.增大压强有利于加快反应速率,所以压强大越好
③T℃时,该反应的平衡常数为
(4)研究表明某些过渡金属催化剂可以加速氨气的分解,某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解的初始速率(单位: mmol/min)与化剂的对应关系如表所示。
| 催化剂 | Fe | Pd | Ru | Rh | Pt | Ni |
| 初始速率 | 0.5 | 1.8 | 7.9 | 4.0 | 2.2 | 3.0 |
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐3】I.50mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是___ ;
(2)烧杯间填满碎纸条的作用是___ ;
(3)用相同浓度和体积的氨水(NH3· H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会___ (填“偏大”、“偏小”或“无影响”)。
(4)实验中改用60mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量___ (填“相等”、“不相等”),所求中和热___ ,(填“相等”、“不相等”)。
Ⅱ.(1)已知充分燃烧一定质量的丁烷(C4H10)气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则表示丁烷燃烧热的热化学方程式为___ ;
(2)0.3mol的气态高能燃料乙硼烷(B2H6)在O2中燃烧,生成固态B2O3和液态水,放出649.5kJ的热量,其热化学方程式为___ 。

(1)从实验装置上看,图中尚缺少的一种玻璃用品是
(2)烧杯间填满碎纸条的作用是
(3)用相同浓度和体积的氨水(NH3· H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会
(4)实验中改用60mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量
Ⅱ.(1)已知充分燃烧一定质量的丁烷(C4H10)气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则表示丁烷燃烧热的热化学方程式为
(2)0.3mol的气态高能燃料乙硼烷(B2H6)在O2中燃烧,生成固态B2O3和液态水,放出649.5kJ的热量,其热化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
【推荐1】一定温度下,在2L的密闭容器中,M、N两种气体的物质的量随时间变化的曲线如图所示:

(1)反应的化学方程式为_______________ 。
(2)反应达到最大限度的时间是____ min,该时间内的平均反应速率 (N)=
(N)=____ 。
(3)反应达到平衡状态时,放出80kJ的热量,当容器中充入1mol N时,反应放出的热量为( ) (填序号)
A.等于10 kJ B.小于10 kJ C.大于10 kJ D.等于20 kJ
(4)判断该反应达到平衡状态的依据是( ) (填序号)
A.该条件下,正、逆反应速率都为零
B.该条件下,混合气体的密度不再发生变化
C.该条件下,混合气体的压强不再发生变化
D.条件下,单位时间内消耗2mol N的同时,生成1mol M
(5)能加快反应速率的措施是( ) (填序号)
A.升高温度 B.容器容积不变,充入惰性气体Ar
C.容器压强不变,充入惰性气体Ar D.使用催化剂

(1)反应的化学方程式为
(2)反应达到最大限度的时间是
 (N)=
(N)=(3)反应达到平衡状态时,放出80kJ的热量,当容器中充入1mol N时,反应放出的热量为
A.等于10 kJ B.小于10 kJ C.大于10 kJ D.等于20 kJ
(4)判断该反应达到平衡状态的依据是
A.该条件下,正、逆反应速率都为零
B.该条件下,混合气体的密度不再发生变化
C.该条件下,混合气体的压强不再发生变化
D.条件下,单位时间内消耗2mol N的同时,生成1mol M
(5)能加快反应速率的措施是
A.升高温度 B.容器容积不变,充入惰性气体Ar
C.容器压强不变,充入惰性气体Ar D.使用催化剂
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
【推荐2】 的回收与利用是科学家研究的热点课题,工业上有一种用
的回收与利用是科学家研究的热点课题,工业上有一种用 生产甲醇燃料的方法:
生产甲醇燃料的方法:
 kJ·mol
kJ·mol .将6 mol
.将6 mol  和8 mol
和8 mol  充入2 L的密闭容器中,测得的物质的量随时间变化如图所示(实线)。
充入2 L的密闭容器中,测得的物质的量随时间变化如图所示(实线)。
(1)已知
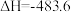 kJ·mol
kJ·mol .依据题中信息计算反应:
.依据题中信息计算反应: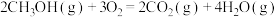

______ kJ·mol .
.
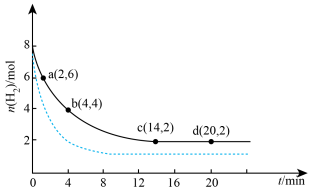
(2)a点正反应速率______ (填大于、等于或小于)逆反应速率,前4 min内,用 表示的平均反应速率为
表示的平均反应速率为______ mol·L ·min
·min 。
。
(3)平衡时氢气的转化率a=______ ,该条件下反应的平衡常数
______ 。
(4)二氧化碳催化加氢也可以合成乙烯,该反应是综合利用 的热点研究领域。
的热点研究领域。 催化加氢生成乙烯和水的反应中,产物的物质的量之比
催化加氢生成乙烯和水的反应中,产物的物质的量之比
______ 。当反应达到平衡时,若增大压强,则
______ (填“变大”“变小”或“不变”)。
 的回收与利用是科学家研究的热点课题,工业上有一种用
的回收与利用是科学家研究的热点课题,工业上有一种用 生产甲醇燃料的方法:
生产甲醇燃料的方法:
 kJ·mol
kJ·mol .将6 mol
.将6 mol  和8 mol
和8 mol  充入2 L的密闭容器中,测得的物质的量随时间变化如图所示(实线)。
充入2 L的密闭容器中,测得的物质的量随时间变化如图所示(实线)。(1)已知

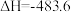 kJ·mol
kJ·mol .依据题中信息计算反应:
.依据题中信息计算反应: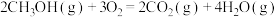

 .
.
(2)a点正反应速率
 表示的平均反应速率为
表示的平均反应速率为 ·min
·min 。
。(3)平衡时氢气的转化率a=

(4)二氧化碳催化加氢也可以合成乙烯,该反应是综合利用
 的热点研究领域。
的热点研究领域。 催化加氢生成乙烯和水的反应中,产物的物质的量之比
催化加氢生成乙烯和水的反应中,产物的物质的量之比

您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
【推荐3】废物再利用是一种环保行为,可以有效降低环境污染,同时又能达到资源的再利用。一种利用酸浸出法从冶金厂废炉渣中提取镍和钴的工艺流程如图:

已知:ⅰ.酸浸液中的金属阳离子有 、
、 、
、 、
、 、
、 等
等
ⅱ. 在水中的溶解度随温度升高而增大
在水中的溶解度随温度升高而增大
回答下列问题:
(1)提高“酸浸”速率的方法有___________ 。(任写一条)
(2)基态Fe原子价层电子的轨道表示式___________ 。Fe的晶胞结构如图所示,已知 表示阿伏加德罗常数的值,若晶胞参数为anm,则Fe晶胞的密度为
表示阿伏加德罗常数的值,若晶胞参数为anm,则Fe晶胞的密度为___________  (用含
(用含 和a的代数式表示)。
和a的代数式表示)。

(3)黄钠铁矾的化学式为 ,“除铁”的离子方程式为
,“除铁”的离子方程式为___________ 。
(4)“除钙镁”时,随pH降低,NaF用量急剧增加,原因是___________ (结合平衡理论解释)。
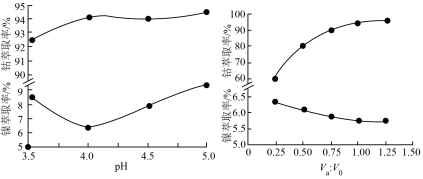
(5)镍、钴萃取率与料液pH、萃取剂体积与料液体积比 的关系曲线如图所示,则“萃取”时应选择的pH和
的关系曲线如图所示,则“萃取”时应选择的pH和 分别为
分别为___________ 、___________ 。
(6)获得 的“一系列操作”是
的“一系列操作”是___________ ,工艺流程中,可循环利用的物质是___________ 。

已知:ⅰ.酸浸液中的金属阳离子有
 、
、 、
、 、
、 、
、 等
等ⅱ.
 在水中的溶解度随温度升高而增大
在水中的溶解度随温度升高而增大回答下列问题:
(1)提高“酸浸”速率的方法有
(2)基态Fe原子价层电子的轨道表示式
 表示阿伏加德罗常数的值,若晶胞参数为anm,则Fe晶胞的密度为
表示阿伏加德罗常数的值,若晶胞参数为anm,则Fe晶胞的密度为 (用含
(用含 和a的代数式表示)。
和a的代数式表示)。
(3)黄钠铁矾的化学式为
 ,“除铁”的离子方程式为
,“除铁”的离子方程式为(4)“除钙镁”时,随pH降低,NaF用量急剧增加,原因是
(5)镍、钴萃取率与料液pH、萃取剂体积与料液体积比
 的关系曲线如图所示,则“萃取”时应选择的pH和
的关系曲线如图所示,则“萃取”时应选择的pH和 分别为
分别为
(6)获得
 的“一系列操作”是
的“一系列操作”是
您最近一年使用:0次



