氨是人科学技术发史上的一项重大突,目前工业上用氢气和氨气直接合成氨。
(1)固氮一直是科学家致力研究的要课题,有关热力学数据如下:
常温下,大气固氮的倾向_______ 工业固氮(填“大于”或“小于”)
(2)N2(g)与H2(g) 反应的能量变化如图所示,则N2(g)与H2(g) 反应制备NH3(g) 的热化学方程式为:_______ ;

(3)T℃时,在2L恒容密闭容器中加入1.2mol N2和2mol H2模拟一定条件下工业固氮[N2(g)+3H2(g) 2NH3(g)],体系中n(NH3)随时间的变化如图所示;
2NH3(g)],体系中n(NH3)随时间的变化如图所示;

①前2分钟内的平均反应速率v(NH3)=_______ mol·L-1·min-1;
②有关工业固氮的说法正确的是_______ (选填序号) 。
A.使用化剂可提高反应物的转化率
B.循环使用N2、H2可提高NH3的产率
C.温度控制在500℃左右有利于反应向正方向行
D.增大压强有利于加快反应速率,所以压强大越好
③T℃时,该反应的平衡常数为_______ ;
(4)研究表明某些过渡金属催化剂可以加速氨气的分解,某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解的初始速率(单位: mmol/min)与化剂的对应关系如表所示。
在不同催化剂的催化作用下,氨气分解反应中的活化能最大的催化剂是 _______ (填化学式)
(1)固氮一直是科学家致力研究的要课题,有关热力学数据如下:
| 反应 | 大气固氮N2(g)+O2(g)  2NO(g) 2NO(g) | 工业固氮N2(g)+3H2(g)  2NH3(g) 2NH3(g) | ||||
| 温度/℃ | 25 | 2000 | 25 | 350 | 400 | 450 |
| 平衡常数K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.504 | 0.152 |
(2)N2(g)与H2(g) 反应的能量变化如图所示,则N2(g)与H2(g) 反应制备NH3(g) 的热化学方程式为:

(3)T℃时,在2L恒容密闭容器中加入1.2mol N2和2mol H2模拟一定条件下工业固氮[N2(g)+3H2(g)
 2NH3(g)],体系中n(NH3)随时间的变化如图所示;
2NH3(g)],体系中n(NH3)随时间的变化如图所示;
①前2分钟内的平均反应速率v(NH3)=
②有关工业固氮的说法正确的是
A.使用化剂可提高反应物的转化率
B.循环使用N2、H2可提高NH3的产率
C.温度控制在500℃左右有利于反应向正方向行
D.增大压强有利于加快反应速率,所以压强大越好
③T℃时,该反应的平衡常数为
(4)研究表明某些过渡金属催化剂可以加速氨气的分解,某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解的初始速率(单位: mmol/min)与化剂的对应关系如表所示。
| 催化剂 | Fe | Pd | Ru | Rh | Pt | Ni |
| 初始速率 | 0.5 | 1.8 | 7.9 | 4.0 | 2.2 | 3.0 |
更新时间:2022-09-17 00:23:27
|
相似题推荐
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐1】氨在国民经济中占有重要地位。完成合成氨工业中有关问题。
(1)合成氨工业中,合成塔中每产生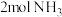 ,放出92.2kJ热量。
,放出92.2kJ热量。
①高温高压、催化剂条件下,工业合成氨的热化学方程式:______ 。
②若起始时向容器内放入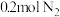 和
和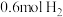 ,达到平衡后放出的热量为Q,则Q值
,达到平衡后放出的热量为Q,则Q值______ 18.44kJ(填“>”“=”或“<”)。
(2) 与
与 经过两步反应合成尿素(
经过两步反应合成尿素( ),两步反应的能量变化示意图如下:
),两步反应的能量变化示意图如下:
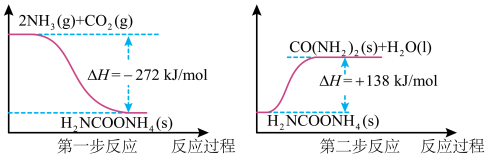
①则

______  。
。
②在一定温度和压强下,若①中的反应, 和
和 的物质的量之比(氨碳比)
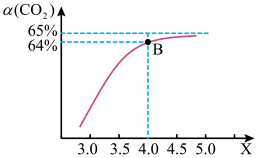
的物质的量之比(氨碳比) 。下图是氨碳比(x)与
。下图是氨碳比(x)与 平衡转化率(
平衡转化率( )的关系。
)的关系。 随着x增大而增大的原因:
随着x增大而增大的原因:____________ 。
③图中B点处, 的平衡转化率
的平衡转化率____________ 。
(3)将 和
和 各1mol充入一密闭容器中,在一定条件下发生合成氨反应。反应至平衡的过程中,
各1mol充入一密闭容器中,在一定条件下发生合成氨反应。反应至平衡的过程中, 的体积分数将
的体积分数将______ 。
a.一直减小 b.始终不变 c.一直增大 d.无法确定
(4)一定温度下,在容积固定的密闭容器中加入 、
、 ,发生反应:
,发生反应:
 ,下列能说明上述反应一定达到平衡状态的是______(填字母)。
,下列能说明上述反应一定达到平衡状态的是______(填字母)。
(1)合成氨工业中,合成塔中每产生
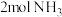 ,放出92.2kJ热量。
,放出92.2kJ热量。①高温高压、催化剂条件下,工业合成氨的热化学方程式:
②若起始时向容器内放入
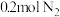 和
和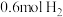 ,达到平衡后放出的热量为Q,则Q值
,达到平衡后放出的热量为Q,则Q值(2)
 与
与 经过两步反应合成尿素(
经过两步反应合成尿素( ),两步反应的能量变化示意图如下:
),两步反应的能量变化示意图如下:
①则


 。
。②在一定温度和压强下,若①中的反应,
 和
和 的物质的量之比(氨碳比)
的物质的量之比(氨碳比) 。下图是氨碳比(x)与
。下图是氨碳比(x)与 平衡转化率(
平衡转化率( )的关系。
)的关系。 随着x增大而增大的原因:
随着x增大而增大的原因:③图中B点处,
 的平衡转化率
的平衡转化率
(3)将
 和
和 各1mol充入一密闭容器中,在一定条件下发生合成氨反应。反应至平衡的过程中,
各1mol充入一密闭容器中,在一定条件下发生合成氨反应。反应至平衡的过程中, 的体积分数将
的体积分数将a.一直减小 b.始终不变 c.一直增大 d.无法确定
(4)一定温度下,在容积固定的密闭容器中加入
 、
、 ,发生反应:
,发生反应:
 ,下列能说明上述反应一定达到平衡状态的是______(填字母)。
,下列能说明上述反应一定达到平衡状态的是______(填字母)。A.容器内 、 、 、 、 的浓度之比为1:3:2 的浓度之比为1:3:2 |
B.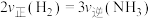 |
| C.容器内气体总的物质的量保持不变 |
| D.混合气体的密度保持不变 |
您最近半年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
【推荐2】将V1 mL 1.0 mol·L-1盐酸和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液的温度,实验结果如图所示,实验中始终保持V1+V2=50。
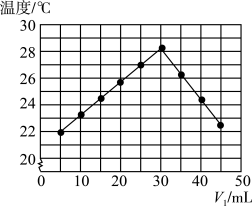
(1)下列叙述正确的是___ 。
A.做该实验时环境温度为22 ℃
B.该实验表明化学能可转化为热能
C.NaOH溶液的浓度约为1.5 mol/L
D.该实验表明有水生成的反应都是放热反应。
(2)中和热的理论数值为57.3 kJ·mol-1,下列操作可能使测得的数值偏小的是___ (填序号)。
①室温低于10 ℃时进行实验 ②在量取NaOH溶液的体积时仰视读数 ③分多次把NaOH溶液倒入盛有盐酸的小烧杯中 ④实验时用环形铜丝搅拌棒代替环形玻璃搅拌棒
在做测定中和反应的反应热实验时,应使用仪器的正确组合是( )
①天平 ②量筒 ③烧杯 ④滴定管 ⑤温度计 ⑥试管 ⑦酒精灯
A. ①②④⑤ B. ②③⑤ C.②③④⑦ D. 全部
(3)若含有8.0 g NaOH的稀溶液与稍过量的1 L 0.21 mol·L-1的盐酸反应放出11.46 kJ的热量,则表示中和热的热化学方程式为____ (填字母)。
A.NaOH(aq)+HCl(aq) NaCl(aq)+H2O(l) ΔH=+57.3 kJ·mol-1
NaCl(aq)+H2O(l) ΔH=+57.3 kJ·mol-1
B.NaOH(s)+HCl(l) NaCl(s)+H2O(l) ΔH=-57.3 kJ·mol-1
NaCl(s)+H2O(l) ΔH=-57.3 kJ·mol-1
C.NaOH(aq)+HCl(aq) NaCl(aq)+H2O(l) ΔH=-11.46 kJ·mol-1
NaCl(aq)+H2O(l) ΔH=-11.46 kJ·mol-1
D.NaOH(aq)+HCl(aq) NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
(4)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:____________________________ 。


(1)下列叙述正确的是
A.做该实验时环境温度为22 ℃
B.该实验表明化学能可转化为热能
C.NaOH溶液的浓度约为1.5 mol/L
D.该实验表明有水生成的反应都是放热反应。
(2)中和热的理论数值为57.3 kJ·mol-1,下列操作可能使测得的数值偏小的是
①室温低于10 ℃时进行实验 ②在量取NaOH溶液的体积时仰视读数 ③分多次把NaOH溶液倒入盛有盐酸的小烧杯中 ④实验时用环形铜丝搅拌棒代替环形玻璃搅拌棒
在做测定中和反应的反应热实验时,应使用仪器的正确组合是
①天平 ②量筒 ③烧杯 ④滴定管 ⑤温度计 ⑥试管 ⑦酒精灯
A. ①②④⑤ B. ②③⑤ C.②③④⑦ D. 全部
(3)若含有8.0 g NaOH的稀溶液与稍过量的1 L 0.21 mol·L-1的盐酸反应放出11.46 kJ的热量,则表示中和热的热化学方程式为
A.NaOH(aq)+HCl(aq)
 NaCl(aq)+H2O(l) ΔH=+57.3 kJ·mol-1
NaCl(aq)+H2O(l) ΔH=+57.3 kJ·mol-1B.NaOH(s)+HCl(l)
 NaCl(s)+H2O(l) ΔH=-57.3 kJ·mol-1
NaCl(s)+H2O(l) ΔH=-57.3 kJ·mol-1C.NaOH(aq)+HCl(aq)
 NaCl(aq)+H2O(l) ΔH=-11.46 kJ·mol-1
NaCl(aq)+H2O(l) ΔH=-11.46 kJ·mol-1D.NaOH(aq)+HCl(aq)
 NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1(4)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:

您最近半年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
【推荐3】能源是国民经济发展的重要基础。请根据所学知识回答下列问题:
Ⅰ.火箭推进器中装有还原剂肼 和强氧化剂过氧化氢
和强氧化剂过氧化氢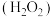 ,当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态过氧化氢反应,生成氮气和水蒸气,放出256.4kJ的热量。
,当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态过氧化氢反应,生成氮气和水蒸气,放出256.4kJ的热量。
(1)肼的结构式为_______ ,过氧化氢的电子式为_______ 。
(2)写出反应的热化学方程式:_______ 。
(3)已知
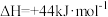 ,则16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是
,则16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是_______ kJ。
(4)上述反应用于火箭推进器,除释放大量热和快速产生大量气体外,还有一个很突出的优点是_______ 。
Ⅱ.氨气是一种重要的化学物质,可用于制取化肥和硝酸等。合成氨原料中的可用CO在高温下与水蒸气反应制得。已知:在25℃、101kPa下,
①2C(石墨,s)

②
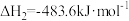
③C(石墨,s)
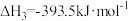
(5)25℃、101kPa下,CO与水蒸气反应转化为 和
和 的热化学方程式为
的热化学方程式为_______ 。
Ⅲ.氢氧燃料电池是符合绿色化学理念的新型发电装置。电池示意图如图所示,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。
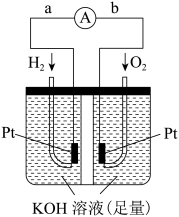
(6)其正极上的电极反应式为_______ ,若将负极改为通入 ,写出其负极上的电极反应式:
,写出其负极上的电极反应式:_______ 。
Ⅰ.火箭推进器中装有还原剂肼
 和强氧化剂过氧化氢
和强氧化剂过氧化氢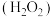 ,当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态过氧化氢反应,生成氮气和水蒸气,放出256.4kJ的热量。
,当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态过氧化氢反应,生成氮气和水蒸气,放出256.4kJ的热量。(1)肼的结构式为
(2)写出反应的热化学方程式:
(3)已知

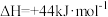 ,则16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是
,则16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是(4)上述反应用于火箭推进器,除释放大量热和快速产生大量气体外,还有一个很突出的优点是
Ⅱ.氨气是一种重要的化学物质,可用于制取化肥和硝酸等。合成氨原料中的可用CO在高温下与水蒸气反应制得。已知:在25℃、101kPa下,
①2C(石墨,s)


②

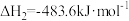
③C(石墨,s)

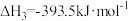
(5)25℃、101kPa下,CO与水蒸气反应转化为
 和
和 的热化学方程式为
的热化学方程式为Ⅲ.氢氧燃料电池是符合绿色化学理念的新型发电装置。电池示意图如图所示,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。

(6)其正极上的电极反应式为
 ,写出其负极上的电极反应式:
,写出其负极上的电极反应式:
您最近半年使用:0次
【推荐1】合理处理燃气中的H2S,不仅可减少对大气的污染,还可进行资源化利用。回答下列问题:
(1)H2S和S的燃烧热如表所示,

请写出常温下H2S与SO2反应的热化学方程式______ 。
(2)可以把H2S设计为一种燃料电池,原理如图a所示:其中,Fe2+在电池工作中的作用是______ ;请写出 I室发生的离子方程式______ 。
(3)为探究H2S的直接热解2H2S(g)=2H2(g )+S2(g)。在一体积为2L的密闭容器中充入2 mol H2S与1 molAr (起到稀释作用),进行实验。
①某同学测出不同温度下H2S的物质的量与反应时间的图象,图b是截取该图象的中间某部分。请计算T2温度下,0-l0s内,H2S的反应速率v=______ mo•L-1•s-1;
②图b中,T1、T2、T3三个温度,最高的是______ ;比较A点与B点的逆反应速率的大小,vA(逆)______ vB(逆)(填“>”、“<”或“=”);
③图c是表示反应2H2S(g)=2H2(g)+S2(g)平衡时,装置内各组分气体物质的量分数=与温度的关系(其中Ar气体变化曲线未画出)。请计算:C点的平衡常数K=______ ;D点平衡时,H2S的转化率=______ 。
(1)H2S和S的燃烧热如表所示,
| 物质 | 燃烧热/△H(kJ•mol-1) |
| H2S | -a |
| S | -b |

请写出常温下H2S与SO2反应的热化学方程式
(2)可以把H2S设计为一种燃料电池,原理如图a所示:其中,Fe2+在电池工作中的作用是
(3)为探究H2S的直接热解2H2S(g)=2H2(g )+S2(g)。在一体积为2L的密闭容器中充入2 mol H2S与1 molAr (起到稀释作用),进行实验。
①某同学测出不同温度下H2S的物质的量与反应时间的图象,图b是截取该图象的中间某部分。请计算T2温度下,0-l0s内,H2S的反应速率v=
②图b中,T1、T2、T3三个温度,最高的是
③图c是表示反应2H2S(g)=2H2(g)+S2(g)平衡时,装置内各组分气体物质的量分数=与温度的关系(其中Ar气体变化曲线未画出)。请计算:C点的平衡常数K=
您最近半年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
【推荐2】完成下列问题
(1)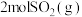 被氧化为
被氧化为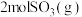 时放出热量198kJ,反应
时放出热量198kJ,反应 的能量变化如图。
的能量变化如图。

①图中A点表示___________ ,E的大小对该反应的热量变化___________ (填“有”或“无”)影响。
②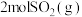 和
和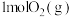 充分反应放出的热量
充分反应放出的热量___________ 198kJ(填“>”、“<”或“=”)。
(2)一定温度下,在体积为2L的密闭容器中,充入 和
和 发生如下反应:
发生如下反应: 。测定得
。测定得 和
和 的物质的量随时间变化如图。
的物质的量随时间变化如图。
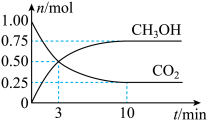
①从反应开始到平衡, 的平均反应速率
的平均反应速率
___________ 。
②达到平衡时, 的转化率为
的转化率为___________ 。(用百分数表示)
③下列措施不能提高化学反应速率的是___________ 。
A.升高温度
B.加入适当催化剂
C.缩小体积,增大压强
D.恒温、恒压下通入氦气
④下列叙述中不能说明上述反应达到平衡状态的是___________ 。
A.混合气体的平均相对分子质量保持不变
B.混合气体的压强不随时间的变化而变化
C. 在混合气体中的质量分数保持不变
在混合气体中的质量分数保持不变
D.反应中 与
与 的物质的量之比为
的物质的量之比为
E.单位时间内每消耗 同时生成
同时生成
(3)如图所示,左侧石墨上通入 ,右侧石墨上通入
,右侧石墨上通入 ,电解质溶液为KOH溶液。完成下列问题:
,电解质溶液为KOH溶液。完成下列问题:
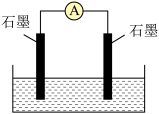
① 属于
属于___________ 化合物(填“离子”或“共价”),KOH中的化学键类型有___________ 。
②放电时 向
向___________ (填“正”或“负”)极移动。负极反应式为___________ 。
③当外电路通过电子的物质的量为7mol时,正极通入的 在标准状况下的体积为
在标准状况下的体积为___________ (假设能量全部转化为电能)。
(1)
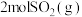 被氧化为
被氧化为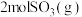 时放出热量198kJ,反应
时放出热量198kJ,反应 的能量变化如图。
的能量变化如图。
①图中A点表示
②
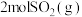 和
和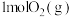 充分反应放出的热量
充分反应放出的热量(2)一定温度下,在体积为2L的密闭容器中,充入
 和
和 发生如下反应:
发生如下反应: 。测定得
。测定得 和
和 的物质的量随时间变化如图。
的物质的量随时间变化如图。
①从反应开始到平衡,
 的平均反应速率
的平均反应速率
②达到平衡时,
 的转化率为
的转化率为③下列措施不能提高化学反应速率的是
A.升高温度
B.加入适当催化剂
C.缩小体积,增大压强
D.恒温、恒压下通入氦气
④下列叙述中不能说明上述反应达到平衡状态的是
A.混合气体的平均相对分子质量保持不变
B.混合气体的压强不随时间的变化而变化
C.
 在混合气体中的质量分数保持不变
在混合气体中的质量分数保持不变D.反应中
 与
与 的物质的量之比为
的物质的量之比为
E.单位时间内每消耗
 同时生成
同时生成
(3)如图所示,左侧石墨上通入
 ,右侧石墨上通入
,右侧石墨上通入 ,电解质溶液为KOH溶液。完成下列问题:
,电解质溶液为KOH溶液。完成下列问题:
①
 属于
属于②放电时
 向
向③当外电路通过电子的物质的量为7mol时,正极通入的
 在标准状况下的体积为
在标准状况下的体积为
您最近半年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐3】已知在某温度下2L的密闭容器中进行合成氨的反应,测得如表数据:
根据表中数据计算:
(1)若反应进行到2h时放出的热量为27.78 kJ,试写出该反应的热化学方程式___________
(2)0~1h内N2的平均反应速率为___________ mol•L﹣1•h﹣1。
(3)此温度下该反应第___________ 小时达到平衡,试计算达到平衡时N2的浓度___________ mol•L﹣1
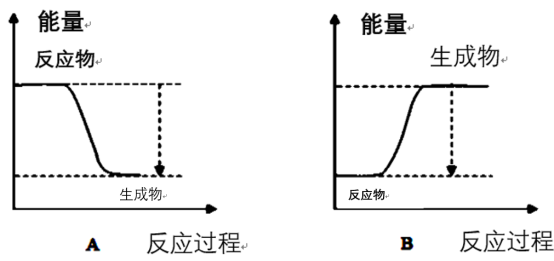
(4)下图能正确表示该反应中能量变化的是___________ (填“A”或“B”)。
(5)下列说法能说明该反应达到平衡状态的是___________ 。
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N﹣H键的同时生成2n mol H﹣H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2
d.混合气体的物质的量不变
e.容器内的气体密度不变
| 时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | 1.00 | 1.00 |
根据表中数据计算:
(1)若反应进行到2h时放出的热量为27.78 kJ,试写出该反应的热化学方程式
(2)0~1h内N2的平均反应速率为
(3)此温度下该反应第
(4)下图能正确表示该反应中能量变化的是

(5)下列说法能说明该反应达到平衡状态的是
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N﹣H键的同时生成2n mol H﹣H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2
d.混合气体的物质的量不变
e.容器内的气体密度不变
您最近半年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐1】目前,常利用催化技术将汽车尾气中的 和
和 转化成
转化成 和
和 。为研究如何增大该化学反应的速率,某课题组进行了以下实验探究。
。为研究如何增大该化学反应的速率,某课题组进行了以下实验探究。
【提出问题】在其他条件不变的情况下,温度或催化剂的比表面积(单位质量的物质所具有的总面积)如何影响汽车尾气的转化速率?
【查阅资料】使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
【实验设计】
(1)请填写下表中的空白。
(2)写出汽车尾气处理的化学方程式__________ 。
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂的比表面积,该化学反应的速率将___________ (填“增大”“减小”或“无影响”)。

(4)由实验Ⅰ和Ⅲ可得出的结论是______________ 。
 和
和 转化成
转化成 和
和 。为研究如何增大该化学反应的速率,某课题组进行了以下实验探究。
。为研究如何增大该化学反应的速率,某课题组进行了以下实验探究。【提出问题】在其他条件不变的情况下,温度或催化剂的比表面积(单位质量的物质所具有的总面积)如何影响汽车尾气的转化速率?
【查阅资料】使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
【实验设计】
(1)请填写下表中的空白。
| 编号 | 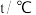 | 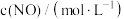 | 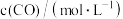 | 催化剂的比表面积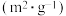 |
| Ⅰ | 280 | 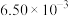 | 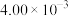 | 80.0 |
| Ⅱ | 120 | |||
| Ⅲ | 360 | 80.0 |
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂的比表面积,该化学反应的速率将

(4)由实验Ⅰ和Ⅲ可得出的结论是
您最近半年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐2】2018年是合成氨工业先驱哈珀获得诺贝尔奖100周年,合成氨工业对化学工业和国防工业具有重要意义。
I.N2和H2生成NH3的反应为: N2(g)+
N2(g)+ H2(g)
H2(g) NH3(g) ΔH(298K)=-46.2kJ·mol-1, 在Fe催化剂作用下的反应历程如下(*表示吸附态)
NH3(g) ΔH(298K)=-46.2kJ·mol-1, 在Fe催化剂作用下的反应历程如下(*表示吸附态)
化学吸附:N2(g)→2N* , H2(g)→2H*
表面反应:N*+H*→NH* ,NH*+H*→NH2 * ,NH2 *+H*→NH3*
脱附: NH3* NH3(g)
NH3(g)
其中,N2的吸附分解反应活化能高、速率慢,决定合成氨的整体反应速率
(1)利于提高合成氨平衡产率的条件有_______ 。
A.高温 B.低温 C.低压 D.高压 E.催化剂
(2)实际生产中常用工艺条件:Fe作催化剂。控制温度773K,压强3.0×107Pa,原料气中N2和H2物质的量之比为1:2.8。
①分析说明原料气中N2过量的理由(任写一条)_______ 。
②关于合成氨工艺的下列理解,正确的是_______ (填选项字母)。
A.合成氨反应在不同温度下的ΔH和ΔS都小于零
B.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
C.迅速冷却可将NH3液化,不断将液态氨移去,有利于反应正向进行
D.分离空气可得到N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发生
II.工业合成氨生产示意图如图所示:
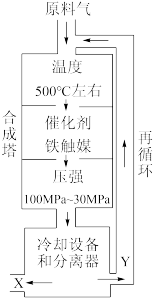
(3)X的化学式为_______ 。
(4)图中条件选定的主要原因是_______ (填字母)。
A.温度、压强对化学平衡的影响
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
(5)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和 NH3的量),反应速率与时间的关系如图所示。图中t1时引起平衡移动的条件可能是_______ 。其中表示平衡混合物中NH3的含量最高的一段时间是_______ (填字母)。
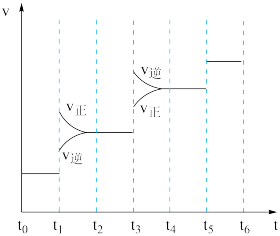
A.0~t1 B.t2~t3 C.t4~t5 D.t5~t6
I.N2和H2生成NH3的反应为:
 N2(g)+
N2(g)+ H2(g)
H2(g) NH3(g) ΔH(298K)=-46.2kJ·mol-1, 在Fe催化剂作用下的反应历程如下(*表示吸附态)
NH3(g) ΔH(298K)=-46.2kJ·mol-1, 在Fe催化剂作用下的反应历程如下(*表示吸附态)化学吸附:N2(g)→2N* , H2(g)→2H*
表面反应:N*+H*→NH* ,NH*+H*→NH2 * ,NH2 *+H*→NH3*
脱附: NH3*
 NH3(g)
NH3(g)其中,N2的吸附分解反应活化能高、速率慢,决定合成氨的整体反应速率
(1)利于提高合成氨平衡产率的条件有
A.高温 B.低温 C.低压 D.高压 E.催化剂
(2)实际生产中常用工艺条件:Fe作催化剂。控制温度773K,压强3.0×107Pa,原料气中N2和H2物质的量之比为1:2.8。
①分析说明原料气中N2过量的理由(任写一条)
②关于合成氨工艺的下列理解,正确的是
A.合成氨反应在不同温度下的ΔH和ΔS都小于零
B.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
C.迅速冷却可将NH3液化,不断将液态氨移去,有利于反应正向进行
D.分离空气可得到N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发生
II.工业合成氨生产示意图如图所示:

(3)X的化学式为
(4)图中条件选定的主要原因是
A.温度、压强对化学平衡的影响
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
(5)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和 NH3的量),反应速率与时间的关系如图所示。图中t1时引起平衡移动的条件可能是

A.0~t1 B.t2~t3 C.t4~t5 D.t5~t6
您最近半年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐3】取等体积、等物质的量浓度H2O2溶液分别进行下列实验,研究外界条件对反应速率的影响。
(1)实验1、2研究的是___________ 对H2O2分解速率的影响; 实验3、4研究的是________ 对H2O2分解速率的影响。
(2)实验中可以判断该反应速率快慢的现象是__________ 。
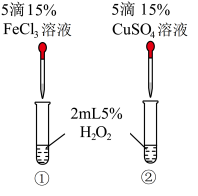
(3)有同学认为,若把实验3中的催化剂改成CuSO4进行下图操作,看到反应速率为①>②,则一定可以说明Fe3+比Cu2+对H2O2分解催化效果好。你认为此同学的结论是否正确?____ (填“正确”或“不正确”),理由是_____ 。
序号 | 条件 | |
温度/℃ | 催化剂 | |
1 | 40 | FeCl3溶液 |
2 | 20 | FeCl3溶液 |
3 | 20 | MnO2 |
4 | 20 | 无 |
(2)实验中可以判断该反应速率快慢的现象是
(3)有同学认为,若把实验3中的催化剂改成CuSO4进行下图操作,看到反应速率为①>②,则一定可以说明Fe3+比Cu2+对H2O2分解催化效果好。你认为此同学的结论是否正确?

您最近半年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐1】甲醇来源丰富、价格低廉,是一种重要的化工原料,有着重要的用途和应用前景。
2CO(g)+O2(g)=2CO2(g) △H = -570 kJ/mol
(1)计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H =_______ 。
(2)若在绝热恒容 的容器内进行反应2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g),初始加入2mol CH3OH和3mol O2下列不能 表示该反应达到平衡状态的有__________ (填字母序号)。
A.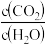 保持不变 B.容器中混合气体的密度不变化
保持不变 B.容器中混合气体的密度不变化
C.2v正(H2O)=v逆(CO2) D.容器中混合气体的压强不变化
E. 平均相对分子量保持不变 F. K值保持不变_______ ,初始压强为P,该反应的压强平衡常数Kp=______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)若再次向容器中充入0.5mol H2和0.5mol CO,则此时该反应v(正)_____ v(逆)(填“>”、“<”或“=”);
(5)某实验小组设计了甲醇以氢氧化钾为电解质溶液的燃料电池装置。该电池负极反应的离子方程式为______ 。
Ⅰ.工业生产甲醇的常用方法是:CO(g)+2H2(g)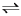 CH3OH(g) △H = -91 kJ/mol。
CH3OH(g) △H = -91 kJ/mol。
2CO(g)+O2(g)=2CO2(g) △H = -570 kJ/mol
(1)计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H =
(2)若在
A.
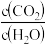 保持不变 B.容器中混合气体的密度不变化
保持不变 B.容器中混合气体的密度不变化C.2v正(H2O)=v逆(CO2) D.容器中混合气体的压强不变化
E. 平均相对分子量保持不变 F. K值保持不变
Ⅱ.制甲醇所需要的H2,可用下列反应制取:H2O(g)+CO(g)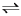 H2(g)+ CO2(g) △H<0,某温度下该反应,若起始时向2L容器中充入1 mol CO和1 mol H2O,5min达到平衡时,CO的转化率为60%,试回答下列问题:
H2(g)+ CO2(g) △H<0,某温度下该反应,若起始时向2L容器中充入1 mol CO和1 mol H2O,5min达到平衡时,CO的转化率为60%,试回答下列问题:
(4)若再次向容器中充入0.5mol H2和0.5mol CO,则此时该反应v(正)
(5)某实验小组设计了甲醇以氢氧化钾为电解质溶液的燃料电池装置。该电池负极反应的离子方程式为
您最近半年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
【推荐2】我国力争实现2030年前碳达峰、2060年前碳中和的目标,研究碳的化合物对减少 在大气中累积及实现可再生能源的有效利用具有重要意义。
在大气中累积及实现可再生能源的有效利用具有重要意义。
(1)已知 和
和 在一定条件下能发生反应
在一定条件下能发生反应 ,反应物与生成物的能量与活化能的关系如图所示,该反应的
,反应物与生成物的能量与活化能的关系如图所示,该反应的
______ kJ/mol(用含 和
和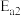 的代数式表示)。
的代数式表示)。
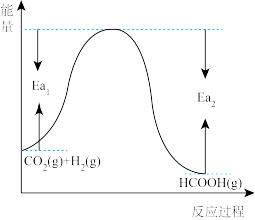
(2)恒温恒容条件下,为了提高 反应中
反应中 的平衡转化率,可采取的措施为
的平衡转化率,可采取的措施为______ (任写一项)。
(3)下列能说反应 达到平衡状态的是______(填字母)。
达到平衡状态的是______(填字母)。
(4)一定温度下,在一刚性密闭容器中,充入等物质的量的 和
和 此时容器的压强为48kPa,发生反应
此时容器的压强为48kPa,发生反应 ,6min时达到平衡,此时容器压强为36kPa,则0~6min内用
,6min时达到平衡,此时容器压强为36kPa,则0~6min内用 分压表示的化学反应速率为
分压表示的化学反应速率为______ kPa/min。相同温度下,该反应的逆反应平衡常数
______ kPa( 是平衡分压代替平衡浓度计算的平衡常数)。
是平衡分压代替平衡浓度计算的平衡常数)。
(5)除合成甲酸(HCOOH)外,有科学家以 、
、 为原料合成
为原料合成 达到有效降低空气中二氧化碳含量的目的,其中涉及的主要反应如下:
达到有效降低空气中二氧化碳含量的目的,其中涉及的主要反应如下:
Ⅰ.
 kJ⋅mol
kJ⋅mol
Ⅱ.
 kJ⋅mol
kJ⋅mol
不同条件下,按照 投料,
投料, 的平衡转化率如图所示:
的平衡转化率如图所示:

压强 、
、 、
、 由小到大的顺序是
由小到大的顺序是______ 。压强为 时,温度高于300℃后,
时,温度高于300℃后, 的平衡转化率随温度升高而升高的原因是
的平衡转化率随温度升高而升高的原因是________________________ 。
(6)近年来,有研究人员用 通过电催化生成多种燃料,实现
通过电催化生成多种燃料,实现 的回收利用,其工作原理如图所示:
的回收利用,其工作原理如图所示:
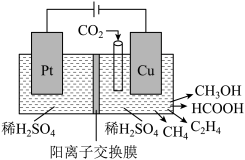
请写出Cu电极上产生 的电极反应式
的电极反应式______ 。
 在大气中累积及实现可再生能源的有效利用具有重要意义。
在大气中累积及实现可再生能源的有效利用具有重要意义。(1)已知
 和
和 在一定条件下能发生反应
在一定条件下能发生反应 ,反应物与生成物的能量与活化能的关系如图所示,该反应的
,反应物与生成物的能量与活化能的关系如图所示,该反应的
 和
和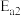 的代数式表示)。
的代数式表示)。
(2)恒温恒容条件下,为了提高
 反应中
反应中 的平衡转化率,可采取的措施为
的平衡转化率,可采取的措施为(3)下列能说反应
 达到平衡状态的是______(填字母)。
达到平衡状态的是______(填字母)。A.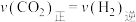 | B.HCOOH的体积分数不再变化 |
| C.混合气体的密度不再变化 | D. |
(4)一定温度下,在一刚性密闭容器中,充入等物质的量的
 和
和 此时容器的压强为48kPa,发生反应
此时容器的压强为48kPa,发生反应 ,6min时达到平衡,此时容器压强为36kPa,则0~6min内用
,6min时达到平衡,此时容器压强为36kPa,则0~6min内用 分压表示的化学反应速率为
分压表示的化学反应速率为
 是平衡分压代替平衡浓度计算的平衡常数)。
是平衡分压代替平衡浓度计算的平衡常数)。(5)除合成甲酸(HCOOH)外,有科学家以
 、
、 为原料合成
为原料合成 达到有效降低空气中二氧化碳含量的目的,其中涉及的主要反应如下:
达到有效降低空气中二氧化碳含量的目的,其中涉及的主要反应如下:Ⅰ.

 kJ⋅mol
kJ⋅mol
Ⅱ.

 kJ⋅mol
kJ⋅mol
不同条件下,按照
 投料,
投料, 的平衡转化率如图所示:
的平衡转化率如图所示:
压强
 、
、 、
、 由小到大的顺序是
由小到大的顺序是 时,温度高于300℃后,
时,温度高于300℃后, 的平衡转化率随温度升高而升高的原因是
的平衡转化率随温度升高而升高的原因是(6)近年来,有研究人员用
 通过电催化生成多种燃料,实现
通过电催化生成多种燃料,实现 的回收利用,其工作原理如图所示:
的回收利用,其工作原理如图所示:
请写出Cu电极上产生
 的电极反应式
的电极反应式
您最近半年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐3】以乙苯催化脱氢来制取苯乙烯,是化工产业中常用的方法,其反应如下所示:
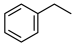 (g)
(g)
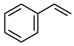 (g)+H2(g)
(g)+H2(g) 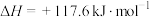
回答下列问题:
Ⅰ.在 催化下,在三个恒容(均为1.0L)密闭容器中发生上述反应。相关实验数据如下:
催化下,在三个恒容(均为1.0L)密闭容器中发生上述反应。相关实验数据如下:
(1) ℃时,按表格中数据投料,则此时乙容器中v正
℃时,按表格中数据投料,则此时乙容器中v正_________ (填“>”“=”或“<”)v逆。
(2)
_________ (填“>”“=”或“<”) 。
。
Ⅱ.乙苯脱氢的历程如下图所示:
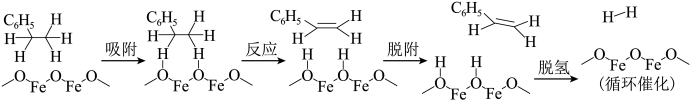
(3)四个步骤中,更有利于在低温发生的是上图中的_________ 步骤。“吸附”步骤中乙苯分子被吸附在催化剂 表面活性位点并被活化;“反应”步骤中Fe(Ⅲ)转化为
表面活性位点并被活化;“反应”步骤中Fe(Ⅲ)转化为_________ ,从共价键变化的角度描述该步骤为_________ 。该催化剂在使用过程中,失活现象比较严重,由此推断“脱氢”步骤除了产生 ,还可能生成小分子离开催化剂表面。
,还可能生成小分子离开催化剂表面。
Ⅲ.为了节省能源,乙苯催化脱氢制苯乙烯的过程可以在 气氛下进行。100kPa下,反应气组成
气氛下进行。100kPa下,反应气组成 按1∶0、1:1、1∶5、1∶9投料,乙苯的平衡转化率随反应温度的变化关系如图。
按1∶0、1:1、1∶5、1∶9投料,乙苯的平衡转化率随反应温度的变化关系如图。
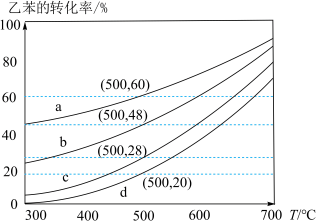
(4)图中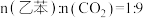 对应的曲线是
对应的曲线是_________ (填序号)。
(5)工业乙苯催化脱氢生产苯乙烯时,会产生少量积碳,加入一定温度的水蒸气可较长时间保持催化剂的活性,用化学方程式表示其原因是_________ 。
 (g)
(g)
 (g)+H2(g)
(g)+H2(g) 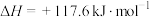
回答下列问题:
Ⅰ.在
 催化下,在三个恒容(均为1.0L)密闭容器中发生上述反应。相关实验数据如下:
催化下,在三个恒容(均为1.0L)密闭容器中发生上述反应。相关实验数据如下:| 容器 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
| 乙苯(g) | 苯乙烯(g) | 氢气(g) | 苯乙烯(g) | ||
| 甲 |  | 3.0 | 0 | 0 | 1.0 |
| 乙 |  | 4.0 | 3.0 | 1.0 | x |
| 丙 | 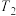 | 5.0 | 0 | 0 | 1.2 |
(1)
 ℃时,按表格中数据投料,则此时乙容器中v正
℃时,按表格中数据投料,则此时乙容器中v正(2)

 。
。Ⅱ.乙苯脱氢的历程如下图所示:

(3)四个步骤中,更有利于在低温发生的是上图中的
 表面活性位点并被活化;“反应”步骤中Fe(Ⅲ)转化为
表面活性位点并被活化;“反应”步骤中Fe(Ⅲ)转化为 ,还可能生成小分子离开催化剂表面。
,还可能生成小分子离开催化剂表面。Ⅲ.为了节省能源,乙苯催化脱氢制苯乙烯的过程可以在
 气氛下进行。100kPa下,反应气组成
气氛下进行。100kPa下,反应气组成 按1∶0、1:1、1∶5、1∶9投料,乙苯的平衡转化率随反应温度的变化关系如图。
按1∶0、1:1、1∶5、1∶9投料,乙苯的平衡转化率随反应温度的变化关系如图。
(4)图中
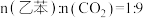 对应的曲线是
对应的曲线是(5)工业乙苯催化脱氢生产苯乙烯时,会产生少量积碳,加入一定温度的水蒸气可较长时间保持催化剂的活性,用化学方程式表示其原因是
您最近半年使用:0次



