名校
1 . 13g锌粒与足量2 稀硫酸反应生成
稀硫酸反应生成 ,下列措施可以加快反应速率,但减少
,下列措施可以加快反应速率,但减少 的最终生成量的是
的最终生成量的是
 稀硫酸反应生成
稀硫酸反应生成 ,下列措施可以加快反应速率,但减少
,下列措施可以加快反应速率,但减少 的最终生成量的是
的最终生成量的是| A.将锌粒换成等质量的锌粉 | B.向稀硫酸中加入少量 固体 固体 |
C.向稀硫酸中加入少量 溶液 溶液 | D.将该稀硫酸换成足量0.5 稀硫酸 稀硫酸 |
您最近半年使用:0次
名校
2 . 铁片与稀硫酸反应制氢气,下列措施不能使氢气生成速率加大的是
| A.用98%的㳖硫酸代替稀硫酸 | B.用铁粉代替铁片 |
C.滴加适量 溶液 溶液 | D.加热 |
您最近半年使用:0次
3 . 叠氮化钠 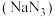 是一种应用广泛的化工产品,可用于合成抗生素头孢菌素药物的中间体、汽车安全气囊等。回答下列问题:
是一种应用广泛的化工产品,可用于合成抗生素头孢菌素药物的中间体、汽车安全气囊等。回答下列问题:
Ⅰ.实验室制备
水合肼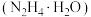 与亚硝酸甲酯
与亚硝酸甲酯 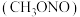 在氢氧化钠存在下制备
在氢氧化钠存在下制备  ,其反应装置如图所示:
,其反应装置如图所示: 无色无味,微溶于醇,溶于水。
无色无味,微溶于醇,溶于水。
(1) 的电子式为
的电子式为_______ ; 晶体中阴离子与阳离子个数之比为
晶体中阴离子与阳离子个数之比为_______ 。
(2)装置中多孔球泡的作用是_______ 。
(3)锥形瓶中水合与亚硝酸甲酯在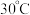 时可以反应生成叠氮化钠、甲醇等物质,写出该反应的化学方程式:
时可以反应生成叠氮化钠、甲醇等物质,写出该反应的化学方程式:_______ 。
Ⅱ.回收甲醇
将制备反应后所得混合溶液加入烧瓶中,按照图所示装置进行减压蒸馏。
①
② 在
在 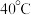 时分解。
时分解。
(4)实验时冷凝管中冷却水要_______ (填“ 进
进  出”或 “
出”或 “ 进
进  出”)。
出”)。
(5)甲醇回收时需用减压蒸馏的原因是_______ 。
Ⅲ.产品提取及纯度测定
将蒸馏后所得母液降温结晶,过滤得 湿品;再用去离子水重结晶得
湿品;再用去离子水重结晶得  产品并用碘量法测定产品纯度。取产品
产品并用碘量法测定产品纯度。取产品  加入足量去离子水中溶解,并加入适量稀硫酸酸化;向混合液中加入
加入足量去离子水中溶解,并加入适量稀硫酸酸化;向混合液中加入  溶液,溶液呈紫红色;再加入足量
溶液,溶液呈紫红色;再加入足量 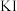 溶液消耗过量的
溶液消耗过量的 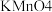 溶液;其后用
溶液;其后用 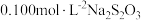 ,标准溶液滴定所产生的
,标准溶液滴定所产生的  ,消耗
,消耗  溶液
溶液 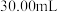 。
。
(6)实验所得产品的纯度为_______ ;若加入的 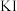 溶液有部分被空气中的氧气氧化,则测得产品的纯度
溶液有部分被空气中的氧气氧化,则测得产品的纯度_______ (填“偏低”、“偏高”、“不变”)。
已知:①产品中杂质不参与反应。
②测定过程中发生的反应:
 ;
;
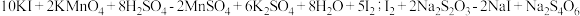 。
。
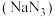 是一种应用广泛的化工产品,可用于合成抗生素头孢菌素药物的中间体、汽车安全气囊等。回答下列问题:
是一种应用广泛的化工产品,可用于合成抗生素头孢菌素药物的中间体、汽车安全气囊等。回答下列问题:Ⅰ.实验室制备

水合肼
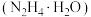 与亚硝酸甲酯
与亚硝酸甲酯 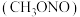 在氢氧化钠存在下制备
在氢氧化钠存在下制备  ,其反应装置如图所示:
,其反应装置如图所示:
 无色无味,微溶于醇,溶于水。
无色无味,微溶于醇,溶于水。(1)
 的电子式为
的电子式为 晶体中阴离子与阳离子个数之比为
晶体中阴离子与阳离子个数之比为(2)装置中多孔球泡的作用是
(3)锥形瓶中水合与亚硝酸甲酯在
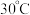 时可以反应生成叠氮化钠、甲醇等物质,写出该反应的化学方程式:
时可以反应生成叠氮化钠、甲醇等物质,写出该反应的化学方程式:Ⅱ.回收甲醇
将制备反应后所得混合溶液加入烧瓶中,按照图所示装置进行减压蒸馏。
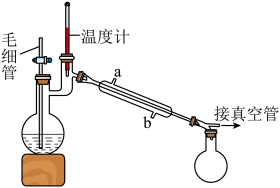
①
| 物质 |  |  |  |
沸点  | 64.7 | 113.5 | 300 |
 在
在 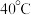 时分解。
时分解。(4)实验时冷凝管中冷却水要
 进
进  出”或 “
出”或 “ 进
进  出”)。
出”)。(5)甲醇回收时需用减压蒸馏的原因是
Ⅲ.产品提取及纯度测定
将蒸馏后所得母液降温结晶,过滤得
 湿品;再用去离子水重结晶得
湿品;再用去离子水重结晶得  产品并用碘量法测定产品纯度。取产品
产品并用碘量法测定产品纯度。取产品  加入足量去离子水中溶解,并加入适量稀硫酸酸化;向混合液中加入
加入足量去离子水中溶解,并加入适量稀硫酸酸化;向混合液中加入  溶液,溶液呈紫红色;再加入足量
溶液,溶液呈紫红色;再加入足量 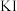 溶液消耗过量的
溶液消耗过量的 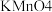 溶液;其后用
溶液;其后用 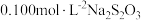 ,标准溶液滴定所产生的
,标准溶液滴定所产生的  ,消耗
,消耗  溶液
溶液 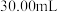 。
。(6)实验所得产品的纯度为
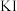 溶液有部分被空气中的氧气氧化,则测得产品的纯度
溶液有部分被空气中的氧气氧化,则测得产品的纯度已知:①产品中杂质不参与反应。
②测定过程中发生的反应:
 ;
;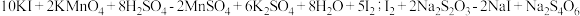 。
。
您最近半年使用:0次
解题方法
4 . 某化工厂利用废旧锂离子电池正极材料(含有LiCoO2以及少量Ca、Mg、Fe、Al、C等)制备Co2O3和Li2CO3。工艺流程如下:
①已知LiCoO2难溶于水,酸浸后的溶液中含有的部分金属离子有:Co2+、Fe2+、Al3+、Mg2+等;
②NaHCO3溶液中存在 的自耦电离:
的自耦电离: ;
;
③常温时,有关物质Ksp如下表:
(1)为了使拆解后的“正极材料”与酸充分反应,可采取的措施有___________ (任写一种)。
(2)元素Co在周期表中的位置为___________ ;Co2+价层电子轨道表示式为___________ 。
(3)“酸浸”时,LiCoO2参与反应的离子方程式为___________ ;下列试剂中最适宜替换H2C2O4的是___________ 。
A.Na2CO3溶液 B.Na2S2O5溶液 C.NaNO3溶液 D.浓盐酸
(4)滤渣1的主要成分有___________ 。
(5)加NaOH调节pH=10时,可以完全沉淀的金属离子有___________ (一般认为离子浓度≤10-5mol/L时,离子沉淀完全)。
(6)滤液3中含金属元素的离子主要是 ,则滤渣2与NH3∙H2O,(NH4)2CO3混合溶液主要反应的离子方程式为
,则滤渣2与NH3∙H2O,(NH4)2CO3混合溶液主要反应的离子方程式为___________ 。
(7)沉锂操作过程中需将温度升高到90℃,原因①是加快反应速率,并降低Li2CO3的溶解度②是(结合平衡原理解释)___________ 。

①已知LiCoO2难溶于水,酸浸后的溶液中含有的部分金属离子有:Co2+、Fe2+、Al3+、Mg2+等;
②NaHCO3溶液中存在
 的自耦电离:
的自耦电离: ;
;③常温时,有关物质Ksp如下表:
| 物质 |  |  |  |  |
| Ksp | 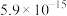 |  | 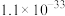 |  |
(1)为了使拆解后的“正极材料”与酸充分反应,可采取的措施有
(2)元素Co在周期表中的位置为
(3)“酸浸”时,LiCoO2参与反应的离子方程式为
A.Na2CO3溶液 B.Na2S2O5溶液 C.NaNO3溶液 D.浓盐酸
(4)滤渣1的主要成分有
(5)加NaOH调节pH=10时,可以完全沉淀的金属离子有
(6)滤液3中含金属元素的离子主要是
 ,则滤渣2与NH3∙H2O,(NH4)2CO3混合溶液主要反应的离子方程式为
,则滤渣2与NH3∙H2O,(NH4)2CO3混合溶液主要反应的离子方程式为(7)沉锂操作过程中需将温度升高到90℃,原因①是加快反应速率,并降低Li2CO3的溶解度②是(结合平衡原理解释)
您最近半年使用:0次
名校
解题方法
5 . 下列事实能说明影响化学反应速率的决定性因素是反应物本身性质的是
| A.Cu能与浓硝酸反应,而不与浓盐酸反应 |
| B.Cu与浓硝酸反应比与稀硝酸反应快 |
C. 与 与 在常温、常压下不反应,放电时可反应 在常温、常压下不反应,放电时可反应 |
D.加热时, 与浓盐酸反应,而不与稀盐酸反应 与浓盐酸反应,而不与稀盐酸反应 |
您最近半年使用:0次
解题方法
6 . 一种利用铅铋合金(主要成分为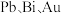 ,杂质为
,杂质为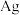 )制备草酸铅的工艺流程如图所示。其中,熔化和制粒两步工序的具体操作为:将铅铋合金加热熔化后,以一定的流速加入水中,形成直径为
)制备草酸铅的工艺流程如图所示。其中,熔化和制粒两步工序的具体操作为:将铅铋合金加热熔化后,以一定的流速加入水中,形成直径为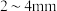 的合金颗粒。
的合金颗粒。
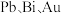 ,杂质为
,杂质为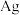 )制备草酸铅的工艺流程如图所示。其中,熔化和制粒两步工序的具体操作为:将铅铋合金加热熔化后,以一定的流速加入水中,形成直径为
)制备草酸铅的工艺流程如图所示。其中,熔化和制粒两步工序的具体操作为:将铅铋合金加热熔化后,以一定的流速加入水中,形成直径为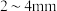 的合金颗粒。
的合金颗粒。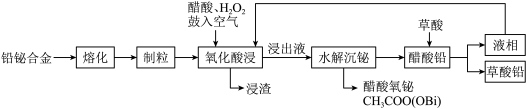
| A.熔化和制粒的目的是增大铅铋合金与反应物的接触面积 |
B.氧化酸浸工序中, 和空气中的 和空气中的 作氧化剂 作氧化剂 |
C.氧化酸浸工序所得浸渣的主要成分为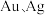 |
D.制备草酸铅的反应可表示为: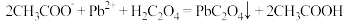 |
您最近半年使用:0次
解题方法
7 . 甲酸( )可在纳米级
)可在纳米级 表面分解为活性
表面分解为活性 和
和 ,经下列历程实现
,经下列历程实现 的催化还原。已知
的催化还原。已知 (Ⅱ)、
(Ⅱ)、 (Ⅲ)表示
(Ⅲ)表示 中的二价铁和三价铁,设
中的二价铁和三价铁,设 为阿伏加德罗常数的值。下列说法错误的是
为阿伏加德罗常数的值。下列说法错误的是
 )可在纳米级
)可在纳米级 表面分解为活性
表面分解为活性 和
和 ,经下列历程实现
,经下列历程实现 的催化还原。已知
的催化还原。已知 (Ⅱ)、
(Ⅱ)、 (Ⅲ)表示
(Ⅲ)表示 中的二价铁和三价铁,设
中的二价铁和三价铁,设 为阿伏加德罗常数的值。下列说法错误的是
为阿伏加德罗常数的值。下列说法错误的是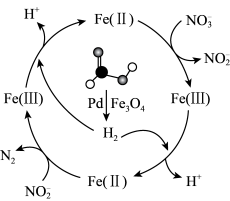
A.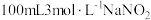 溶液中含有的 溶液中含有的 数目为 数目为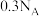 |
| B.生产中将催化剂处理成纳米级颗粒可增大甲酸分解的速率 |
C. 由 由 和 和 组成的混合气体中,含氧原子的总数为 组成的混合气体中,含氧原子的总数为 |
D.反应历程中生成的 可调节体系 可调节体系 ,有增强 ,有增强 氧化性的作用 氧化性的作用 |
您最近半年使用:0次
2024-04-16更新
|
209次组卷
|
3卷引用:甘肃省靖远县2024届高三下学期第三次联考化学试题
解题方法
8 .  是棕黑色粉末,不溶于水和醇,常用于染料、火柴、焰火、合成橡胶、电极等制造。一种以硫铅矿(主要成分为PbS,含有杂质
是棕黑色粉末,不溶于水和醇,常用于染料、火柴、焰火、合成橡胶、电极等制造。一种以硫铅矿(主要成分为PbS,含有杂质 、FeO、
、FeO、 )制备
)制备 的工艺流程如图所示。
的工艺流程如图所示。 在冷水中的溶解度较小,易溶于热水;
在冷水中的溶解度较小,易溶于热水;
②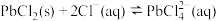
 ;
;
③
④25℃时,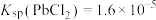 ,
,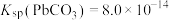
回答下列问题:
(1)硫铅矿“浸取”时需要预先粉碎,其目的是________ ,检验“浸取”后的溶液中不含有 的试剂是
的试剂是________ 。
(2)“浸取”以及“调 ”后均需要趁热过滤的原因是
”后均需要趁热过滤的原因是________ ,已知滤渣1中含有硫单质,则生成硫单质的化学反应中氧化剂和还原剂物质的量之比为________ 。
(3)滤渣2的主要成分有MnO、________ (填化学式)。
(4)写出“氧化”过程中的离子方程式________ 。
(5)“沉淀转化”是为了使 转化为
转化为 ,若滤液2中
,若滤液2中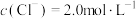 ,欲使“沉淀转化”过程中所得
,欲使“沉淀转化”过程中所得 固体中不含
固体中不含 ,则溶液中
,则溶液中
________  。
。
 是棕黑色粉末,不溶于水和醇,常用于染料、火柴、焰火、合成橡胶、电极等制造。一种以硫铅矿(主要成分为PbS,含有杂质
是棕黑色粉末,不溶于水和醇,常用于染料、火柴、焰火、合成橡胶、电极等制造。一种以硫铅矿(主要成分为PbS,含有杂质 、FeO、
、FeO、 )制备
)制备 的工艺流程如图所示。
的工艺流程如图所示。
 在冷水中的溶解度较小,易溶于热水;
在冷水中的溶解度较小,易溶于热水;②
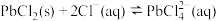
 ;
;③

④25℃时,
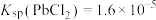 ,
,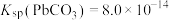
回答下列问题:
(1)硫铅矿“浸取”时需要预先粉碎,其目的是
 的试剂是
的试剂是(2)“浸取”以及“调
 ”后均需要趁热过滤的原因是
”后均需要趁热过滤的原因是(3)滤渣2的主要成分有MnO、
(4)写出“氧化”过程中的离子方程式
(5)“沉淀转化”是为了使
 转化为
转化为 ,若滤液2中
,若滤液2中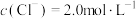 ,欲使“沉淀转化”过程中所得
,欲使“沉淀转化”过程中所得 固体中不含
固体中不含 ,则溶液中
,则溶液中
 。
。
您最近半年使用:0次
9 . 下列4支试管中,等质量的铁与足量盐酸反应生成H2的反应速率最大的是
| 试管 | 盐酸浓度 | 温度 | 铁的状态 |
| A | 1mol·L-1 | 10℃ | 块状 |
| B | 1mol·L-1 | 10℃ | 粉末状 |
| C | 3mol·L-1 | 20℃ | 块状 |
| D | 3mol·L-1 | 20℃ | 粉末状 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2024-03-30更新
|
145次组卷
|
2卷引用:云南省保山市腾冲市第八中学2020-2021学年高一下学期期末考试化学试题
解题方法
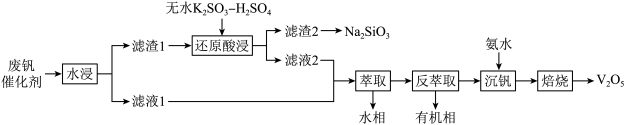
10 . 钒是重要的战略资源,以硫酸工业产生的废钒催化剂为原料(含 、
、 、
、 、
、 以及少量的
以及少量的 等),综合回收利用钒、硅、钾实现变废为宝、保护环境的目的,回收工艺流程如下:
等),综合回收利用钒、硅、钾实现变废为宝、保护环境的目的,回收工艺流程如下:
已知:钒的氧化物在酸性条件下以 、
、 存在,
存在, 增大时
增大时 可转化为
可转化为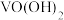 沉淀。
沉淀。
(1)“水浸”前,通常需要将催化剂粉碎,其目的是___________ 。
(2)“滤渣2”转化为 的化学方程式是
的化学方程式是___________ 。
(3)“还原酸浸”时:
①硫酸的用量会影响钒的浸出率, 需保持在1.2以下的原因是
需保持在1.2以下的原因是___________ 。
②过程中除了有 被还原成
被还原成 ,还涉及的反应离子方程式为
,还涉及的反应离子方程式为___________ 。
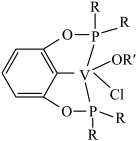
③若以磷酸为介质处理废催化剂,可以提高钒的浸出率。一种钒磷配合物的结构如图所示,形成配位键时V提供___________ (选填“孤对电子”或“空轨道”)。
(4)“萃取”时选择有机萃取剂,原理是: (有机层)
(有机层)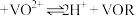 (有机层),“反萃取”应选择在
(有机层),“反萃取”应选择在___________ 环境中进行(选填“酸性”、“中性”或“碱性”)。
(5)加氨水生成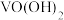 沉淀,若经焙烧得到
沉淀,若经焙烧得到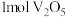 产品,则消耗空气中
产品,则消耗空气中
___________  。
。
(6)近年来,研究人员发现含钒的锑化物在超导方面表现出潜在的应用前景。某含钒的锑化物晶胞如图1所示,晶体中包含由V和 组成的二维平面如图2。
组成的二维平面如图2。
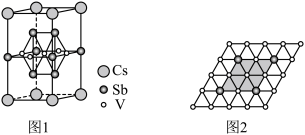
该含钒的锑化物化学式为___________ ,钒原子周围紧邻的锑原子数为___________ 。
 、
、 、
、 、
、 以及少量的
以及少量的 等),综合回收利用钒、硅、钾实现变废为宝、保护环境的目的,回收工艺流程如下:
等),综合回收利用钒、硅、钾实现变废为宝、保护环境的目的,回收工艺流程如下:
已知:钒的氧化物在酸性条件下以
 、
、 存在,
存在, 增大时
增大时 可转化为
可转化为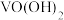 沉淀。
沉淀。(1)“水浸”前,通常需要将催化剂粉碎,其目的是
(2)“滤渣2”转化为
 的化学方程式是
的化学方程式是(3)“还原酸浸”时:
①硫酸的用量会影响钒的浸出率,
 需保持在1.2以下的原因是
需保持在1.2以下的原因是②过程中除了有
 被还原成
被还原成 ,还涉及的反应离子方程式为
,还涉及的反应离子方程式为③若以磷酸为介质处理废催化剂,可以提高钒的浸出率。一种钒磷配合物的结构如图所示,形成配位键时V提供

(4)“萃取”时选择有机萃取剂,原理是:
 (有机层)
(有机层)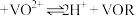 (有机层),“反萃取”应选择在
(有机层),“反萃取”应选择在(5)加氨水生成
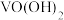 沉淀,若经焙烧得到
沉淀,若经焙烧得到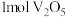 产品,则消耗空气中
产品,则消耗空气中
 。
。(6)近年来,研究人员发现含钒的锑化物在超导方面表现出潜在的应用前景。某含钒的锑化物晶胞如图1所示,晶体中包含由V和
 组成的二维平面如图2。
组成的二维平面如图2。
该含钒的锑化物化学式为
您最近半年使用:0次



