名校
解题方法
1 . 下列过程中,通常需要增大化学反应速率的是
| A.工业合成氨 | B.钢铁的腐蚀 | C.食物腐败 | D.塑料老化 |
您最近半年使用:0次
名校
2 . 下列现象或做法与化学反应速率无关的是
| A.“冰墩墩”制作材料生产过程中添加抗老化助剂 | B.新冠病毒可能通过气溶胶加速传播 |
| C.谷物酿酒时加入酒曲酶 | D.馒头制作过程中用酵头发酵 |
您最近半年使用:0次
3 . 下列有关合成氨工业的说法,正确的是
A.根据勒夏特列原理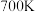 左右比室温更有利于合成氨的反应 左右比室温更有利于合成氨的反应 |
B.由于氨易液化, 在实际生产中可循环使用,所以总体来说合成氨的产率很高 在实际生产中可循环使用,所以总体来说合成氨的产率很高 |
| C.升高温度可以加快反应速率,且有利于化学平衡向合成氨的方向移动 |
D.合成氨采用的压强是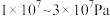 ,因为该压强下铁触媒的活性最高 ,因为该压强下铁触媒的活性最高 |
您最近半年使用:0次
4 . 下列生产生活中需要增大化学反应速率的是
 |  |  |  |
| A.铁桥生锈 | B.牛奶变质 | C.塑料老化 | D.高炉炼铁 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
5 . 工业合成氨对粮食增产、增加人口具重要价值。1913年,Haber-Bosch发明的催化合成氨技术实现了工业化生产:N2(g)+3H2(g)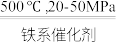 2NH3(g),298K时反应相关数据如表所示:
2NH3(g),298K时反应相关数据如表所示:
已知:化学反应吉布斯自由能变化量ΔG=ΔH -TΔS (通常温度区间,ΔH和ΔS可视为常量),ΔG与压力平衡常数Kp的关系为:lgKp = 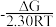 ,Kp为压力平衡常数;R为气体摩尔常数8.314 J·K-1· mol-1;T为热力学温度,单位:K。
,Kp为压力平衡常数;R为气体摩尔常数8.314 J·K-1· mol-1;T为热力学温度,单位:K。
(1)298K时,合成氨反应______ (选填“能”或“不能”)自发进行,理由是___________ 。
(2)实验研究表明,特定条件下,合成氨反应的速率与参与反应的物质浓度的关系式为: ν=kc(N2)·c1.5(H2)·c-1(NH3),下列措施不能提高反应速率的是______ 。
A.适度增加氮气的浓度 B.适度增加氢气的浓度
C.及时将产物氨气分离出反应体系 D.适度提高反应温度
E.在低压下进行反应 F.加入铁催化剂
(3)T℃下,设反应N2(g)+3H2(g) 2NH3(g)的平衡常数为K,反应NH3(g)
2NH3(g)的平衡常数为K,反应NH3(g)
 N2(g)+
N2(g)+  H2(g)的平衡常数为
H2(g)的平衡常数为 ,则K与
,则K与 之间的关系是
之间的关系是________ 。298K时,合成氨反应的压力平衡常数Kp(298K )=______ (保留2位有效数字);向一恒定温度的刚性密闭容器中充入物质的量之比为1:1的N2和H2混合气体,初始压强为30MPa,在不同催化剂作用下反应,相同时间内H2的转化率随温度的变化如图所示,b点v正_____ v逆(填“>”、“<”或“=”)。图中a点混合气体平均相对分子质量为18.75,a点对应温度(T4)下反应的平衡常数Kp=______ (保留两位有效数字,Kp为以分压表示的平衡常数,分压=总压 物质的量分数),由此知T4
物质的量分数),由此知T4______ 298K,(选填“>”、“<”或“=”)。

(4)格哈德·埃特尔证实氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:

下列关于合成氨反应的叙述中错误的是________。
(5)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前要经过铜氨溶液处理以除去 CO,反应为:[Cu(NH3)2]2++CO+NH3 [Cu(NH3)3CO]2+ ΔH<0。
[Cu(NH3)3CO]2+ ΔH<0。
①铜氨溶液吸收CO的适宜生产条件是_________ 。
②吸收CO后的铜氨溶液经过适当处理再生,恢复其吸收 CO的能力,可循环使用,铜氨溶液再生的适宜条件是_________ 。
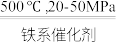 2NH3(g),298K时反应相关数据如表所示:
2NH3(g),298K时反应相关数据如表所示:| ΔH(kJ·mol-1) | -92.2 |
| ΔS(J·K-1·mol-1) | -198.2 |
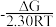 ,Kp为压力平衡常数;R为气体摩尔常数8.314 J·K-1· mol-1;T为热力学温度,单位:K。
,Kp为压力平衡常数;R为气体摩尔常数8.314 J·K-1· mol-1;T为热力学温度,单位:K。(1)298K时,合成氨反应
(2)实验研究表明,特定条件下,合成氨反应的速率与参与反应的物质浓度的关系式为: ν=kc(N2)·c1.5(H2)·c-1(NH3),下列措施不能提高反应速率的是
A.适度增加氮气的浓度 B.适度增加氢气的浓度
C.及时将产物氨气分离出反应体系 D.适度提高反应温度
E.在低压下进行反应 F.加入铁催化剂
(3)T℃下,设反应N2(g)+3H2(g)
 2NH3(g)的平衡常数为K,反应NH3(g)
2NH3(g)的平衡常数为K,反应NH3(g)
 N2(g)+
N2(g)+  H2(g)的平衡常数为
H2(g)的平衡常数为 ,则K与
,则K与 之间的关系是
之间的关系是 物质的量分数),由此知T4
物质的量分数),由此知T4
(4)格哈德·埃特尔证实氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:

下列关于合成氨反应的叙述中错误的是________。
| A.过程表明在化学反应中存在化学键的断裂与形成 |
| B.催化剂能改变化学反应的历程,使反应物化学键更易断裂,活化分子百分比增多 |
| C.过程①③④会放出能量,过程②需吸收能量 |
| D.常温下该反应难以进行,是因为常温下生成物的化学键难以形成 |
(5)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前要经过铜氨溶液处理以除去 CO,反应为:[Cu(NH3)2]2++CO+NH3
 [Cu(NH3)3CO]2+ ΔH<0。
[Cu(NH3)3CO]2+ ΔH<0。①铜氨溶液吸收CO的适宜生产条件是
②吸收CO后的铜氨溶液经过适当处理再生,恢复其吸收 CO的能力,可循环使用,铜氨溶液再生的适宜条件是
您最近半年使用:0次
名校
解题方法
6 . 我国某科研团队研究了氧化铈( )表面空间受阻路易斯酸碱对(FLPs)和氮(N)掺杂的协同作用,促进了光吸收、
)表面空间受阻路易斯酸碱对(FLPs)和氮(N)掺杂的协同作用,促进了光吸收、 成键活化,提高了光催化还原
成键活化,提高了光催化还原 制
制 的产率和选择性。反应历程如图所示。已知:*代表吸附在催化剂表面的物种,+代表起始或终态物质;自由能与相对能量相当。下列叙述错误的是
的产率和选择性。反应历程如图所示。已知:*代表吸附在催化剂表面的物种,+代表起始或终态物质;自由能与相对能量相当。下列叙述错误的是
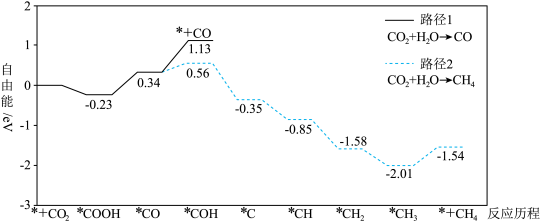
 )表面空间受阻路易斯酸碱对(FLPs)和氮(N)掺杂的协同作用,促进了光吸收、
)表面空间受阻路易斯酸碱对(FLPs)和氮(N)掺杂的协同作用,促进了光吸收、 成键活化,提高了光催化还原
成键活化,提高了光催化还原 制
制 的产率和选择性。反应历程如图所示。已知:*代表吸附在催化剂表面的物种,+代表起始或终态物质;自由能与相对能量相当。下列叙述错误的是
的产率和选择性。反应历程如图所示。已知:*代表吸附在催化剂表面的物种,+代表起始或终态物质;自由能与相对能量相当。下列叙述错误的是
| A.*COH→*C是路径2的决速步 | B.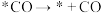 过程中自由能升高 过程中自由能升高 |
C.CO为光催化还原 制 制 的副产物 的副产物 | D.同等条件下,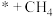 比 比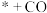 稳定 稳定 |
您最近半年使用:0次
2024-02-05更新
|
102次组卷
|
3卷引用:湖南省张家界市2023-2024学年高三上学期期末联考化学试题
名校
解题方法
7 . 肼( )及其衍生物的合成与利用具有重要意义。
)及其衍生物的合成与利用具有重要意义。
(1)“肼合成酶”以其中的 “配合物为催化中心,可将
“配合物为催化中心,可将 与
与 转化为肼,其反应历程如图所示。
转化为肼,其反应历程如图所示。
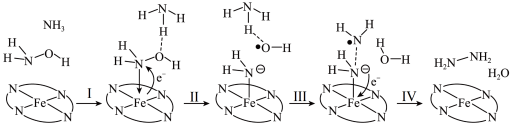
上图所示的反应步骤Ⅱ中Fe元素化合价的变化可描述为___________ 。
②将 替换为
替换为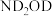 ,反应所得产物的化学式为
,反应所得产物的化学式为___________ 。
(2)在碱性条件下,水合肼( )在催化剂Rh(铑)g-
)在催化剂Rh(铑)g- 作用下发生如下分解反应:
作用下发生如下分解反应:
反应Ⅰ: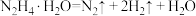
反应Ⅱ: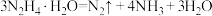
转化频率(TOF)能反映催化剂的性能。
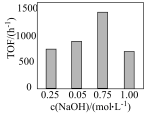
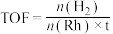 (t为反应时间),保持温度不变,相同时间内反应中不同
(t为反应时间),保持温度不变,相同时间内反应中不同 对应的TOF如图所示。
对应的TOF如图所示。
①催化剂载体g- 可由三聚氰胺(
可由三聚氰胺(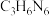 )在空气中焙烧得到。已知
)在空气中焙烧得到。已知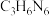 具有六元环结构,其结构简式可表示为
具有六元环结构,其结构简式可表示为___________ 。
②TOF随 变化的原因是
变化的原因是___________ 。
(3)相同条件下,测得 诱导肼、甲肼(
诱导肼、甲肼(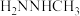 )和偏二甲肼[
)和偏二甲肼[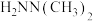 ]低温反应(均为吸热反应)产物与反应物能量差
]低温反应(均为吸热反应)产物与反应物能量差 、反应速率常数k值(k越大,反应越快)如下表。
、反应速率常数k值(k越大,反应越快)如下表。
①请补充上表所缺反应产物的结构简式___________ 。
②相较甲肼而言,肼、偏二甲肼与 的反应效果不佳的原因分别是
的反应效果不佳的原因分别是___________ 。
(4)液态肼也可以作为燃料电池,如图一种肼燃料电池,写成负极的电极反应___________ 。

 )及其衍生物的合成与利用具有重要意义。
)及其衍生物的合成与利用具有重要意义。(1)“肼合成酶”以其中的
 “配合物为催化中心,可将
“配合物为催化中心,可将 与
与 转化为肼,其反应历程如图所示。
转化为肼,其反应历程如图所示。
上图所示的反应步骤Ⅱ中Fe元素化合价的变化可描述为
②将
 替换为
替换为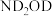 ,反应所得产物的化学式为
,反应所得产物的化学式为(2)在碱性条件下,水合肼(
 )在催化剂Rh(铑)g-
)在催化剂Rh(铑)g- 作用下发生如下分解反应:
作用下发生如下分解反应:反应Ⅰ:
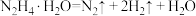
反应Ⅱ:
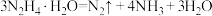
转化频率(TOF)能反映催化剂的性能。
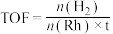 (t为反应时间),保持温度不变,相同时间内反应中不同
(t为反应时间),保持温度不变,相同时间内反应中不同 对应的TOF如图所示。
对应的TOF如图所示。
①催化剂载体g-
 可由三聚氰胺(
可由三聚氰胺(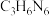 )在空气中焙烧得到。已知
)在空气中焙烧得到。已知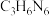 具有六元环结构,其结构简式可表示为
具有六元环结构,其结构简式可表示为②TOF随
 变化的原因是
变化的原因是(3)相同条件下,测得
 诱导肼、甲肼(
诱导肼、甲肼(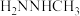 )和偏二甲肼[
)和偏二甲肼[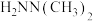 ]低温反应(均为吸热反应)产物与反应物能量差
]低温反应(均为吸热反应)产物与反应物能量差 、反应速率常数k值(k越大,反应越快)如下表。
、反应速率常数k值(k越大,反应越快)如下表。| 燃料 | 反应产物 |  | k值 |
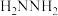 | 5.73 | 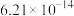 | |
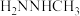 | 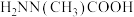 | 14.15 | 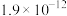 |
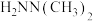 |  | 47.81 | - |
②相较甲肼而言,肼、偏二甲肼与
 的反应效果不佳的原因分别是
的反应效果不佳的原因分别是(4)液态肼也可以作为燃料电池,如图一种肼燃料电池,写成负极的电极反应

您最近半年使用:0次
名校
解题方法
8 . 化学与生产、生活密切相关。下列事实与化学反应速率无关的是
| A.食品中添加适量的防腐剂 | B.医护人员冷藏存放“新冠”疫苗 |
| C.食盐中添加碘酸钾 | D.工业矿石冶炼前先将矿石粉碎 |
您最近半年使用:0次
2024-01-23更新
|
207次组卷
|
3卷引用:四川省眉山市青神中学校2023-2024学年高二上学期1月期末化学试题
解题方法
9 . 回答下列问题。
Ⅰ.某实验小组用 100mL0.50mol·L-1NaOH 溶液与 60mL0.50mol·L-1 硫酸溶液进行中和热的测定,装置如图1所示。回答下列问题:
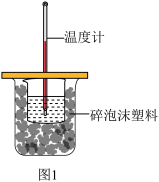
(1)图中装置缺少的仪器是___________ 。
(2)硫酸稍过量的原因是___________ 。
(3)某小组同学实验数据记录如下表,若近似认为 0.50mol•L-1NaOH 溶液与 0.50mol•L-1硫酸溶液的密度都是1g•cm-3,中和后生成溶液的比热容 c=4.18J•g-1•℃-1,则上述实验测得的中和热△H =___________ (结果保留至小数点后一位)。
(4)上述实验测得中和热的数值小于 57.3kJ·mol-1,产生偏差的原因可能是___________(填字母)。
Ⅱ.甲、乙两位同学探究外界条件对化学反应速率的影响。
【实验原理】反应:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,反应过程中溶液出现乳白色浑浊和有刺激性气味的 气体。
【实验用品】0.1mol/LNa2S2O3溶液、0.1mol/LH2SO4溶液、蒸馏水、试管、烧杯、量筒、胶头滴管等。
实验一:甲同学利用如图装置测定化学反应速率。
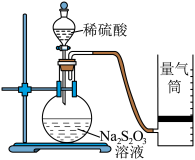
(5)为保证实验的准确性和可靠性,利用该装置进行实验前应先进行的操作是___________ 。除如图所示的实验用品外,还需要的实验仪器 是___________ 。
(6)若在 2min 时收集到 224mL(已折算成标准状况)气体,可计算出在 2min 内的反应速率v(H+)=0.02mol/(L·min),而该速率值比实际值偏小,其原因是_____________________ 。
实验二:乙同学得到各组实验数据如下表。
(7)实验Ⅰ、Ⅱ探究___________ 对化学反应速率的影响,a=___________ ,V=___________ 。
(8)实验Ⅱ、Ⅲ探究温度对化学反应速率的影响。实验表明,实验Ⅲ的反应速率最快,支持这一结论的实验现象是___________ 。
Ⅰ.某实验小组用 100mL0.50mol·L-1NaOH 溶液与 60mL0.50mol·L-1 硫酸溶液进行中和热的测定,装置如图1所示。回答下列问题:

(1)图中装置缺少的仪器是
(2)硫酸稍过量的原因是
(3)某小组同学实验数据记录如下表,若近似认为 0.50mol•L-1NaOH 溶液与 0.50mol•L-1硫酸溶液的密度都是1g•cm-3,中和后生成溶液的比热容 c=4.18J•g-1•℃-1,则上述实验测得的中和热△H =
| 实验序号 | 起始温度t1/℃ | 终止温度T2/℃ | 平均温度差(t2-t1)/℃ | ||
| HCl | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | _____ |
| 2 | 27.0 | 27.2 | 27.1 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
| A.量取 NaOH 溶液时仰视读数 |
| B.为了使反应充分,向酸溶液中分次加入碱溶液 |
| C.实验装置保温隔热效果差 |
| D.用铜丝代替玻璃搅拌器搅拌 |
Ⅱ.甲、乙两位同学探究外界条件对化学反应速率的影响。
【实验原理】反应:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,反应过程中溶液出现乳白色浑浊和有刺激性气味的 气体。
【实验用品】0.1mol/LNa2S2O3溶液、0.1mol/LH2SO4溶液、蒸馏水、试管、烧杯、量筒、胶头滴管等。
实验一:甲同学利用如图装置测定化学反应速率。

(5)为保证实验的准确性和可靠性,利用该装置进行实验前应先进行的操作是
(6)若在 2min 时收集到 224mL(已折算成标准状况)气体,可计算出在 2min 内的反应速率v(H+)=0.02mol/(L·min),而该速率值比实际值偏小,其原因是
实验二:乙同学得到各组实验数据如下表。
| 实验编号 | Na2S2O3溶液 | H2SO4溶液 | 蒸馏水 | |||
| 浓度/(mol/L) | 体积/mL | 浓度/(mol/L) | 体积/mL | 体积/mL | 温度/℃ | |
| I | 0.1 | 3.0 | 0.1 | 3.0 | V | 20 |
| Ⅱ | 0.1 | 5.0 | 0.1 | 3.0 | 0 | a |
| Ⅲ | 0.1 | 5.0 | 0.1 | 3.0 | 0 | 30 |
(8)实验Ⅱ、Ⅲ探究温度对化学反应速率的影响。实验表明,实验Ⅲ的反应速率最快,支持这一结论的实验现象是
您最近半年使用:0次
2023高三·全国·专题练习
解题方法
10 . 已知2SO2(g)+O2(g) 2SO3(g) ΔH<0的实验数据如下表:
2SO3(g) ΔH<0的实验数据如下表:
(1)应选择的温度是___________ ,理由是___________ 。
(2)应采用的压强是___________ ,理由是___________ 。
(3)生产中通入过量空气的目的是___________ 。
 2SO3(g) ΔH<0的实验数据如下表:
2SO3(g) ΔH<0的实验数据如下表:| 温度 | 不同压强下SO2的转化率(%) | ||||
| 1×105 Pa | 5×105 Pa | 1×106 Pa | 5×106 Pa | 1×107 Pa | |
| 450 ℃ | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550 ℃ | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
(2)应采用的压强是
(3)生产中通入过量空气的目的是
您最近半年使用:0次



