解题方法
1 . 研究发现,大多数化学反应并不是经过简单碰撞就能完成的,而往往经过多个反应步骤才能实现。碘钟反应是一种化学振荡反应,其体现了化学动力学的原理。某小组同学在室温下对某“碘钟实验”的原理进行探究。
资料:该“碘钟实验”反应分A、B两步进行:
反应A: (慢)
(慢)
反应B: (快)
(快)
(1)该“碘钟实验”的总反应是___ 。
(2)为证明反应A、B的存在,进行实验Ⅰ。
a.向K2S2O8溶液中加入试剂X的水溶液,溶液变为蓝色。
b.再向得到的蓝色溶液中加入试剂Y溶液,溶液的蓝色褪去。
试剂X是___ 、试剂Y是___ 。
(3)已知A反应的速率方程为: (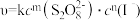 ),式中k为常数。为确定m、n值进行实验II。(溶液浓度均为0.01mol/L)
),式中k为常数。为确定m、n值进行实验II。(溶液浓度均为0.01mol/L)
①表中V1=__ mL,理由是___ ;
②通过数据计算得知:m=___ ,n=___ 。
(4)为探究其他因素对该“碘钟实验”的影响,进行实验III。(溶液浓度均为0.01mol/L)
实验过程中,溶液始终无明显颜色变化。
试结合该“碘钟实验”总反应方程式及反应A与反应B速率的相对快慢关系,解释实验III未产生颜色变化的原因:___ 。
资料:该“碘钟实验”反应分A、B两步进行:
反应A:
 (慢)
(慢)反应B:
 (快)
(快)(1)该“碘钟实验”的总反应是
(2)为证明反应A、B的存在,进行实验Ⅰ。
a.向K2S2O8溶液中加入试剂X的水溶液,溶液变为蓝色。
b.再向得到的蓝色溶液中加入试剂Y溶液,溶液的蓝色褪去。
试剂X是
(3)已知A反应的速率方程为: (
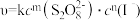 ),式中k为常数。为确定m、n值进行实验II。(溶液浓度均为0.01mol/L)
),式中k为常数。为确定m、n值进行实验II。(溶液浓度均为0.01mol/L)| 实验 序号 | 试剂体积V/mL | 显色时间 t/s | ||||
| K2S2O8溶液 | KI溶液 | 水 | Na2S2O3溶液 | 淀粉溶液 | ||
| ① | 10 | 10 | 0 | 4 | 1 | 27.0 |
| ② | 5 | 10 | 5 | 4 | 1 | 54.0 |
| ③ | 2.5 | 10 | V1 | 4 | 1 | 108.0 |
| ④ | 10 | 5 | 5 | 4 | 1 | 54.0 |
②通过数据计算得知:m=
(4)为探究其他因素对该“碘钟实验”的影响,进行实验III。(溶液浓度均为0.01mol/L)
| 试剂体积V/mL | ||||
| K2S2O8溶液 | KI溶液 | 水 | Na2S2O3溶液 | 淀粉溶液 |
| 10 | 5 | 3 | 6 | 1 |
试结合该“碘钟实验”总反应方程式及反应A与反应B速率的相对快慢关系,解释实验III未产生颜色变化的原因:
您最近半年使用:0次
2 . 某兴趣小组为探究外界条件对化学反应速率的影响,设计的实验方案如下:
(1)实验时发生反应的化学方程式为___ ;为了顺利观察到KMnO4紫色褪去,起始时需要满足n(H2C2O4):n(KMnO4)≥___ 。
(2)探究反应物浓度对反应速率影响的是实验___ (填编号,下同),探究反应温度对反应速率影响的是实验___ 。
(3)测得实验①中溶液褪色的时间为30s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=___ 。
(4)实验过程中发现:在开始反应的一段时间内,反应速率较小,溶液褪色不明显;但不久反应速率明显增大,溶液很快褪色。导致上述现象的原因可能是___ 。
(5)草酸又称乙二酸,是一种二元弱酸。写出草酸在水中的第一步电离方程式:___ ,该步电离的平衡常数表达式K1=___ 。
| 实验编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/(mol•L-1) | 体积/mL | 浓度/(mol•L-1) | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.01 | 3.0 | 25 |
| ② | 0.20 | 2.0 | 0.01 | 3.0 | 25 |
| ③ | 0.20 | 2.0 | 0.01 | 3.0 | 50 |
(1)实验时发生反应的化学方程式为
(2)探究反应物浓度对反应速率影响的是实验
(3)测得实验①中溶液褪色的时间为30s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=
(4)实验过程中发现:在开始反应的一段时间内,反应速率较小,溶液褪色不明显;但不久反应速率明显增大,溶液很快褪色。导致上述现象的原因可能是
(5)草酸又称乙二酸,是一种二元弱酸。写出草酸在水中的第一步电离方程式:
您最近半年使用:0次
名校
解题方法
3 . 硫酸是中学最常见的三大强酸之一,某研究性学习小组探究外界条件对铁与硫酸反应速率的影响。
[实验设计]控制用同种铁块,初始使用硫酸体积均为1000mL,恒定实验温度在298K或313K(其余实验条件见表),设计如下对比试验。
(1)请完成以下实验设计表(表中不要留空格)。
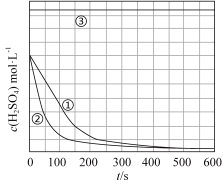
[解释与结论]
(2)实验①、②表明___________
请再提出一种加快该反应速率的方法___________
(3)实验③得出的结论是:当硫酸浓度为18.4 mol/L,________ ,原因是__________
[思考与交流]
(4)实验③,若t1时开始加热,在铁的表面逐渐产生气泡,当有大量气泡产生时,控制反应温度基本不变。甲同学将收集到的气体体积与时间的关系粗略地表示为图2。t1~t2时间段,反应生成的气体是_________ 。写出开始加热时发生反应的化学方程式:___ 。

[实验设计]控制用同种铁块,初始使用硫酸体积均为1000mL,恒定实验温度在298K或313K(其余实验条件见表),设计如下对比试验。
(1)请完成以下实验设计表(表中不要留空格)。
| 实验 编号 | 实验目的 | T/K | Fe/g | c(H2SO4)/ mol·L-1 |
| ① | 为以下实验作参考 | 298 | 10 | 1.0 |
| ② | 探究温度对反应速率的影响 | |||
| ③ | 298 | 10 | 18.4 |

[解释与结论]
(2)实验①、②表明
请再提出一种加快该反应速率的方法
(3)实验③得出的结论是:当硫酸浓度为18.4 mol/L,
[思考与交流]
(4)实验③,若t1时开始加热,在铁的表面逐渐产生气泡,当有大量气泡产生时,控制反应温度基本不变。甲同学将收集到的气体体积与时间的关系粗略地表示为图2。t1~t2时间段,反应生成的气体是

您最近半年使用:0次
名校
解题方法
4 . 下列人们在生活、生产、实验的相关措施中。不是用来调控化学反应速率的是
| A.将食物存放在温度较低的地方 |
| B.火力发电厂将烟囱建的很高 |
| C.实验时,通常将颗粒状的固体药品研细混匀后进行反应 |
| D.将固体试剂溶于水配成溶液后再进行化学实验 |
您最近半年使用:0次
解题方法
5 . 某小组进行实验:向硫酸酸化的过氧化氢溶液中加入碘化钾、淀粉和硫代硫酸钠的混合溶液,一段时间后溶液变蓝。查阅资料知体系中存在两个主要反应:
反应i:H2O2(aq)+2I-(aq)+2H+(aq)=I2(aq)+2H2O(l)△H1=-247.5kJ·mol-1
反应ii:I2(aq)+2S2O (aq)=2I-(aq)+S4O
(aq)=2I-(aq)+S4O (aq)△H2=-1021.6kJ·mol-1
(aq)△H2=-1021.6kJ·mol-1
(1)H2O2与S2O 反应的热化学方程式为
反应的热化学方程式为___ 。
(2)下列实验方案可证实上述反应过程。
将实验方案补充完整(所用试剂浓度均为0.01mol·L-1)。
①向酸化的H2O2溶液中加入___ 溶液,溶液几秒后变为蓝色。
②向①中蓝色溶液中加入___ 溶液,溶液立即褪色。
(3)探究c(H+)对反应速率的影响,实验方案如表所示。(所用试剂除H2O以外,浓度均为0.01mol·L-1)
①将实验b补充完整,X=___ 、Q=___ 。
②对比实验a和实验b,t1___ (填“>”或“<”)t2。
③结合(2)中现象解释溶液混合后一段时间才变蓝的原因:___ 。
④利用实验a的数据,计算t1时间内H2O2与S2O 反应的平均反应速率(用H2O2浓度的变化表示),
反应的平均反应速率(用H2O2浓度的变化表示),___ mol·L-1·s-1。
反应i:H2O2(aq)+2I-(aq)+2H+(aq)=I2(aq)+2H2O(l)△H1=-247.5kJ·mol-1
反应ii:I2(aq)+2S2O
 (aq)=2I-(aq)+S4O
(aq)=2I-(aq)+S4O (aq)△H2=-1021.6kJ·mol-1
(aq)△H2=-1021.6kJ·mol-1(1)H2O2与S2O
 反应的热化学方程式为
反应的热化学方程式为(2)下列实验方案可证实上述反应过程。
将实验方案补充完整(所用试剂浓度均为0.01mol·L-1)。
①向酸化的H2O2溶液中加入
②向①中蓝色溶液中加入
(3)探究c(H+)对反应速率的影响,实验方案如表所示。(所用试剂除H2O以外,浓度均为0.01mol·L-1)
实验序号 | a | b | |
试剂 | H2O2/mL | 4.5 | X |
| H2SO4/mL | 4.5 | 2 | |
| Na2S2O3/mL | 8 | Y | |
| KI(含淀粉)/mL | 3 | Z | |
| H2O/mL | 0 | Q | |
| 将上述溶液迅速混合现象 | 溶液变蓝所需时间为t1秒 | 溶液变蓝所需时间为t2秒 | |
②对比实验a和实验b,t1
③结合(2)中现象解释溶液混合后一段时间才变蓝的原因:
④利用实验a的数据,计算t1时间内H2O2与S2O
 反应的平均反应速率(用H2O2浓度的变化表示),
反应的平均反应速率(用H2O2浓度的变化表示),
您最近半年使用:0次
2020-11-06更新
|
109次组卷
|
3卷引用:河南省豫南九校2020-2021学年高二上学期第二次联考化学试题
名校
6 . 处理、回收CO是环境科学家研究的热点课题。CO用于处理大气污染物N2O,发生的反应为:N2O(g)+CO(g)  CO2(g)+N2(g) ΔH=-365 kJ·mol-1。上述反应可用“Fe+”作催化剂,其总反应分两步进行:
CO2(g)+N2(g) ΔH=-365 kJ·mol-1。上述反应可用“Fe+”作催化剂,其总反应分两步进行:
第一步:Fe++N2O=FeO++N2;
第二步:FeO++CO=Fe++CO2,第二步反应不影响总反应达到平衡所用的时间。
下列说法中正确的是
 CO2(g)+N2(g) ΔH=-365 kJ·mol-1。上述反应可用“Fe+”作催化剂,其总反应分两步进行:
CO2(g)+N2(g) ΔH=-365 kJ·mol-1。上述反应可用“Fe+”作催化剂,其总反应分两步进行:第一步:Fe++N2O=FeO++N2;
第二步:FeO++CO=Fe++CO2,第二步反应不影响总反应达到平衡所用的时间。
下列说法中正确的是
| A.FeO+也是该反应的催化剂 |
| B.第一步中Fe+与N2O的碰撞仅部分有效 |
| C.第二步反应速率大于第一步反应速率 |
| D.增大CO的浓度可显著增大处理N2O的反应速率 |
您最近半年使用:0次
2020-11-05更新
|
210次组卷
|
2卷引用:湖北省四地六校2020-2021学年高二上学期联合考试化学试题
名校
解题方法
7 . 下列反应条件的改变对4Fe+3O2+xH2O=2Fe2O3·xH2O速率的影响不正确的是
| A.增大O2的浓度能加快生锈速率 | B.潮湿环境中铁生锈的速率更快 |
| C.升高温度能加快生锈速率 | D.干燥空气中铁生锈速率更快 |
您最近半年使用:0次
2020-11-02更新
|
257次组卷
|
3卷引用:江苏省徐州市沛县2020-2021学年高二上学期第一次学情调研化学(必修)试题
2020高三·全国·专题练习
解题方法
8 . 以下是几位同学在学习化学反应速率理论后发表的一些看法,其中不正确的是( )
| A.化学反应速率理论可指导怎样提高原料的转化率和生成物的产率 |
| B.化学反应速率理论可以指导怎样在一定时间内快出产品 |
| C.影响化学反应速率的主要因素是反应物的性质,浓度、温度、催化剂、反应物颗粒大小等外部因素也会对化学反应速率产生影响 |
| D.正确利用化学反应速率理论可提高化工生产的综合经济效益 |
您最近半年使用:0次
名校
9 . 下列生产生活中需要增大化学反应速率的是
A.铁桥生锈 | B.牛奶变质 | C.塑料老化 | D.高炉炼铁 |
您最近半年使用:0次
2020-10-10更新
|
533次组卷
|
13卷引用:河北省邢台市2017-2018学年高二上学期第一次月考化学试题
河北省邢台市2017-2018学年高二上学期第一次月考化学试题河北省承德市联校2017-2018学年高二上学期期末考试化学试题云南省昆明市黄冈实验学校2017-2018学年高一下学期第三次月考化学试题新疆维吾尔自治区昌吉市第九中学2018-2019学年高二上学期期末考试化学试题甘肃省永昌四中2019-2020学年高二上学期期中考试化学试题四川省广安市北京师范大学广安实验学校2020-2021学年高二上学期9月月考化学试题人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第一节 化学反应速率河北省邢台市2020-2021学年高二上学期第一次9月联考化学试题陕西省黄陵中学2020-2021学年高二(本部)上学期期中考试化学试题重庆市第七中学校2020-2021学年高二上学期12月考化学试题甘肃省静宁县第一中学2021-2022学年高二上学期第一次月考(普通班)化学试题陕西省泾阳县2020-2021学年高二上学期期中考试化学试题天津市第三中学2022-2023学年高二上学期期中考试化学试题
20-21高二·全国·单元测试
10 . 下列各图所反映的措施中,目的是为了加快其化学反应速率的是
| A | B | C | D |
 |  |  |  |
| 铁门表面喷漆 | 冰箱保存食物 | 扇子扇煤炉火 | 烤焦电线杆生成焦炭 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次



