名校
解题方法
1 . 工业合成氨对粮食增产、增加人口具重要价值。1913年,Haber-Bosch发明的催化合成氨技术实现了工业化生产:N2(g)+3H2(g)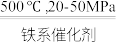 2NH3(g),298K时反应相关数据如表所示:
2NH3(g),298K时反应相关数据如表所示:
已知:化学反应吉布斯自由能变化量ΔG=ΔH -TΔS (通常温度区间,ΔH和ΔS可视为常量),ΔG与压力平衡常数Kp的关系为:lgKp = 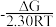 ,Kp为压力平衡常数;R为气体摩尔常数8.314 J·K-1· mol-1;T为热力学温度,单位:K。
,Kp为压力平衡常数;R为气体摩尔常数8.314 J·K-1· mol-1;T为热力学温度,单位:K。
(1)298K时,合成氨反应______ (选填“能”或“不能”)自发进行,理由是___________ 。
(2)实验研究表明,特定条件下,合成氨反应的速率与参与反应的物质浓度的关系式为: ν=kc(N2)·c1.5(H2)·c-1(NH3),下列措施不能提高反应速率的是______ 。
A.适度增加氮气的浓度 B.适度增加氢气的浓度
C.及时将产物氨气分离出反应体系 D.适度提高反应温度
E.在低压下进行反应 F.加入铁催化剂
(3)T℃下,设反应N2(g)+3H2(g) 2NH3(g)的平衡常数为K,反应NH3(g)
2NH3(g)的平衡常数为K,反应NH3(g)
 N2(g)+
N2(g)+  H2(g)的平衡常数为
H2(g)的平衡常数为 ,则K与
,则K与 之间的关系是
之间的关系是________ 。298K时,合成氨反应的压力平衡常数Kp(298K )=______ (保留2位有效数字);向一恒定温度的刚性密闭容器中充入物质的量之比为1:1的N2和H2混合气体,初始压强为30MPa,在不同催化剂作用下反应,相同时间内H2的转化率随温度的变化如图所示,b点v正_____ v逆(填“>”、“<”或“=”)。图中a点混合气体平均相对分子质量为18.75,a点对应温度(T4)下反应的平衡常数Kp=______ (保留两位有效数字,Kp为以分压表示的平衡常数,分压=总压 物质的量分数),由此知T4
物质的量分数),由此知T4______ 298K,(选填“>”、“<”或“=”)。

(4)格哈德·埃特尔证实氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:

下列关于合成氨反应的叙述中错误的是________。
(5)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前要经过铜氨溶液处理以除去 CO,反应为:[Cu(NH3)2]2++CO+NH3 [Cu(NH3)3CO]2+ ΔH<0。
[Cu(NH3)3CO]2+ ΔH<0。
①铜氨溶液吸收CO的适宜生产条件是_________ 。
②吸收CO后的铜氨溶液经过适当处理再生,恢复其吸收 CO的能力,可循环使用,铜氨溶液再生的适宜条件是_________ 。
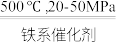 2NH3(g),298K时反应相关数据如表所示:
2NH3(g),298K时反应相关数据如表所示:| ΔH(kJ·mol-1) | -92.2 |
| ΔS(J·K-1·mol-1) | -198.2 |
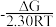 ,Kp为压力平衡常数;R为气体摩尔常数8.314 J·K-1· mol-1;T为热力学温度,单位:K。
,Kp为压力平衡常数;R为气体摩尔常数8.314 J·K-1· mol-1;T为热力学温度,单位:K。(1)298K时,合成氨反应
(2)实验研究表明,特定条件下,合成氨反应的速率与参与反应的物质浓度的关系式为: ν=kc(N2)·c1.5(H2)·c-1(NH3),下列措施不能提高反应速率的是
A.适度增加氮气的浓度 B.适度增加氢气的浓度
C.及时将产物氨气分离出反应体系 D.适度提高反应温度
E.在低压下进行反应 F.加入铁催化剂
(3)T℃下,设反应N2(g)+3H2(g)
 2NH3(g)的平衡常数为K,反应NH3(g)
2NH3(g)的平衡常数为K,反应NH3(g)
 N2(g)+
N2(g)+  H2(g)的平衡常数为
H2(g)的平衡常数为 ,则K与
,则K与 之间的关系是
之间的关系是 物质的量分数),由此知T4
物质的量分数),由此知T4
(4)格哈德·埃特尔证实氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:

下列关于合成氨反应的叙述中错误的是________。
| A.过程表明在化学反应中存在化学键的断裂与形成 |
| B.催化剂能改变化学反应的历程,使反应物化学键更易断裂,活化分子百分比增多 |
| C.过程①③④会放出能量,过程②需吸收能量 |
| D.常温下该反应难以进行,是因为常温下生成物的化学键难以形成 |
(5)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前要经过铜氨溶液处理以除去 CO,反应为:[Cu(NH3)2]2++CO+NH3
 [Cu(NH3)3CO]2+ ΔH<0。
[Cu(NH3)3CO]2+ ΔH<0。①铜氨溶液吸收CO的适宜生产条件是
②吸收CO后的铜氨溶液经过适当处理再生,恢复其吸收 CO的能力,可循环使用,铜氨溶液再生的适宜条件是
您最近半年使用:0次
20-21高三下·浙江·阶段练习
2 . 合成氨工业是人工固氮的重要途径,氨气是工农业生产中的重要物质。请回答以下问题:
(1)下列说法不正确的是___________
A.实验室制备氨气时,可以用CaCl2固体干燥氨气
B.在浓氨水中加入生石灰可制备少量氨气
C.合成氨塔中,需要有热交换装置,便于能量的有效利用
D.合成氨工业中,可将氨气液化,并不断将液氨移去,利于提高NH3的产率
(2)氨是制取硝酸的重要原料。氨的催化氧化过程主要有以下两个反应:
I.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔHI
4NO(g)+6H2O(g) ΔHI
II.4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ΔHII
2N2(g)+6H2O(g) ΔHII
不同温度下氨氧化的平衡常数如下(p=0.1013Mpa):
①下列说法正确的是___________
A.ΔHI>0,ΔHII>0
B.如果对反应不加控制,氨和氧气反应的最终产物主要是N2
C.为使反应有利于朝生成更多的NO方向进行,不必关注热力学问题(平衡移动问题),需要关注动力学问题(反应速率问题)
D.在实际生产中,需采用高压氧化,以利于提高NO的产率
E.反应中需控制氨氧比、选择性催化剂的形状、气固相接触时间等
②在实际工业生产中,温度一般需要在750℃~850℃左右,其主要原因是___________
(3)已知可通过下列方法合成尿素:
第一步:2NH3(1)+CO2(g) H2NCOONH4(1) ΔH=-159.5kJ/mol
H2NCOONH4(1) ΔH=-159.5kJ/mol
第二步:H2NCOONH4(1) CO(NH2)2(1)+H2O(1) ΔH=+28.5kJ/mol
CO(NH2)2(1)+H2O(1) ΔH=+28.5kJ/mol
在体积为5L的密闭容器中加入1molCO2和4molNH3,在一定条件下反应进行到10min时,测得CO2和尿素的物质的量均为0.25mol,如图所示。
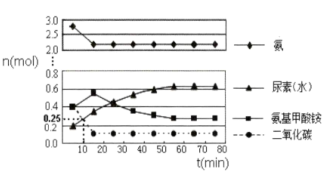
①若用单位时间内物质的量的变化来表示固体或纯液体的反应速率,则10min内第一步反应中生成H2NCOONH4(1)[氨基甲酸铵]的平均反应速率为___________
②反应进行15分钟后,随着时间的变化,尿素和氨基甲酸铵的物质的量变化比较明显,但氨气和二氧化碳的变化很小,其主要原因是___________ 。
(1)下列说法不正确的是
A.实验室制备氨气时,可以用CaCl2固体干燥氨气
B.在浓氨水中加入生石灰可制备少量氨气
C.合成氨塔中,需要有热交换装置,便于能量的有效利用
D.合成氨工业中,可将氨气液化,并不断将液氨移去,利于提高NH3的产率
(2)氨是制取硝酸的重要原料。氨的催化氧化过程主要有以下两个反应:
I.4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) ΔHI
4NO(g)+6H2O(g) ΔHIII.4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) ΔHII
2N2(g)+6H2O(g) ΔHII不同温度下氨氧化的平衡常数如下(p=0.1013Mpa):
| 温度(℃) | 300 | 500 | 700 | 900 | 1100 |
| 反应I(KI) | 6.3×1041 | 1.1×1026 | 2.1×1019 | 3.8×1015 | 3.4×1011 |
| 反应II(KII) | 7.3×1056 | 7.1×1034 | 2.6×1025 | 1.5×1020 | 6.7×1016 |
A.ΔHI>0,ΔHII>0
B.如果对反应不加控制,氨和氧气反应的最终产物主要是N2
C.为使反应有利于朝生成更多的NO方向进行,不必关注热力学问题(平衡移动问题),需要关注动力学问题(反应速率问题)
D.在实际生产中,需采用高压氧化,以利于提高NO的产率
E.反应中需控制氨氧比、选择性催化剂的形状、气固相接触时间等
②在实际工业生产中,温度一般需要在750℃~850℃左右,其主要原因是
(3)已知可通过下列方法合成尿素:
第一步:2NH3(1)+CO2(g)
 H2NCOONH4(1) ΔH=-159.5kJ/mol
H2NCOONH4(1) ΔH=-159.5kJ/mol第二步:H2NCOONH4(1)
 CO(NH2)2(1)+H2O(1) ΔH=+28.5kJ/mol
CO(NH2)2(1)+H2O(1) ΔH=+28.5kJ/mol在体积为5L的密闭容器中加入1molCO2和4molNH3,在一定条件下反应进行到10min时,测得CO2和尿素的物质的量均为0.25mol,如图所示。

①若用单位时间内物质的量的变化来表示固体或纯液体的反应速率,则10min内第一步反应中生成H2NCOONH4(1)[氨基甲酸铵]的平均反应速率为
②反应进行15分钟后,随着时间的变化,尿素和氨基甲酸铵的物质的量变化比较明显,但氨气和二氧化碳的变化很小,其主要原因是
您最近半年使用:0次



