解题方法
1 . 某化学小组为了研究外界条件对化学反应速率的影响,进行了酸性高锰酸钾与草酸的反应,记录以下实验数据(已知 为阿伏加 德罗常数的值):
为阿伏加 德罗常数的值):
(1)请写出该反应的离子方程式:___ ,当该反应以实验①中数据反应完全时转移电子数为_____  。
。
(2)实验①②是探究浓度对反应速率的影响,实验②③时探究温度对反应速率的影响,则表中V1=_______ ,V2=__________ 。
(3)根据实验①、②的数据,可以得到的结论是____ 。
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示。
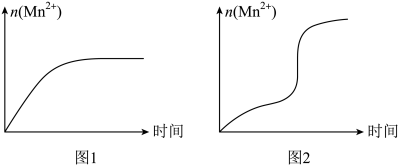
该小组同学根据上述信息提出了新的假设,并设计一下实验方案继续进行实验探究。
①该小组同学提出的新假设是__________ 。
②若该小组同学提出的假设成立,应观察到__________ (填实验现象)。
 为阿伏加 德罗常数的值):
为阿伏加 德罗常数的值):| 试管中所加试剂及其用量/mL | 溶液退至无色所需时间/min | |||||
| 实验编号 | 实验温度/℃ | 0.6 mol/LH2C2O4溶液 | H2O | 3 mol/LH2SO4溶液 | 0.05 mol/LKMnO4溶液 | |
| ① | 25 | 3.0 | v1 | 2.0 | 3.0 | 1.5 |
| ② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
| ③ | 50 | 2.0 | v2 | 2.0 | 3.0 | 1.0 |
 。
。(2)实验①②是探究浓度对反应速率的影响,实验②③时探究温度对反应速率的影响,则表中V1=
(3)根据实验①、②的数据,可以得到的结论是
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示。

该小组同学根据上述信息提出了新的假设,并设计一下实验方案继续进行实验探究。
| 实验编号 | 实验温度/℃ | 试管中所加试剂及其用量/ml | 再加入某种固体 | 溶液退至无色所需时间/min | |||
| 0.6 mol/LH2C2O4溶液 | H2O | 3 mol/LH2SO4溶液 | 0.05 mol/L KMnO4 溶液 | ||||
| ④ | 25 | 3.0 | 2.0 | 2.0 | 3.0 | MnSO4 | t |
②若该小组同学提出的假设成立,应观察到
您最近半年使用:0次
解题方法
2 . 某研究性学习小组向一定量的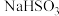 溶液(加入少量淀粉)中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝。为进一步研究有关因素对反应速率的影响,探究如下:
溶液(加入少量淀粉)中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝。为进一步研究有关因素对反应速率的影响,探究如下:
(1)查阅资料知: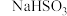 与过量KIO3反应分为两步进行,第一步反应的离子方程式为
与过量KIO3反应分为两步进行,第一步反应的离子方程式为 ,则第二步反应的离子方程式为
,则第二步反应的离子方程式为_______ ;分两步进行的反应,其反应速率主要由慢反应决定,所以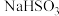 与过量KIO3反应中,慢反应是
与过量KIO3反应中,慢反应是_______ (填“第一步”或“第二步”)反应。
(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响记录如表:
实验①②是探究_______ 对反应速率的影响,表中t1_______ (填“>”、“=”或“<”)t2;实验②③是探究温度对反应速率的影响,表中a=_______ ,b=_______ 。
(3)将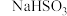 溶液与KIO3溶液在恒温条件下混合用速率检测仪检测出起始阶段反应速率逐渐增大。该小组对其原因提出假设,认为是生成的
溶液与KIO3溶液在恒温条件下混合用速率检测仪检测出起始阶段反应速率逐渐增大。该小组对其原因提出假设,认为是生成的 对反应起催化作用,故设计实验验证,试完成表中的内容。
对反应起催化作用,故设计实验验证,试完成表中的内容。
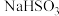 溶液(加入少量淀粉)中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝。为进一步研究有关因素对反应速率的影响,探究如下:
溶液(加入少量淀粉)中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝。为进一步研究有关因素对反应速率的影响,探究如下:(1)查阅资料知:
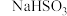 与过量KIO3反应分为两步进行,第一步反应的离子方程式为
与过量KIO3反应分为两步进行,第一步反应的离子方程式为 ,则第二步反应的离子方程式为
,则第二步反应的离子方程式为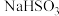 与过量KIO3反应中,慢反应是
与过量KIO3反应中,慢反应是(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响记录如表:
| 编号 | 0.01mol·L-1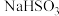 溶液/mL 溶液/mL | 0.01mol·L-1KIO3溶液/mL | H2O/mL | 反应温度/℃ | 液变蓝所用时间t/s |
| ① | 4.0 | 14.0 | 2.0 | 15 | t1 |
| ② | 6.0 | 14.0 | 0 | 15 | t2 |
| ③ | 6.0 | a | b | 25 | t3 |
(3)将
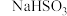 溶液与KIO3溶液在恒温条件下混合用速率检测仪检测出起始阶段反应速率逐渐增大。该小组对其原因提出假设,认为是生成的
溶液与KIO3溶液在恒温条件下混合用速率检测仪检测出起始阶段反应速率逐渐增大。该小组对其原因提出假设,认为是生成的 对反应起催化作用,故设计实验验证,试完成表中的内容。
对反应起催化作用,故设计实验验证,试完成表中的内容。| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
Ⅰ.在烧杯甲中将一定量的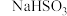 溶液与KIO3溶液混合,用速率检测仪测定起始时的反应速率v(甲) 溶液与KIO3溶液混合,用速率检测仪测定起始时的反应速率v(甲)Ⅱ.在烧杯乙中先加入少量 | 若v(甲) 若以(甲) |
您最近半年使用:0次
3 . 某研究性学习小组向一定量的NaHSO3溶液(加入少量淀粉)中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色。为进一步研究有关因素对反应速率的影响,探究如下。
(1)查阅资料知NaHSO3与过量KIO3反应分为两步进行,且其反应速率主要由第一步反应决定。已知第一步反应的离子方程式为IO3-+3HSO3-=3SO42-+I-+3H+,则第二步反应的离子方程式为____ 。
(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如下。
①实验①②是探究KIO3浓度对反应速率的影响,表中c=_____ mL;
②实验①③是探究温度对反应速率的影响,表中a=____ 。
(3)将NaHSO3溶液与KIO3溶液在恒温条件下混合,用速率检测仪检测出起始阶段反应速率逐渐增大。该小组对其原因提出如下假设,请你完成假设二。
假设一:生成的SO42-对反应起催化作用;
假设二:____ ;
(4)请你设计实验验证上述假设一,完成表中内容。
(1)查阅资料知NaHSO3与过量KIO3反应分为两步进行,且其反应速率主要由第一步反应决定。已知第一步反应的离子方程式为IO3-+3HSO3-=3SO42-+I-+3H+,则第二步反应的离子方程式为
(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如下。
| 编号 | 0.01mol/LNaHSO3溶液/mL | 0.01mol/LKIO3溶液/mL | H2O/mL | 反应温度/℃ | 溶液变蓝所用时间t/s |
| ① | 6.0 | 10.0 | 4.0 | 15 | t1 |
| ② | 6.0 | 12.0 | c | 15 | t2 |
| ③ | 6.0 | a | b | 25 | t3 |
②实验①③是探究温度对反应速率的影响,表中a=
(3)将NaHSO3溶液与KIO3溶液在恒温条件下混合,用速率检测仪检测出起始阶段反应速率逐渐增大。该小组对其原因提出如下假设,请你完成假设二。
假设一:生成的SO42-对反应起催化作用;
假设二:
(4)请你设计实验验证上述假设一,完成表中内容。
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定起始时的反应速率v(甲)在烧杯乙中先加入少量① | ②若v(甲) ③若v(甲) |
您最近半年使用:0次
解题方法
4 .  可作为水溶液中
可作为水溶液中 歧化反应的催化剂:
歧化反应的催化剂: 。实验小组探究浓度、催化剂、溶液酸性对
。实验小组探究浓度、催化剂、溶液酸性对 歧化反应速率的影响,分别在盛有反应物的试管中加入2 mL相应试剂,密闭放置观察现象。(已知:
歧化反应速率的影响,分别在盛有反应物的试管中加入2 mL相应试剂,密闭放置观察现象。(已知: 易溶解在KI溶液中)
易溶解在KI溶液中)
回答下列问题
(1)实验②、③的目的是_______ 。
(2)实验①、⑤说明 单独存在时不具有催化作用,实验①、③说明
单独存在时不具有催化作用,实验①、③说明_______ ,④是③的对比实验,则a=_______ ,可得出的结论是_______ 。
(3)查阅资料知 催化
催化 歧化反应过程分为两步,写出反应ⅱ的离子方程式。
歧化反应过程分为两步,写出反应ⅱ的离子方程式。
ⅰ.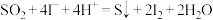
ⅱ._______
(4)实验表明, 的歧化反应速率⑥>③,则
的歧化反应速率⑥>③,则 催化
催化 歧化反应过程中
歧化反应过程中_______ (填“ⅰ”或“ⅱ”)步反应速率更快,试分析实验⑥中 的歧化反应速率快于实验③的原因
的歧化反应速率快于实验③的原因_______ 。
 可作为水溶液中
可作为水溶液中 歧化反应的催化剂:
歧化反应的催化剂: 。实验小组探究浓度、催化剂、溶液酸性对
。实验小组探究浓度、催化剂、溶液酸性对 歧化反应速率的影响,分别在盛有反应物的试管中加入2 mL相应试剂,密闭放置观察现象。(已知:
歧化反应速率的影响,分别在盛有反应物的试管中加入2 mL相应试剂,密闭放置观察现象。(已知: 易溶解在KI溶液中)
易溶解在KI溶液中)| 实验编号 | 反应物 | 试剂组成 | 实验现象 |
| ① | 18mL  饱和溶液 饱和溶液 | 无明显现象 | |
| ② | 18mL  稀溶液 稀溶液 | 0.4 KI KI | 出现浑浊较③慢 |
| ③ | 18mL  饱和溶液 饱和溶液 | 0.4 KI KI | 一段时间出现浑浊 |
| ④ | 18mL  饱和溶液 饱和溶液 | a KI、0.2 KI、0.2  | 出现浑浊较③快 |
| ⑤ | 18mL  饱和溶液 饱和溶液 | 0.2  | 无明显现象 |
| ⑥ | 18mL  饱和溶液 饱和溶液 | 0.2 KI、0.0002mol KI、0.0002mol  | 出现浑浊较③快 |
(1)实验②、③的目的是
(2)实验①、⑤说明
 单独存在时不具有催化作用,实验①、③说明
单独存在时不具有催化作用,实验①、③说明(3)查阅资料知
 催化
催化 歧化反应过程分为两步,写出反应ⅱ的离子方程式。
歧化反应过程分为两步,写出反应ⅱ的离子方程式。ⅰ.
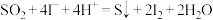
ⅱ.
(4)实验表明,
 的歧化反应速率⑥>③,则
的歧化反应速率⑥>③,则 催化
催化 歧化反应过程中
歧化反应过程中 的歧化反应速率快于实验③的原因
的歧化反应速率快于实验③的原因
您最近半年使用:0次
5 . 辉铜矿主要成分Cu2S,此外还含有少量SiO2、Fe2O3等杂质,软锰矿主要含有MnO2,以及少量SiO2、Fe2O3等杂质。研究人员开发综合利用这两种资源,用同槽酸浸湿法冶炼工艺,制备硫酸锰晶体和碱式碳酸铜。主要工艺流程如下:
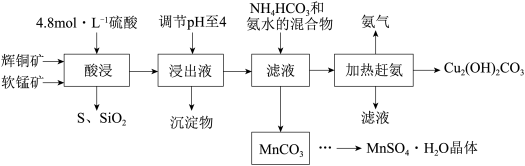
已知:
①MnO2有较强的氧化性,能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水溶液中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围(开始沉淀和完全沉淀的pH):
④MnSO4·H2O溶于1份冷水、0.6份沸水,不溶于乙醇。
(1)实验室配制240mL 4.8mol•L-1的稀硫酸,所需的玻璃仪器除玻璃棒、量筒、烧杯以外还需要___________ 。
(2)酸浸时,为了提高浸取率可采取的措施有___________ (任写一点)。
(3)酸浸时,得到浸出液中主要含有CuSO4、MnSO4等。写出该反应的化学方程式:___________ 。
(4)调节浸出液pH=4的作用是___________ 。
(5)写出流程中生成MnCO3的离子方程式___________ 。
(6)MnCO3先加稀硫酸溶解,在经过___________ 得到MnSO4·H2O晶体
(7)本工艺中可循环使用的物质是___________ (写化学式)。

已知:
①MnO2有较强的氧化性,能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水溶液中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围(开始沉淀和完全沉淀的pH):
| 金属离子 | Fe3+ | Mn2+ | Cu2+ |
| 开始沉淀pH值 | 1.5 | 8.3 | 4.4 |
| 完全沉淀pH值 | 3.2 | 9.8 | 6.4 |
(1)实验室配制240mL 4.8mol•L-1的稀硫酸,所需的玻璃仪器除玻璃棒、量筒、烧杯以外还需要
(2)酸浸时,为了提高浸取率可采取的措施有
(3)酸浸时,得到浸出液中主要含有CuSO4、MnSO4等。写出该反应的化学方程式:
(4)调节浸出液pH=4的作用是
(5)写出流程中生成MnCO3的离子方程式
(6)MnCO3先加稀硫酸溶解,在经过
(7)本工艺中可循环使用的物质是
您最近半年使用:0次
6 . 利用下列实验所选择的装置或仪器(夹持装置已略去)不能达到实验目的的是
A.利用图中装置制备并收集乙酸乙酯 |
B.利用图中装置探究SO2的氧化性和漂白性 |
C.利用图中装置从苯和溴苯的混合溶液中分离出溴苯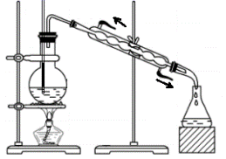 |
D.利用图中装置探究温度对反应速率的影响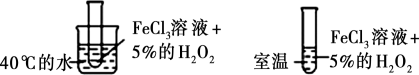 |
您最近半年使用:0次
7 . 下列说法正确的是
| A.在植物油中滴几滴酸性高锰酸钾溶液,振荡,溶液褪色,说明植物油含有酯基 |
| B.盐酸与硅酸钠溶液反应生成白色沉,证明氯的非金属性大于硅 |
| C.溶液的酸碱性对H2O2的稳定性有较大影响,如在酸性溶液中,H2O2分解较快 |
| D.任何反应都有一定限度,通过改变反应条件可对反应进行调控 |
您最近半年使用:0次
名校
解题方法
8 . I.某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”,进行了如下实验:2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O。
请回答:
(1)实验计时方法是从溶液混合开始计时,至___________ 时计时结束。
(2)V1=___________ ,V2=___________ ;
(3)设计实验Ⅰ.Ⅲ的目的是___________ 。
(4)利用实验Ⅲ中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=___________ 。
(5)有同学在实验中发现酸性高锰酸钾溶液和草酸溶液反应时,开始一段时间反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大。某同学认为是放热导致溶液温度升高所致,重做Ⅰ号实验,测定实验过程中不同时刻溶液的温度,结果温度没有明显变化。由此你得出的结论是:可能是是反应产物有___________ 作用。Ⅳ号实验是为验证你的猜测,实验中要加入的少量某种物质是___________ (填化学式)。
II.相同温度条件下,分别用3支试管按下列方式完成A、B、C三组实验:
上述实验能否说明“相同条件下,反应物浓度越大,反应速率越快”___________ (选填“能”或“不能”);简述你的理由:___________
| 编号 | 酸性KMnO4溶液(0.01mol·L-1) | H2C2O4溶液(0.1mol·L-1) | 水 | 某种物质 | 反应温度(℃) | 反应时间(min) |
| Ⅰ | 2mL | 2mL | 0 | 0 | 20 | 2.1 |
| Ⅱ | V1mL | 2mL | 1mL | 0 | 20 | 5.5 |
| Ⅲ | V2mL | 2mL | 0 | 0 | 50 | 0.5 |
| Ⅳ | 2mL | 2mL | 0 | 少量 | 20 | 0.2 |
(1)实验计时方法是从溶液混合开始计时,至
(2)V1=
(3)设计实验Ⅰ.Ⅲ的目的是
(4)利用实验Ⅲ中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=
(5)有同学在实验中发现酸性高锰酸钾溶液和草酸溶液反应时,开始一段时间反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大。某同学认为是放热导致溶液温度升高所致,重做Ⅰ号实验,测定实验过程中不同时刻溶液的温度,结果温度没有明显变化。由此你得出的结论是:可能是是反应产物有
II.相同温度条件下,分别用3支试管按下列方式完成A、B、C三组实验:
| 试管 | A | B | C |
| 加入试剂 | 4mL0.01mol/LKMnO4 1ml0.1moL/LH2SO4 2mL0.1mol/LH2C2O4 | 4mL0.02mol/LKMnO4 1ml0.1moL/LH2SO4 2mL0.1mol/LH2C2O4 | 4mL0.03mol/LKMnO4 1ml0.1moL/LH2SO4 2mL0.1mol/LH2C2O4 |
| 褪色时间 | 28秒 | 30秒 | 不褪色 |
您最近半年使用:0次



