2023高三·全国·专题练习
解题方法
1 . 已知2SO2(g)+O2(g) 2SO3(g) ΔH<0的实验数据如下表:
2SO3(g) ΔH<0的实验数据如下表:
(1)应选择的温度是___________ ,理由是___________ 。
(2)应采用的压强是___________ ,理由是___________ 。
(3)生产中通入过量空气的目的是___________ 。
 2SO3(g) ΔH<0的实验数据如下表:
2SO3(g) ΔH<0的实验数据如下表:| 温度 | 不同压强下SO2的转化率(%) | ||||
| 1×105 Pa | 5×105 Pa | 1×106 Pa | 5×106 Pa | 1×107 Pa | |
| 450 ℃ | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550 ℃ | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
(2)应采用的压强是
(3)生产中通入过量空气的目的是
您最近半年使用:0次
2 . 某储氢合金(M)的储氢机理简述如下:合金吸附H2→氢气解离成氢原子→形成含氢固溶体MHx( 相)→形成氢化物MHy(
相)→形成氢化物MHy( 相)。已知:
相)。已知: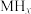 (
( 相)与MHy(
相)与MHy( 相)之间可建立平衡:
相)之间可建立平衡:

请回答下列问题:
(1)上述平衡中化学计量数k=________ (用含x、y的代数式表示)。
(2)t℃时,向体积恒定的密闭容器中加入一定量的储氢合金(M),随充入H2量的改变,固相中氢原子与金属原子个数比(H/M)与容器中H2的平衡压强p的变化关系如图所示。
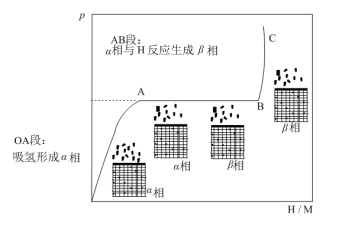
①在________ 温________ 压强下有利于该储氢合金(M)储存H2(填“低”或“高”)。
②若6g该储氢合金(M)在10 s内吸收的H2体积为24 mL,吸氢平均速率v=________ mL/(g∙s)。
③关于该储氢过程的说法错误的是________ 。
a.OA段:其他条件不变时,适当升温能提升形成 相的速率
相的速率
b.AB段:由于H2的平衡压强p未改变,故AB段过程中无H2充入
c.BC段:提升H2压力能大幅提高 相中氢原子物质的量
相中氢原子物质的量
(3)实验表明,H2中常含有O2、CO2、 、H2O等杂质,必须经过净化处理才能被合金储存,原因是
、H2O等杂质,必须经过净化处理才能被合金储存,原因是___________ 。
(4)有资料显示,储氢合金表面氢化物的形成会阻碍储氢合金吸附新的氢气分子,若把储氢合金制成纳米颗粒,单位时间内储氢效率会大幅度提高,可能的原因是________________ 。
(5)某镁系储氢合金的晶体结构如图所示:
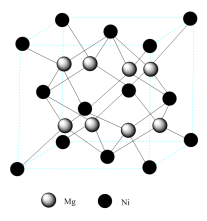
该储氢合金的化学式为________ 。若储氢后每个Mg原子都能结合2个氢原子,则该储氢合金的储氢容量为________ mL/g(储氢容量用每克合金结合标准状况下的氢气体积来表示,结果保留到整数)。
 相)→形成氢化物MHy(
相)→形成氢化物MHy( 相)。已知:
相)。已知: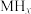 (
( 相)与MHy(
相)与MHy( 相)之间可建立平衡:
相)之间可建立平衡:
请回答下列问题:
(1)上述平衡中化学计量数k=
(2)t℃时,向体积恒定的密闭容器中加入一定量的储氢合金(M),随充入H2量的改变,固相中氢原子与金属原子个数比(H/M)与容器中H2的平衡压强p的变化关系如图所示。

①在
②若6g该储氢合金(M)在10 s内吸收的H2体积为24 mL,吸氢平均速率v=
③关于该储氢过程的说法错误的是
a.OA段:其他条件不变时,适当升温能提升形成
 相的速率
相的速率b.AB段:由于H2的平衡压强p未改变,故AB段过程中无H2充入
c.BC段:提升H2压力能大幅提高
 相中氢原子物质的量
相中氢原子物质的量(3)实验表明,H2中常含有O2、CO2、
 、H2O等杂质,必须经过净化处理才能被合金储存,原因是
、H2O等杂质,必须经过净化处理才能被合金储存,原因是(4)有资料显示,储氢合金表面氢化物的形成会阻碍储氢合金吸附新的氢气分子,若把储氢合金制成纳米颗粒,单位时间内储氢效率会大幅度提高,可能的原因是
(5)某镁系储氢合金的晶体结构如图所示:

该储氢合金的化学式为
您最近半年使用:0次
21-22高二·全国·假期作业
3 . 草酸(H2C2O4)是一种易溶于水的二元有机弱酸,常用作还原剂、沉淀剂等,可与酸性KMnO4溶液发生反应,以下为探究外界条件对反应速率的影响。请回答下列问题:
(1)硫酸酸化的高锰酸钾溶液与草酸溶液反应的离子方程式为_______ 。
(2)完成此实验设计,其中:V1=_______ ,V2=_______ 。
(3)对比实验1、2可探究_______ 对反应速率的影响。
| 实验编号 | 所加试剂及用量/mL | 条件 | 溶液颜色褪至无色所需时间/min | |||
| 0.01mol·L-1H2C2O4溶液 | 0.01mol·L-1KMnO4溶液 | 3.0mol·L-1稀H2SO4 | 水 | 温度/℃ | ||
| 1 | 12.0 | 2.0 | 3.0 | 3.0 | 20 | t1 |
| 2 | 6.0 | 2.0 | 3.0 | V1 | 20 | t2 |
| 3 | V2 | 2.0 | 3.0 | 9.0 | 30 | t3 |
(2)完成此实验设计,其中:V1=
(3)对比实验1、2可探究
您最近半年使用:0次
2022高三·全国·专题练习
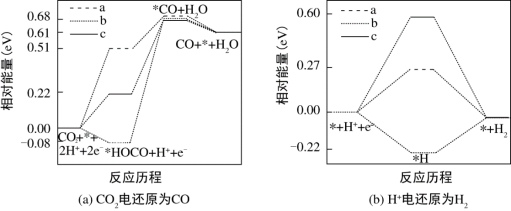
4 . 研究表明,在电解质水溶液中,CO2气体可被电化学还原。在电解质水溶液中,三种不同催化剂(a、b、c)上CO2电还原为CO的反应进程中(H+被还原为H2的反应可同时发生),相对能量变化如图。由此判断,CO2电还原为CO从易到难的顺序为_______ (用a、b、c字母排序)。

您最近半年使用:0次
2021高三·全国·专题练习
5 . 可逆反应2SO2(g)+O2(g)  2SO3(g)是工业上制取H2SO4的重要反应。
2SO3(g)是工业上制取H2SO4的重要反应。
(1)在恒压条件下,该反应分组实验的有关条件如下表:
已知Ⅰ、Ⅱ两组实验过程中,SO3气体的体积分数φ(SO3)随时间t的变化曲线如图所示。
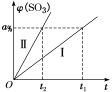
①Ⅱ组与Ⅰ相比不同的条件是___________ ;
②将Ⅰ组实验中温度变为800 ℃,则φ(SO3)达到a%所需时间___________ t1(填“小于”“大于”或“等于”)。
(2)向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按反应速率由大到小排列的是___________。
甲:在500 ℃时,10 mol SO2和10 mol O2反应
乙:在500 ℃时,用V2O5作催化剂,10 mol SO2和10 mol O2反应
丙:在450 ℃时,8 mol SO2和5 mol O2反应
丁:在500 ℃时,8 mol SO2和5 mol O2反应
 2SO3(g)是工业上制取H2SO4的重要反应。
2SO3(g)是工业上制取H2SO4的重要反应。(1)在恒压条件下,该反应分组实验的有关条件如下表:
| 反应条件 | 温度 | 容器容积 | 起始n(SO2) | 起始n(O2) | 其他条件 |
| Ⅰ组 | 500 ℃ | 1 L | 1 mol | 2 mol | 无 |
| Ⅱ组 | 500 ℃ | 1 L | 1 mol | 2 mol |

①Ⅱ组与Ⅰ相比不同的条件是
②将Ⅰ组实验中温度变为800 ℃,则φ(SO3)达到a%所需时间
(2)向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按反应速率由大到小排列的是___________。
甲:在500 ℃时,10 mol SO2和10 mol O2反应
乙:在500 ℃时,用V2O5作催化剂,10 mol SO2和10 mol O2反应
丙:在450 ℃时,8 mol SO2和5 mol O2反应
丁:在500 ℃时,8 mol SO2和5 mol O2反应
| A.甲、乙、丙、丁 | B.乙、甲、丙、丁 |
| C.乙、甲、丁、丙 | D.丁、丙、乙、甲 |
您最近半年使用:0次
解题方法
6 . 亚硫酸钠和碘酸钾在酸性溶液里反应的化学方程式是:Na2SO3+KIO3+H2SO4=Na2SO4+K2SO4+I2+H2O,该反应过程和机理较复杂,一般认为分为以下几步:
① +
+ →
→ +
+ (慢)
(慢)
② +
+ →IO-+
→IO-+ (快)
(快)
③5I-+6H++ →3I2+3H2O(快)
→3I2+3H2O(快)
④I2+ +H2O→2I-+
+H2O→2I-+ +2H2(快)
+2H2(快)
(1)根据上述条件推测,此反应的总的反应速率由___ 步反应决定。
(2)若预先加入淀粉溶液,由题述看必在___ 离子消耗完时,才会使淀粉变蓝的现象产生。
①
 +
+ →
→ +
+ (慢)
(慢)②
 +
+ →IO-+
→IO-+ (快)
(快)③5I-+6H++
 →3I2+3H2O(快)
→3I2+3H2O(快)④I2+
 +H2O→2I-+
+H2O→2I-+ +2H2(快)
+2H2(快)(1)根据上述条件推测,此反应的总的反应速率由
(2)若预先加入淀粉溶液,由题述看必在
您最近半年使用:0次
解题方法
7 . 有关O2的研究具有非常重要的意义,2019年3名科学家因发现大多数动物体内O2的感知通路而获得诺贝尔奖。
(1)标准状况下,22.4LO2的质量为_______ g。
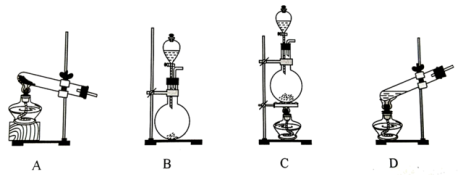
(2)在MnO2存在下用H2O2为原料制备O2,反应的化学方程式为_________________ , 应选择的气体发生装置为____________ (填字母)。
(3) 已知H2O2不与CI-反应。为探究FeCl3在H2O2制取O2反应中的作用, 某兴趣小组进行下列实验:向试管中加入5mL 11 mol∙L−1H2O2溶液,静置几分钟,无明显现象;滴加2滴1 mol∙L−1FeCl3溶液,立即产生大量气泡。
①加FeCl3溶液反应20min后,H2O2的浓度变为10.5 mol∙L−1,则20min内H2O2的平均反应速率为___ mol∙L−1∙min−1。
②反应结束后,滴加KSCN溶液,试管中溶液呈红色。经测定,溶液中Fe3+的量没有变化。综合以上实验,可推断出:在H2O2制O2反应中,FeCl3作__________ 剂。
(4)实验完毕,在离开实验室之前,应该完成的事项有________ (写出3项)。

(1)标准状况下,22.4LO2的质量为
(2)在MnO2存在下用H2O2为原料制备O2,反应的化学方程式为
(3) 已知H2O2不与CI-反应。为探究FeCl3在H2O2制取O2反应中的作用, 某兴趣小组进行下列实验:向试管中加入5mL 11 mol∙L−1H2O2溶液,静置几分钟,无明显现象;滴加2滴1 mol∙L−1FeCl3溶液,立即产生大量气泡。
①加FeCl3溶液反应20min后,H2O2的浓度变为10.5 mol∙L−1,则20min内H2O2的平均反应速率为
②反应结束后,滴加KSCN溶液,试管中溶液呈红色。经测定,溶液中Fe3+的量没有变化。综合以上实验,可推断出:在H2O2制O2反应中,FeCl3作
(4)实验完毕,在离开实验室之前,应该完成的事项有
您最近半年使用:0次
2020-12-04更新
|
385次组卷
|
2卷引用:2020年7月广东省普通高中学业水平合格性考试化学试卷
名校
解题方法
8 . 苯乙烯(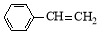 )是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
)是生产各种塑料的重要单体,可通过乙苯催化脱氢制得: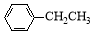

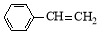 +H2(g)
+H2(g)
(1)已知:
计算上述反应生成1mol氢气的热效应___ (填吸放多少kJ)
(2)工业上,通常在乙苯(EB)蒸气中掺混N2(原料气中乙苯和N2的物质的量之比为1︰10,N2不参与反应),控制反应温度600℃,并保持体系总压为0.1Mpa不变的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图。
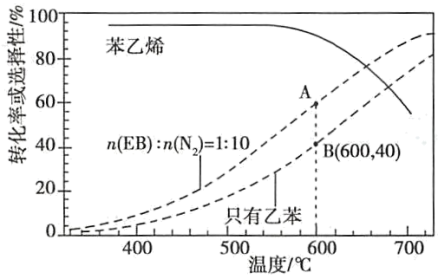
①A、B两点对应的正反应速率较大的是___ 。
②控制反应温度为600℃的理由是___ 。
 )是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
)是生产各种塑料的重要单体,可通过乙苯催化脱氢制得: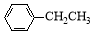

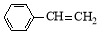 +H2(g)
+H2(g)(1)已知:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ/mol | 412 | 348 | 612 | 436 |
计算上述反应生成1mol氢气的热效应
(2)工业上,通常在乙苯(EB)蒸气中掺混N2(原料气中乙苯和N2的物质的量之比为1︰10,N2不参与反应),控制反应温度600℃,并保持体系总压为0.1Mpa不变的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图。

①A、B两点对应的正反应速率较大的是
②控制反应温度为600℃的理由是
您最近半年使用:0次
2020高三·全国·专题练习
9 . CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g) 2CO(g)+2H2(g)
2CO(g)+2H2(g)
①已知上述反应中相关的化学键键能数据如下:
分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是___ (填“A”或“B”)。
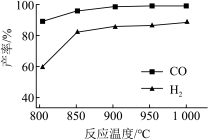
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如图所示。此反应优选温度为900℃的原因是___ 。
CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)
 2CO(g)+2H2(g)
2CO(g)+2H2(g)①已知上述反应中相关的化学键键能数据如下:
| 化学键 | C—H | C=O | H—H | C O(CO) O(CO) |
| 键能/kJ·mol-1 | 413 | 745 | 436 | 1075 |
分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如图所示。此反应优选温度为900℃的原因是

您最近半年使用:0次
18-19高三·浙江·期中
10 . 从能量的变化和反应的快慢等角度研究化学反应具有重要意义。
(1)已知一定条件下,反应 为放热应:
为放热应:
①下图能正确表示该反应中能量变化的是__________ ;

②根据下表数据,计算生成 时该反应放出的热量为
时该反应放出的热量为__________  :
:
(2)某兴趣小组为研究原电池原理,设计如图装置。
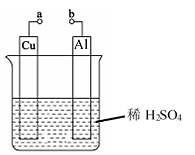
① 和
和 用导线连接,
用导线连接, 极为原电池
极为原电池________ (填“正”或“负”)极,电极反应式是________ ; 极发生
极发生________ (填“氧化”或“还原”)反应,其电极反应式为________ ,溶液中 移向
移向________ (填“ ”或“
”或“ ”极)。当负极金属溶解
”极)。当负极金属溶解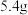 时,通过导线的电子数为
时,通过导线的电子数为________ 。
②不将 连接,请问如何加快
连接,请问如何加快 与稀硫酸的反映速率?
与稀硫酸的反映速率?____________________ 。
(1)已知一定条件下,反应
 为放热应:
为放热应:①下图能正确表示该反应中能量变化的是

②根据下表数据,计算生成
 时该反应放出的热量为
时该反应放出的热量为 :
:| 化学键 |  |  |  |  |  |
断开 键所吸收的能量 键所吸收的能量 | 415 | 498 | 343 | 798 | 465 |

①
 和
和 用导线连接,
用导线连接, 极为原电池
极为原电池 极发生
极发生 移向
移向 ”或“
”或“ ”极)。当负极金属溶解
”极)。当负极金属溶解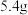 时,通过导线的电子数为
时,通过导线的电子数为②不将
 连接,请问如何加快
连接,请问如何加快 与稀硫酸的反映速率?
与稀硫酸的反映速率?
您最近半年使用:0次



