名校
解题方法
1 . 工业合成氨对粮食增产、增加人口具重要价值。1913年,Haber-Bosch发明的催化合成氨技术实现了工业化生产:N2(g)+3H2(g)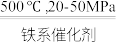 2NH3(g),298K时反应相关数据如表所示:
2NH3(g),298K时反应相关数据如表所示:
已知:化学反应吉布斯自由能变化量ΔG=ΔH -TΔS (通常温度区间,ΔH和ΔS可视为常量),ΔG与压力平衡常数Kp的关系为:lgKp = 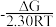 ,Kp为压力平衡常数;R为气体摩尔常数8.314 J·K-1· mol-1;T为热力学温度,单位:K。
,Kp为压力平衡常数;R为气体摩尔常数8.314 J·K-1· mol-1;T为热力学温度,单位:K。
(1)298K时,合成氨反应______ (选填“能”或“不能”)自发进行,理由是___________ 。
(2)实验研究表明,特定条件下,合成氨反应的速率与参与反应的物质浓度的关系式为: ν=kc(N2)·c1.5(H2)·c-1(NH3),下列措施不能提高反应速率的是______ 。
A.适度增加氮气的浓度 B.适度增加氢气的浓度
C.及时将产物氨气分离出反应体系 D.适度提高反应温度
E.在低压下进行反应 F.加入铁催化剂
(3)T℃下,设反应N2(g)+3H2(g) 2NH3(g)的平衡常数为K,反应NH3(g)
2NH3(g)的平衡常数为K,反应NH3(g)
 N2(g)+
N2(g)+  H2(g)的平衡常数为
H2(g)的平衡常数为 ,则K与
,则K与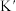 之间的关系是
之间的关系是________ 。298K时,合成氨反应的压力平衡常数Kp(298K )=______ (保留2位有效数字);向一恒定温度的刚性密闭容器中充入物质的量之比为1:1的N2和H2混合气体,初始压强为30MPa,在不同催化剂作用下反应,相同时间内H2的转化率随温度的变化如图所示,b点v正_____ v逆(填“>”、“<”或“=”)。图中a点混合气体平均相对分子质量为18.75,a点对应温度(T4)下反应的平衡常数Kp=______ (保留两位有效数字,Kp为以分压表示的平衡常数,分压=总压 物质的量分数),由此知T4
物质的量分数),由此知T4______ 298K,(选填“>”、“<”或“=”)。

(4)格哈德·埃特尔证实氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:

下列关于合成氨反应的叙述中错误的是________。
(5)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前要经过铜氨溶液处理以除去 CO,反应为:[Cu(NH3)2]2++CO+NH3 [Cu(NH3)3CO]2+ ΔH<0。
[Cu(NH3)3CO]2+ ΔH<0。
①铜氨溶液吸收CO的适宜生产条件是_________ 。
②吸收CO后的铜氨溶液经过适当处理再生,恢复其吸收 CO的能力,可循环使用,铜氨溶液再生的适宜条件是_________ 。
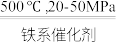 2NH3(g),298K时反应相关数据如表所示:
2NH3(g),298K时反应相关数据如表所示:| ΔH(kJ·mol-1) | -92.2 |
| ΔS(J·K-1·mol-1) | -198.2 |
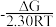 ,Kp为压力平衡常数;R为气体摩尔常数8.314 J·K-1· mol-1;T为热力学温度,单位:K。
,Kp为压力平衡常数;R为气体摩尔常数8.314 J·K-1· mol-1;T为热力学温度,单位:K。(1)298K时,合成氨反应
(2)实验研究表明,特定条件下,合成氨反应的速率与参与反应的物质浓度的关系式为: ν=kc(N2)·c1.5(H2)·c-1(NH3),下列措施不能提高反应速率的是
A.适度增加氮气的浓度 B.适度增加氢气的浓度
C.及时将产物氨气分离出反应体系 D.适度提高反应温度
E.在低压下进行反应 F.加入铁催化剂
(3)T℃下,设反应N2(g)+3H2(g)
 2NH3(g)的平衡常数为K,反应NH3(g)
2NH3(g)的平衡常数为K,反应NH3(g)
 N2(g)+
N2(g)+  H2(g)的平衡常数为
H2(g)的平衡常数为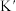 ,则K与
,则K与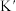 之间的关系是
之间的关系是 物质的量分数),由此知T4
物质的量分数),由此知T4
(4)格哈德·埃特尔证实氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:

下列关于合成氨反应的叙述中错误的是________。
| A.过程表明在化学反应中存在化学键的断裂与形成 |
| B.催化剂能改变化学反应的历程,使反应物化学键更易断裂,活化分子百分比增多 |
| C.过程①③④会放出能量,过程②需吸收能量 |
| D.常温下该反应难以进行,是因为常温下生成物的化学键难以形成 |
(5)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前要经过铜氨溶液处理以除去 CO,反应为:[Cu(NH3)2]2++CO+NH3
 [Cu(NH3)3CO]2+ ΔH<0。
[Cu(NH3)3CO]2+ ΔH<0。①铜氨溶液吸收CO的适宜生产条件是
②吸收CO后的铜氨溶液经过适当处理再生,恢复其吸收 CO的能力,可循环使用,铜氨溶液再生的适宜条件是
您最近半年使用:0次
名校
解题方法
2 . 肼( )及其衍生物的合成与利用具有重要意义。
)及其衍生物的合成与利用具有重要意义。
(1)“肼合成酶”以其中的 “配合物为催化中心,可将
“配合物为催化中心,可将 与
与 转化为肼,其反应历程如图所示。
转化为肼,其反应历程如图所示。
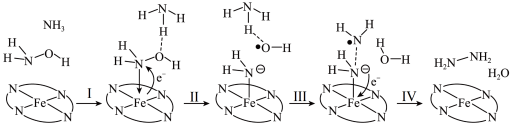
上图所示的反应步骤Ⅱ中Fe元素化合价的变化可描述为___________ 。
②将 替换为
替换为 ,反应所得产物的化学式为
,反应所得产物的化学式为___________ 。
(2)在碱性条件下,水合肼( )在催化剂Rh(铑)g-
)在催化剂Rh(铑)g- 作用下发生如下分解反应:
作用下发生如下分解反应:
反应Ⅰ: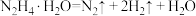
反应Ⅱ: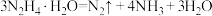
转化频率(TOF)能反映催化剂的性能。
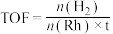 (t为反应时间),保持温度不变,相同时间内反应中不同
(t为反应时间),保持温度不变,相同时间内反应中不同 对应的TOF如图所示。
对应的TOF如图所示。
①催化剂载体g- 可由三聚氰胺(
可由三聚氰胺(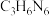 )在空气中焙烧得到。已知
)在空气中焙烧得到。已知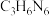 具有六元环结构,其结构简式可表示为
具有六元环结构,其结构简式可表示为___________ 。
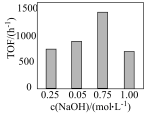
②TOF随 变化的原因是
变化的原因是___________ 。
(3)相同条件下,测得 诱导肼、甲肼(
诱导肼、甲肼(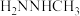 )和偏二甲肼[
)和偏二甲肼[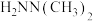 ]低温反应(均为吸热反应)产物与反应物能量差
]低温反应(均为吸热反应)产物与反应物能量差 、反应速率常数k值(k越大,反应越快)如下表。
、反应速率常数k值(k越大,反应越快)如下表。
①请补充上表所缺反应产物的结构简式___________ 。
②相较甲肼而言,肼、偏二甲肼与 的反应效果不佳的原因分别是
的反应效果不佳的原因分别是___________ 。
(4)液态肼也可以作为燃料电池,如图一种肼燃料电池,写成负极的电极反应___________ 。

 )及其衍生物的合成与利用具有重要意义。
)及其衍生物的合成与利用具有重要意义。(1)“肼合成酶”以其中的
 “配合物为催化中心,可将
“配合物为催化中心,可将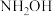 与
与 转化为肼,其反应历程如图所示。
转化为肼,其反应历程如图所示。
上图所示的反应步骤Ⅱ中Fe元素化合价的变化可描述为
②将
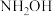 替换为
替换为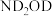 ,反应所得产物的化学式为
,反应所得产物的化学式为(2)在碱性条件下,水合肼(
 )在催化剂Rh(铑)g-
)在催化剂Rh(铑)g- 作用下发生如下分解反应:
作用下发生如下分解反应:反应Ⅰ:
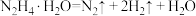
反应Ⅱ:
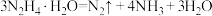
转化频率(TOF)能反映催化剂的性能。
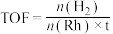 (t为反应时间),保持温度不变,相同时间内反应中不同
(t为反应时间),保持温度不变,相同时间内反应中不同 对应的TOF如图所示。
对应的TOF如图所示。
①催化剂载体g-
 可由三聚氰胺(
可由三聚氰胺(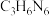 )在空气中焙烧得到。已知
)在空气中焙烧得到。已知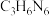 具有六元环结构,其结构简式可表示为
具有六元环结构,其结构简式可表示为②TOF随
 变化的原因是
变化的原因是(3)相同条件下,测得
 诱导肼、甲肼(
诱导肼、甲肼(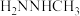 )和偏二甲肼[
)和偏二甲肼[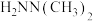 ]低温反应(均为吸热反应)产物与反应物能量差
]低温反应(均为吸热反应)产物与反应物能量差 、反应速率常数k值(k越大,反应越快)如下表。
、反应速率常数k值(k越大,反应越快)如下表。| 燃料 | 反应产物 |  | k值 |
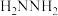 | 5.73 | 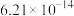 | |
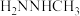 | 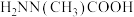 | 14.15 | 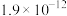 |
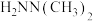 |  | 47.81 | - |
②相较甲肼而言,肼、偏二甲肼与
 的反应效果不佳的原因分别是
的反应效果不佳的原因分别是(4)液态肼也可以作为燃料电池,如图一种肼燃料电池,写成负极的电极反应

您最近半年使用:0次
解题方法
3 . 回答下列问题。
Ⅰ.某实验小组用 100mL0.50mol·L-1NaOH 溶液与 60mL0.50mol·L-1 硫酸溶液进行中和热的测定,装置如图1所示。回答下列问题:
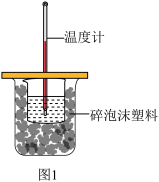
(1)图中装置缺少的仪器是___________ 。
(2)硫酸稍过量的原因是___________ 。
(3)某小组同学实验数据记录如下表,若近似认为 0.50mol•L-1NaOH 溶液与 0.50mol•L-1硫酸溶液的密度都是1g•cm-3,中和后生成溶液的比热容 c=4.18J•g-1•℃-1,则上述实验测得的中和热△H =___________ (结果保留至小数点后一位)。
(4)上述实验测得中和热的数值小于 57.3kJ·mol-1,产生偏差的原因可能是___________(填字母)。
Ⅱ.甲、乙两位同学探究外界条件对化学反应速率的影响。
【实验原理】反应:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,反应过程中溶液出现乳白色浑浊和有刺激性气味的 气体。
【实验用品】0.1mol/LNa2S2O3溶液、0.1mol/LH2SO4溶液、蒸馏水、试管、烧杯、量筒、胶头滴管等。
实验一:甲同学利用如图装置测定化学反应速率。
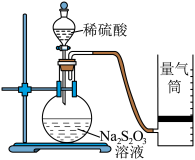
(5)为保证实验的准确性和可靠性,利用该装置进行实验前应先进行的操作是___________ 。除如图所示的实验用品外,还需要的实验仪器 是___________ 。
(6)若在 2min 时收集到 224mL(已折算成标准状况)气体,可计算出在 2min 内的反应速率v(H+)=0.02mol/(L·min),而该速率值比实际值偏小,其原因是_____________________ 。
实验二:乙同学得到各组实验数据如下表。
(7)实验Ⅰ、Ⅱ探究___________ 对化学反应速率的影响,a=___________ ,V=___________ 。
(8)实验Ⅱ、Ⅲ探究温度对化学反应速率的影响。实验表明,实验Ⅲ的反应速率最快,支持这一结论的实验现象是___________ 。
Ⅰ.某实验小组用 100mL0.50mol·L-1NaOH 溶液与 60mL0.50mol·L-1 硫酸溶液进行中和热的测定,装置如图1所示。回答下列问题:

(1)图中装置缺少的仪器是
(2)硫酸稍过量的原因是
(3)某小组同学实验数据记录如下表,若近似认为 0.50mol•L-1NaOH 溶液与 0.50mol•L-1硫酸溶液的密度都是1g•cm-3,中和后生成溶液的比热容 c=4.18J•g-1•℃-1,则上述实验测得的中和热△H =
| 实验序号 | 起始温度t1/℃ | 终止温度T2/℃ | 平均温度差(t2-t1)/℃ | ||
| HCl | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | _____ |
| 2 | 27.0 | 27.2 | 27.1 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
| A.量取 NaOH 溶液时仰视读数 |
| B.为了使反应充分,向酸溶液中分次加入碱溶液 |
| C.实验装置保温隔热效果差 |
| D.用铜丝代替玻璃搅拌器搅拌 |
Ⅱ.甲、乙两位同学探究外界条件对化学反应速率的影响。
【实验原理】反应:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,反应过程中溶液出现乳白色浑浊和有刺激性气味的 气体。
【实验用品】0.1mol/LNa2S2O3溶液、0.1mol/LH2SO4溶液、蒸馏水、试管、烧杯、量筒、胶头滴管等。
实验一:甲同学利用如图装置测定化学反应速率。

(5)为保证实验的准确性和可靠性,利用该装置进行实验前应先进行的操作是
(6)若在 2min 时收集到 224mL(已折算成标准状况)气体,可计算出在 2min 内的反应速率v(H+)=0.02mol/(L·min),而该速率值比实际值偏小,其原因是
实验二:乙同学得到各组实验数据如下表。
| 实验编号 | Na2S2O3溶液 | H2SO4溶液 | 蒸馏水 | |||
| 浓度/(mol/L) | 体积/mL | 浓度/(mol/L) | 体积/mL | 体积/mL | 温度/℃ | |
| I | 0.1 | 3.0 | 0.1 | 3.0 | V | 20 |
| Ⅱ | 0.1 | 5.0 | 0.1 | 3.0 | 0 | a |
| Ⅲ | 0.1 | 5.0 | 0.1 | 3.0 | 0 | 30 |
(8)实验Ⅱ、Ⅲ探究温度对化学反应速率的影响。实验表明,实验Ⅲ的反应速率最快,支持这一结论的实验现象是
您最近半年使用:0次
名校
解题方法
4 . 含氮物质、含硫物质的过量排放会污染大气或水体,研究氮、硫及其化合物的性质及转化,对降低含氮、含硫物质的污染有着重大的意义。
(1)在一定条件下,浓度为5%的尿素[CO(NH2)2]吸收液可以脱除烟气中的NOx。不同吸收反应温度下,测得NOx的脱除率变化如图所示。
已知信息:尿素的分解温度是160℃。尿素水解:CO(NH2)2+H2O=CO2↑+2NH3↑,在低温水解速度慢。
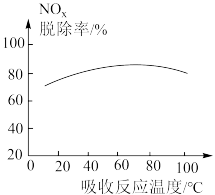
①当温度大于80℃时,NOx的脱除率随温度升高而降低的原因是______ 。
②写出在70~80℃条件下,尿素和烟气中NO2反应的化学方程式为______ 。
(2)ClO2可对烟气中NOx、SO2进行协同脱除,涉及的部分反应如下:
Ⅰ.ClO2+NO=NO2+ClO
Ⅱ.ClO+NO=Cl+NO2
Ⅲ.ClO2+SO2=ClO+SO3
Ⅳ.ClO+SO2=Cl+SO3
①反应Ⅳ的历程如图4所示。该历程中最大活化能E正=_____ kcal·mol-1。
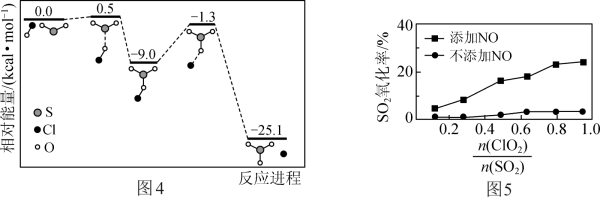
②保持其他条件不变,分别在不添加NO、添加NO两种情况下,控制模拟烟气中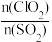 不同并反应相同时间,测得SO2氧化率随
不同并反应相同时间,测得SO2氧化率随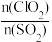 变化如图5所示。不添加NO时,SO2氧化率较低(不超过3%)的原因可能是
变化如图5所示。不添加NO时,SO2氧化率较低(不超过3%)的原因可能是______ 。添加NO时,SO2氧化率比不添加NO时高,其原因可能是______ 。
(1)在一定条件下,浓度为5%的尿素[CO(NH2)2]吸收液可以脱除烟气中的NOx。不同吸收反应温度下,测得NOx的脱除率变化如图所示。
已知信息:尿素的分解温度是160℃。尿素水解:CO(NH2)2+H2O=CO2↑+2NH3↑,在低温水解速度慢。

①当温度大于80℃时,NOx的脱除率随温度升高而降低的原因是
②写出在70~80℃条件下,尿素和烟气中NO2反应的化学方程式为
(2)ClO2可对烟气中NOx、SO2进行协同脱除,涉及的部分反应如下:
Ⅰ.ClO2+NO=NO2+ClO
Ⅱ.ClO+NO=Cl+NO2
Ⅲ.ClO2+SO2=ClO+SO3
Ⅳ.ClO+SO2=Cl+SO3
①反应Ⅳ的历程如图4所示。该历程中最大活化能E正=
②保持其他条件不变,分别在不添加NO、添加NO两种情况下,控制模拟烟气中
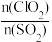 不同并反应相同时间,测得SO2氧化率随
不同并反应相同时间,测得SO2氧化率随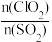 变化如图5所示。不添加NO时,SO2氧化率较低(不超过3%)的原因可能是
变化如图5所示。不添加NO时,SO2氧化率较低(不超过3%)的原因可能是
您最近半年使用:0次
2023高三·全国·专题练习
5 . 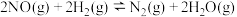 的反应速率表达式为
的反应速率表达式为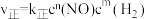 (
( 为正反应速率常数,只与温度有关。
为正反应速率常数,只与温度有关。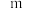 和
和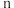 为反应级数,取最简正整数)。
为反应级数,取最简正整数)。
为了探究一定温度下 NO、 的浓度对反应速率的影响,测得实验数据如下:
的浓度对反应速率的影响,测得实验数据如下:
(1)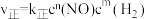 中,m=
中,m=_______ ,n=_______ 。
(2)经研究,有人提出上述反应分两步进行: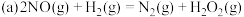 ;
; 。
。
化学总反应由较慢的一步反应决定。
上述反应中,(a)反应较慢,(a)正反应活化能_______ (填“大于”“小于”或“等于”)(b)正反应活化能。
(3)1889年,瑞典化学家阿伦尼乌斯根据实验结果,提出了温度与反应速率常数关系的经验公式: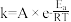 [
[ 为反应速率常数,
为反应速率常数, 为比例常数,
为比例常数,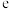 为自然对数的底数,
为自然对数的底数,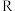 为气体摩尔常数,
为气体摩尔常数, 为开尔文温度,
为开尔文温度, 为活化能
为活化能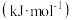 ]。
]。
①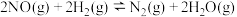 反应达到平衡后,升高温度,正反应速率常数增大的倍数
反应达到平衡后,升高温度,正反应速率常数增大的倍数_______ (填“大于”“小于”或“等于”)逆反应速率常数增大的倍数。
②由此判断下列说法中正确的是_______ (填序号,K正、K逆为正、逆速率常数)。
A.其他条件不变,升高温度,K正增大,K逆变小
B.其他条件不变,使用催化剂,K正、K逆同倍数增大
C.其他条件不变,增大反应物浓度K正增大,K逆不变
D.其他条件不变,减小压强,K正、K逆都变小
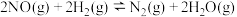 的反应速率表达式为
的反应速率表达式为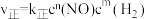 (
( 为正反应速率常数,只与温度有关。
为正反应速率常数,只与温度有关。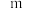 和
和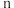 为反应级数,取最简正整数)。
为反应级数,取最简正整数)。为了探究一定温度下 NO、
 的浓度对反应速率的影响,测得实验数据如下:
的浓度对反应速率的影响,测得实验数据如下:| 序号 | 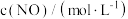 |  | 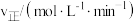 |
| I | 0.10 | 0.10 | 0.414 |
| II | 0.10 | 0.20 | 0.828 |
| III | 0.30 | 0.10 | 3.726 |
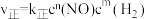 中,m=
中,m=(2)经研究,有人提出上述反应分两步进行:
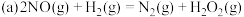 ;
; 。
。化学总反应由较慢的一步反应决定。
上述反应中,(a)反应较慢,(a)正反应活化能
(3)1889年,瑞典化学家阿伦尼乌斯根据实验结果,提出了温度与反应速率常数关系的经验公式:
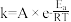 [
[ 为反应速率常数,
为反应速率常数, 为比例常数,
为比例常数,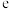 为自然对数的底数,
为自然对数的底数,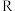 为气体摩尔常数,
为气体摩尔常数, 为开尔文温度,
为开尔文温度, 为活化能
为活化能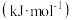 ]。
]。①
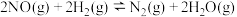 反应达到平衡后,升高温度,正反应速率常数增大的倍数
反应达到平衡后,升高温度,正反应速率常数增大的倍数②由此判断下列说法中正确的是
A.其他条件不变,升高温度,K正增大,K逆变小
B.其他条件不变,使用催化剂,K正、K逆同倍数增大
C.其他条件不变,增大反应物浓度K正增大,K逆不变
D.其他条件不变,减小压强,K正、K逆都变小
您最近半年使用:0次
真题
名校
6 . 某兴趣小组设计实验探究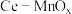 ,催化空气氧化
,催化空气氧化 的效率。回答下列问题:
的效率。回答下列问题:
步骤Ⅰ 制备
在通风橱中用下图装置制备 (加热及夹持装置省略),反应方程式:
(加热及夹持装置省略),反应方程式: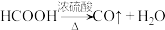

(1)装置A中盛放甲酸的仪器的名称是_______ 。
(2)从B、C、D中选择合适的装置收集 ,正确的接口连接顺序为a→_______→_______→_______→_______→h(每空填一个接口标号)。
,正确的接口连接顺序为a→_______→_______→_______→_______→h(每空填一个接口标号)。______
步骤Ⅱ 检验
将 通入新制银氨溶液中,有黑色沉淀生成。
通入新制银氨溶液中,有黑色沉淀生成。
(3)该反应的化学方程式为_______ 。
步骤Ⅲ 探究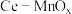 催化空气氧化
催化空气氧化 的效率
的效率
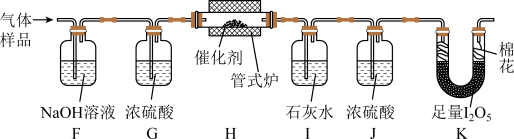
将一定量 与空气混合,得到
与空气混合,得到 体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至
体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至 ,按一定流速通入气体样品。(已知:
,按一定流速通入气体样品。(已知: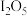 是白色固体,易吸水潮解:
是白色固体,易吸水潮解: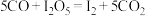 )
)
(4)通入 (已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了
(已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了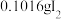 。
。
①能证明 被空气氧化的现象是
被空气氧化的现象是_______ ;
② 被催化氧化的百分率为
被催化氧化的百分率为_______ ;
③若未通入氮气,②的结果将_______ (填“偏大”“偏小”或“无影响”)。
(5)探究气体与催化剂接触时长对催化氧化效率的影响时,采用_______ 方法可以缩短接触时长。
(6)步骤Ⅲ装置存在的不足之处是_______ 。
 ,催化空气氧化
,催化空气氧化 的效率。回答下列问题:
的效率。回答下列问题:步骤Ⅰ 制备

在通风橱中用下图装置制备
 (加热及夹持装置省略),反应方程式:
(加热及夹持装置省略),反应方程式: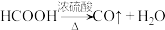

(1)装置A中盛放甲酸的仪器的名称是
(2)从B、C、D中选择合适的装置收集
 ,正确的接口连接顺序为a→_______→_______→_______→_______→h(每空填一个接口标号)。
,正确的接口连接顺序为a→_______→_______→_______→_______→h(每空填一个接口标号)。步骤Ⅱ 检验

将
 通入新制银氨溶液中,有黑色沉淀生成。
通入新制银氨溶液中,有黑色沉淀生成。(3)该反应的化学方程式为
步骤Ⅲ 探究
 催化空气氧化
催化空气氧化 的效率
的效率将一定量
 与空气混合,得到
与空气混合,得到 体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至
体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至 ,按一定流速通入气体样品。(已知:
,按一定流速通入气体样品。(已知: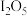 是白色固体,易吸水潮解:
是白色固体,易吸水潮解: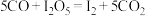 )
)
(4)通入
 (已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了
(已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了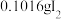 。
。①能证明
 被空气氧化的现象是
被空气氧化的现象是②
 被催化氧化的百分率为
被催化氧化的百分率为③若未通入氮气,②的结果将
(5)探究气体与催化剂接触时长对催化氧化效率的影响时,采用
(6)步骤Ⅲ装置存在的不足之处是
您最近半年使用:0次
2023-02-20更新
|
6403次组卷
|
15卷引用:2022年福建省高考真题化学试题
2022年福建省高考真题化学试题(已下线)专题16 化学实验综合题-2022年高考真题模拟题分项汇编(已下线)2022年福建省高考真题变式题(实验探究题)(已下线)安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试变式题(实验探究题)(已下线)安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试举一反三(实验探究题)(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题突破卷13 化学实验基础(二)-2024年高考化学一轮复习考点通关卷(新教材新高考)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)山东省新泰市第一中学(弘文部)2023-2024学年高三上学期第二次月考化学试题福建省莆田第一中学2023-2024学年高一上学期期末考试化学试题宁夏回族自治区石嘴山市第三中学2023-2024学年高三上学期期末考试理综试题-高中化学天津市耀华中学2023-2024学年高三下学期开学验收考化学试卷
7 . 钛是航空、军工、电力等领域重要的金属材料。一种由钛铁矿[主要成分是钛酸亚铁(FeTiO3),还含有少量 等杂质]制备金属钛同时获得
等杂质]制备金属钛同时获得 的工艺流程如图:
的工艺流程如图:
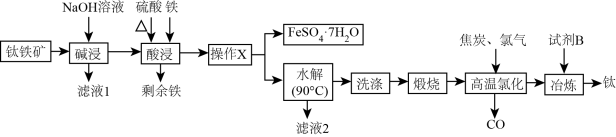
已知:“酸浸”后钛主要以 的形式存在;“水解”后钛以
的形式存在;“水解”后钛以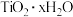 的形式存在。
的形式存在。
回答下列问题:
(1)基态 的最外层电子排布式为
的最外层电子排布式为_______ 。
(2)写出“水解( )”时发生反应的离子方程式:
)”时发生反应的离子方程式:_______ ;验证“洗涤”达到目的的操作为_______ 。
(3)“高温氯化”时发生反应的化学方程式为_______ ;有利于该过程中“气—固—固”接触的措施是_______ (写一种)。某科研小组模拟“高温氯化”反应理论计算结果显示,在 条件下达到平衡时,
条件下达到平衡时, 几乎完全转化为
几乎完全转化为 ,但实际生产中反应温度却远高于
,但实际生产中反应温度却远高于 ,其原因是
,其原因是_______ (写一种)。
(4)每次取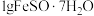 样品,加适量水溶解并加入
样品,加适量水溶解并加入 溶液和
溶液和 溶液,再用
溶液,再用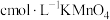 标准溶液滴定至终点,平行滴定3次,平均消耗标准溶液
标准溶液滴定至终点,平行滴定3次,平均消耗标准溶液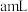 。
。
已知: (黄色)
(黄色)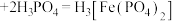 (无色)
(无色)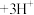 。
。
滴定终点溶液颜色变为_______ ;该样品中 的质量分数为
的质量分数为_______ (填含c,a的表达式)。
 等杂质]制备金属钛同时获得
等杂质]制备金属钛同时获得 的工艺流程如图:
的工艺流程如图:
已知:“酸浸”后钛主要以
 的形式存在;“水解”后钛以
的形式存在;“水解”后钛以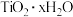 的形式存在。
的形式存在。回答下列问题:
(1)基态
 的最外层电子排布式为
的最外层电子排布式为(2)写出“水解(
 )”时发生反应的离子方程式:
)”时发生反应的离子方程式:(3)“高温氯化”时发生反应的化学方程式为
 条件下达到平衡时,
条件下达到平衡时, 几乎完全转化为
几乎完全转化为 ,但实际生产中反应温度却远高于
,但实际生产中反应温度却远高于 ,其原因是
,其原因是(4)每次取
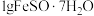 样品,加适量水溶解并加入
样品,加适量水溶解并加入 溶液和
溶液和 溶液,再用
溶液,再用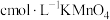 标准溶液滴定至终点,平行滴定3次,平均消耗标准溶液
标准溶液滴定至终点,平行滴定3次,平均消耗标准溶液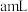 。
。已知:
 (黄色)
(黄色)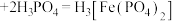 (无色)
(无色)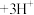 。
。滴定终点溶液颜色变为
 的质量分数为
的质量分数为
您最近半年使用:0次
解题方法
8 . Mn2O3是一种重要的化工产品。以菱锰矿(主要成分为MnCO3,还含有少量Fe3O4、FeO、CoO、Al2O3)为原料制备Mn2O3的工艺流程如下图所示。
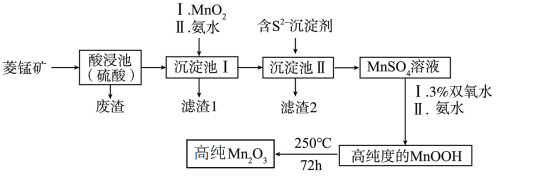
已知:25℃时,相关物质的Ksp见下表。氢氧化氧锰(MnOOH)难溶于水和碱性溶液。
回答下列问题:
(1)为了提高酸浸速率,可采取的措施为_______ (任写2条即可)。
(2)向“沉淀池I”中加入MnO2的作用是_______ ;在“沉淀池I”中,滴加氨水调节溶液的pH,使溶液中铝、铁元素完全沉淀,则理论上pH的最小值为_______ (当溶液中某离子浓度小于1.0×10-5mol·L-1时,可认为该离子沉淀完全)。
(3)“滤渣2”的主要成分是_______ (填化学式)。
(4)请写出MnSO4转化为MnOOH的离子方程式_______ 。
(5)经过滤、洗涤、干燥等步骤可得高纯MnOOH。其中洗涤的具体操作为_______ 。
(6)甲苯(用C7H8表示)是一种挥发性的大气污染物。Mn2O3可用作甲苯热催化氧化消除技术的催化剂。其装置及反应机理如图所示,下列说法中错误的是_______。


已知:25℃时,相关物质的Ksp见下表。氢氧化氧锰(MnOOH)难溶于水和碱性溶液。
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 | Co(OH)2 |
| Ksp | 1×10-16.3 | 1×10-38.6 | 1×10-32.3 | 1×10-12.7 | 1.09×10-15 |
(1)为了提高酸浸速率,可采取的措施为
(2)向“沉淀池I”中加入MnO2的作用是
(3)“滤渣2”的主要成分是
(4)请写出MnSO4转化为MnOOH的离子方程式
(5)经过滤、洗涤、干燥等步骤可得高纯MnOOH。其中洗涤的具体操作为
(6)甲苯(用C7H8表示)是一种挥发性的大气污染物。Mn2O3可用作甲苯热催化氧化消除技术的催化剂。其装置及反应机理如图所示,下列说法中错误的是_______。

| A.反应Ⅱ的方程式为C7H8+36MnO2=7CO2+4H2O+18Mn2O3 |
| B.反应Ⅰ中Mn元素的化合价升高 |
| C.反应Ⅱ中O-H键的形成会吸收能量 |
| D.Mn2O3作催化剂可降低总反应C7H8(g)+9O2(g)=7CO2(g)+4H2O(g)的焓变 |
您最近半年使用:0次
2023-01-12更新
|
163次组卷
|
2卷引用:湖北省部分重点中学2023届高三上学期第二次联考化学试题
9 . 废弃物回收再利用是环境保护的重要课题。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)、锌灰(主要成分为Zn、ZnO,杂质为Fe及其氧化物)回收Cu并制备ZnO,其部分实验过程如下图所示:
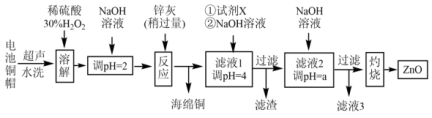
(1)铜帽溶解前需剪碎,其目的是_______ ,写出“溶解”过程中主要化学方程式_______ ,此过程不能加热的原因是_______ 。
(2)“反应”步骤为确定锌灰用量,以碘量法测定溶液中Cu2+含量:向含Cu2+待测液中加入过量KI溶液,再用Na2S2O3标准溶液滴定生成的 至终点,滴定原理如下:2Cu2++4I-=2CuI(白色)↓+I2;
至终点,滴定原理如下:2Cu2++4I-=2CuI(白色)↓+I2;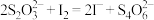 。
。
①滴定选用的指示剂为_______ ,滴定终点的现象是_______ 。
②若待测液中H2O2没有除尽,所测Cu2+含量将_______ (填“偏高”、“偏低”或“不变”)。
(3)已知:①滤液1中主要含有的金属离子有Zn2+、Fe2+;
②pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-;
③几种金属离子生成氧氧化物沉淀pH见下表。
利用滤液1制取ZnO,试剂X为_______ (填序号A.30% H2O2;B.1.0 mol/LHNO3),a的范围是_______ 。

(1)铜帽溶解前需剪碎,其目的是
(2)“反应”步骤为确定锌灰用量,以碘量法测定溶液中Cu2+含量:向含Cu2+待测液中加入过量KI溶液,再用Na2S2O3标准溶液滴定生成的
 至终点,滴定原理如下:2Cu2++4I-=2CuI(白色)↓+I2;
至终点,滴定原理如下:2Cu2++4I-=2CuI(白色)↓+I2;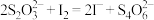 。
。①滴定选用的指示剂为
②若待测液中H2O2没有除尽,所测Cu2+含量将
(3)已知:①滤液1中主要含有的金属离子有Zn2+、Fe2+;
②pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-;
③几种金属离子生成氧氧化物沉淀pH见下表。
| 开始沉淀pH | 沉淀完全pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
您最近半年使用:0次
10 . 铍是原子能、火箭、导弹、航空以及冶金工业中不可缺少的宝贵材料。以绿柱石[Be3Al2(SiO3)6]为原料制备两性金属铍的工艺如图:

回答下列问题:
(1)绿柱石写成氧化物的形式为___________ 。
(2)750℃烧结时,Na3FeF6仅与绿柱石中BeO作用生成易溶于水的Na2BeF4,滤渣的主要成分是Fe2O3和___________ 。
(3)“水浸”时“产物压碎磨细”的目的是___________ ,为检验“过滤1”的滤液中是否含有Na+,可选用的方法是___________ (填方法名称)。
(4)“沉氟”的化学方程式为___________ 。
(5)镍坩埚作阴极、石墨作阳极,350~400℃电解NaCl-BeCl2熔融混合物得到金属铍,阳极反应式为___________ ;不能用该电解槽电解熔融氯化铍制金属铍的原因可能是___________ 。

回答下列问题:
(1)绿柱石写成氧化物的形式为
(2)750℃烧结时,Na3FeF6仅与绿柱石中BeO作用生成易溶于水的Na2BeF4,滤渣的主要成分是Fe2O3和
(3)“水浸”时“产物压碎磨细”的目的是
(4)“沉氟”的化学方程式为
(5)镍坩埚作阴极、石墨作阳极,350~400℃电解NaCl-BeCl2熔融混合物得到金属铍,阳极反应式为
您最近半年使用:0次



