1 . 钛和钛合金被认为是21世纪的重要金属材料,广泛用于火箭、飞机制造业等。如图是工业上利用钛铁矿,其主要成分为钛酸亚铁(FeTiO3)制备金属钛的工艺流程。
资料:Ti为固体,化学性质稳定,不溶于稀硫酸、稀盐酸等。
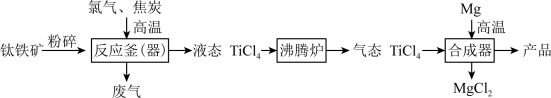
(1)钛酸亚铁(FeTiO3)中钛元素的化合价是___________ 。
(2)钛铁矿在投入反应釜前要先粉碎,其目的是___________ ;反应釜中发生的反应是: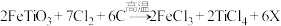 ,X为反应产生的废气,其化学式是
,X为反应产生的废气,其化学式是___________ 。
(3)反应釜中得到TiCl4和FeCl3的混合物在沸腾炉中分离,这是利用了TiCl4与FeCl3的___________ 不同。
(4)写出合成器中反应的化学方程式___________ 。
(5)利用上述方法制取的金属钛中可能会含有少量杂质,该杂质是金属___________ ,由金属钛的性质可知,除去这种杂质可以用___________ (填试剂名称)。
(6)依据“绿色低碳”理念,你认为该流程中存在的不足之处是___________ 。
资料:Ti为固体,化学性质稳定,不溶于稀硫酸、稀盐酸等。

(1)钛酸亚铁(FeTiO3)中钛元素的化合价是
(2)钛铁矿在投入反应釜前要先粉碎,其目的是
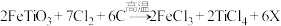 ,X为反应产生的废气,其化学式是
,X为反应产生的废气,其化学式是(3)反应釜中得到TiCl4和FeCl3的混合物在沸腾炉中分离,这是利用了TiCl4与FeCl3的
(4)写出合成器中反应的化学方程式
(5)利用上述方法制取的金属钛中可能会含有少量杂质,该杂质是金属
(6)依据“绿色低碳”理念,你认为该流程中存在的不足之处是
您最近一年使用:0次
名校
解题方法
2 . 黄铁矿的主要成分是FeS2,其中含有一定量的铜、钴等金属。某工厂在传统回收工艺的基础上进一步改进焙烧方式,研究出高效利用硫铁矿资源的工艺如下:
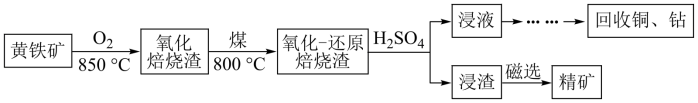
(1)黄铁矿焙烧之前需要粉碎,其目的是:_______
(2)①黄铁矿的氧化焙烧是制硫酸工艺的重要一步,其产物之一是 ,反应的化学方程式为:
,反应的化学方程式为:_______ ;
②制硫酸工艺中涉及反应2SO2+O2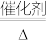 2SO3 ΔH<0,该反应需将温度控制在400-500℃,温度不宜过低的原因是
2SO3 ΔH<0,该反应需将温度控制在400-500℃,温度不宜过低的原因是_______ 。
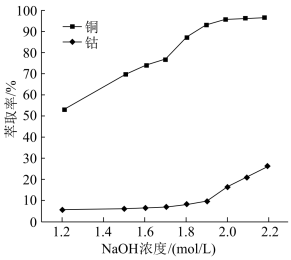
(3)用硫酸浸取后的浸渣能用磁选法分离,则该氧化物为_______ (填化学式);浸液通过加入萃取剂可实现铜和钴的分离,在萃取前加入NaOH溶液乳化可提高分离效率,不同浓度的溶液对萃取率的影响如图,则NaOH溶液最佳的浓度为_______ 。
已知黄铁矿氧化焙烧前后主要元素质量分数如表,为测定铜的浸出率,取50 g焙烧后的烧渣,经处理后测得Cu2+物质的量为5×10-3 mol,则铜离子的浸出率为_______ (结果保留三位有效数字)。

(1)黄铁矿焙烧之前需要粉碎,其目的是:
(2)①黄铁矿的氧化焙烧是制硫酸工艺的重要一步,其产物之一是
 ,反应的化学方程式为:
,反应的化学方程式为:②制硫酸工艺中涉及反应2SO2+O2
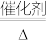 2SO3 ΔH<0,该反应需将温度控制在400-500℃,温度不宜过低的原因是
2SO3 ΔH<0,该反应需将温度控制在400-500℃,温度不宜过低的原因是(3)用硫酸浸取后的浸渣能用磁选法分离,则该氧化物为

已知黄铁矿氧化焙烧前后主要元素质量分数如表,为测定铜的浸出率,取50 g焙烧后的烧渣,经处理后测得Cu2+物质的量为5×10-3 mol,则铜离子的浸出率为
| 项目 | Fe | S | Cu | Co |
| 焙烧前(%) | 40.28 | 42.55 | 0.53 | 0.022 |
| 焙烧后(%) | 53.08 | 0.96 | 0.76 | 0.047 |
您最近一年使用:0次
3 . 金属钼(Mo)、镍(Ni)是重要的战略金属,广泛应用在钢铁、化工等领域,辉银矿的主要 ,还含有Ni、V、Fe等金属元素,处理辉钼矿有火法和湿法两种工艺。下图是用NaClO溶液(pH>9)湿法浸取辉钼矿制备仲钼酸铵[
,还含有Ni、V、Fe等金属元素,处理辉钼矿有火法和湿法两种工艺。下图是用NaClO溶液(pH>9)湿法浸取辉钼矿制备仲钼酸铵[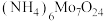 ]的工艺流程(已知:次氯酸钠溶液化学性质不稳定,常温下缓慢分解成NaCl,
]的工艺流程(已知:次氯酸钠溶液化学性质不稳定,常温下缓慢分解成NaCl, 和
和 )。
)。
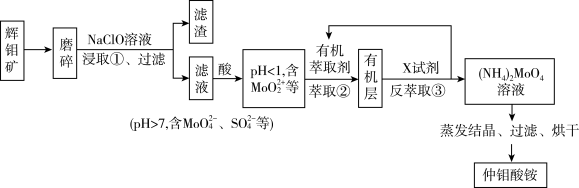
请回答下列问题:
(1)传统的火法工艺是在空气中灼烧辉铝矿得到 和
和 ,和上述湿法工艺相比这种方法最大的缺陷是
,和上述湿法工艺相比这种方法最大的缺陷是_______ 。
(2)浸取辉钼矿之前要先将辉钼矿磨碎,目的是_______ 。
(3)步骤①中 溶于NaClO溶液,发生反应的离子方程式为
溶于NaClO溶液,发生反应的离子方程式为_______ 。
(4)步骤②由于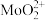 易溶于有机萃取剂,可以发生草取。步骤③反萃取时使用的X试剂为
易溶于有机萃取剂,可以发生草取。步骤③反萃取时使用的X试剂为_______ ,步骤②③的作用为_______ 。
(5)某科研小组研究温度对步骤①中浸取率的影响。实验条件为NaClO)的浓度为130g/L,汉取液pH=9。反应时间1.5h温度控制为采用冷水浴冷却和不冷却两种,实验结果见下表:
出现上表实验结果的原因为_______ 。
(6)碳钢在空气中容易被腐蚀,加入钼酸盐有利于缓蚀,其缓蚀原理是在钢铁表面形成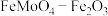 保护膜。密闭式循环冷却水系统中的碳铜管道缓蚀,除需加入钼酸盐外还需加入
保护膜。密闭式循环冷却水系统中的碳铜管道缓蚀,除需加入钼酸盐外还需加入 ,则
,则 的作用是
的作用是_______ 。
 ,还含有Ni、V、Fe等金属元素,处理辉钼矿有火法和湿法两种工艺。下图是用NaClO溶液(pH>9)湿法浸取辉钼矿制备仲钼酸铵[
,还含有Ni、V、Fe等金属元素,处理辉钼矿有火法和湿法两种工艺。下图是用NaClO溶液(pH>9)湿法浸取辉钼矿制备仲钼酸铵[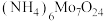 ]的工艺流程(已知:次氯酸钠溶液化学性质不稳定,常温下缓慢分解成NaCl,
]的工艺流程(已知:次氯酸钠溶液化学性质不稳定,常温下缓慢分解成NaCl, 和
和 )。
)。
请回答下列问题:
(1)传统的火法工艺是在空气中灼烧辉铝矿得到
 和
和 ,和上述湿法工艺相比这种方法最大的缺陷是
,和上述湿法工艺相比这种方法最大的缺陷是(2)浸取辉钼矿之前要先将辉钼矿磨碎,目的是
(3)步骤①中
 溶于NaClO溶液,发生反应的离子方程式为
溶于NaClO溶液,发生反应的离子方程式为(4)步骤②由于
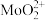 易溶于有机萃取剂,可以发生草取。步骤③反萃取时使用的X试剂为
易溶于有机萃取剂,可以发生草取。步骤③反萃取时使用的X试剂为(5)某科研小组研究温度对步骤①中浸取率的影响。实验条件为NaClO)的浓度为130g/L,汉取液pH=9。反应时间1.5h温度控制为采用冷水浴冷却和不冷却两种,实验结果见下表:
| 反应条性 | 反应现象和结果 |
| 冷水浴 | 反应温度保持30℃左右,Mo元素的浸取率为83.3%。 |
| 不冷却 | 温度上升很快,最高为60℃左右,有大量的气泡产生,Mo元素的浸取率为7.8%。 |
(6)碳钢在空气中容易被腐蚀,加入钼酸盐有利于缓蚀,其缓蚀原理是在钢铁表面形成
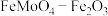 保护膜。密闭式循环冷却水系统中的碳铜管道缓蚀,除需加入钼酸盐外还需加入
保护膜。密闭式循环冷却水系统中的碳铜管道缓蚀,除需加入钼酸盐外还需加入 ,则
,则 的作用是
的作用是
您最近一年使用:0次
4 . 工业上用菱锰矿(MnCO3)[含FeCO3、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
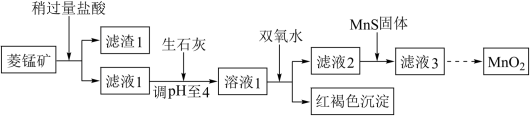
已知:1.Ksp(CuS)=1.27×10-36,Ksp(MnS)=4.65×10-14
2.生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1 mol/L
(1)基态Mn原子价层电子的轨道表示式为___________
(2)含杂质的菱锰矿使用前需将其粉碎,主要目的是___________ 。
(3)向溶液1中加入双氧水时,反应的离子方程式是___________ 。
(4)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,用沉淀溶解平衡 。解释加入难溶电解质MnS的作用___________ 。
(5)制备MnO2的另一种方法是电解法。用惰性电极电解MnCl2溶液可以制得MnO2
①生成MnO2的电极反应式是___________ 。
②若直接电解MnCl2溶液,生成MnO2的电极上同时会产生少量气体。用电极反应式解释产生此气体的原因___________ 。

已知:1.Ksp(CuS)=1.27×10-36,Ksp(MnS)=4.65×10-14
2.生成氢氧化物沉淀的pH
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
(1)基态Mn原子价层电子的轨道表示式为
(2)含杂质的菱锰矿使用前需将其粉碎,主要目的是
(3)向溶液1中加入双氧水时,反应的离子方程式是
(4)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,用
(5)制备MnO2的另一种方法是电解法。用惰性电极电解MnCl2溶液可以制得MnO2
①生成MnO2的电极反应式是
②若直接电解MnCl2溶液,生成MnO2的电极上同时会产生少量气体。用电极反应式解释产生此气体的原因
您最近一年使用:0次
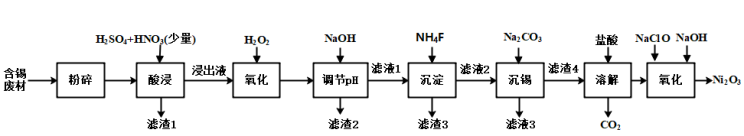
5 . 三氧化二镍(Ni2O3)是一种灰黑色、无气味、有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料生产NiCl2,继而生产Ni2O3,其工艺流程如下:
已知:①下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算)。
②25℃时,Ksp(NiCO3)= 1×10-6
回答下列问题:
(1)“酸浸”过程中,l mol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式:_______ 。
(2)“酸浸”后的酸性溶液中加入H2O2的目的是_______ 。
(3)“沉镍”前需加NaOH控制溶液pH的范围为_______ ;“滤渣1”的主要成分有_______ 。
(4)“氧化”时生成Ni2O3的离子方程式为_______ 。
(5)保持其他条件不变,在不同温度下对含镍废料进行“酸浸”,镍的浸出率随时间变化如图。“酸浸”的最佳温度与时间分别为_______ ℃、_______ min。

(6)“沉镍”过程中,若滤液中c(Ni2+)= 2.0 mol/L,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤1×10-5mol/L],则需要加入Na2CO3固体的质量最少为_______ 。(不考虑 水解,计算结果保留两位小数)
水解,计算结果保留两位小数)

已知:①下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算)。
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 3.0 | 6.7 |
| 沉淀完全的pH | 3.2 | 9.0 | 4.7 | 9.2 |
回答下列问题:
(1)“酸浸”过程中,l mol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式:
(2)“酸浸”后的酸性溶液中加入H2O2的目的是
(3)“沉镍”前需加NaOH控制溶液pH的范围为
(4)“氧化”时生成Ni2O3的离子方程式为
(5)保持其他条件不变,在不同温度下对含镍废料进行“酸浸”,镍的浸出率随时间变化如图。“酸浸”的最佳温度与时间分别为

(6)“沉镍”过程中,若滤液中c(Ni2+)= 2.0 mol/L,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤1×10-5mol/L],则需要加入Na2CO3固体的质量最少为
 水解,计算结果保留两位小数)
水解,计算结果保留两位小数)
您最近一年使用:0次
2022-01-22更新
|
158次组卷
|
2卷引用: 山西省太原市2021-2022学年高三上学期期末考试化学试题
名校
6 . 某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)硫酸铜溶液可以加快氢气生成速率的原因是___ 。
(2)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4四种溶液,可与实验中CuSO4溶液起相似作用的是__ 。
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入六个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
①请完成此实验设计,其中:V1=___ ,V6=___ ,V9=___ 。
②反应一段时间后,实验A中的金属呈___ 色,实验E中的金属呈___ 色。
③该同学最后得出的结论为当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因:___ 。
(1)硫酸铜溶液可以加快氢气生成速率的原因是
(2)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4四种溶液,可与实验中CuSO4溶液起相似作用的是
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入六个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 | A | B | C | D | E | F |
| 4 mol∙L−1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②反应一段时间后,实验A中的金属呈
③该同学最后得出的结论为当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因:
您最近一年使用:0次
解题方法
7 .  可作为水溶液中
可作为水溶液中 歧化反应的催化剂:
歧化反应的催化剂: 。实验小组探究浓度、催化剂、溶液酸性对
。实验小组探究浓度、催化剂、溶液酸性对 歧化反应速率的影响,分别在盛有反应物的试管中加入2 mL相应试剂,密闭放置观察现象。(已知:
歧化反应速率的影响,分别在盛有反应物的试管中加入2 mL相应试剂,密闭放置观察现象。(已知: 易溶解在KI溶液中)
易溶解在KI溶液中)
回答下列问题
(1)实验②、③的目的是_______ 。
(2)实验①、⑤说明 单独存在时不具有催化作用,实验①、③说明
单独存在时不具有催化作用,实验①、③说明_______ ,④是③的对比实验,则a=_______ ,可得出的结论是_______ 。
(3)查阅资料知 催化
催化 歧化反应过程分为两步,写出反应ⅱ的离子方程式。
歧化反应过程分为两步,写出反应ⅱ的离子方程式。
ⅰ.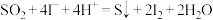
ⅱ._______
(4)实验表明, 的歧化反应速率⑥>③,则
的歧化反应速率⑥>③,则 催化
催化 歧化反应过程中
歧化反应过程中_______ (填“ⅰ”或“ⅱ”)步反应速率更快,试分析实验⑥中 的歧化反应速率快于实验③的原因
的歧化反应速率快于实验③的原因_______ 。
 可作为水溶液中
可作为水溶液中 歧化反应的催化剂:
歧化反应的催化剂: 。实验小组探究浓度、催化剂、溶液酸性对
。实验小组探究浓度、催化剂、溶液酸性对 歧化反应速率的影响,分别在盛有反应物的试管中加入2 mL相应试剂,密闭放置观察现象。(已知:
歧化反应速率的影响,分别在盛有反应物的试管中加入2 mL相应试剂,密闭放置观察现象。(已知: 易溶解在KI溶液中)
易溶解在KI溶液中)| 实验编号 | 反应物 | 试剂组成 | 实验现象 |
| ① | 18mL  饱和溶液 饱和溶液 | 无明显现象 | |
| ② | 18mL  稀溶液 稀溶液 | 0.4 KI KI | 出现浑浊较③慢 |
| ③ | 18mL  饱和溶液 饱和溶液 | 0.4 KI KI | 一段时间出现浑浊 |
| ④ | 18mL  饱和溶液 饱和溶液 | a KI、0.2 KI、0.2  | 出现浑浊较③快 |
| ⑤ | 18mL  饱和溶液 饱和溶液 | 0.2  | 无明显现象 |
| ⑥ | 18mL  饱和溶液 饱和溶液 | 0.2 KI、0.0002mol KI、0.0002mol  | 出现浑浊较③快 |
(1)实验②、③的目的是
(2)实验①、⑤说明
 单独存在时不具有催化作用,实验①、③说明
单独存在时不具有催化作用,实验①、③说明(3)查阅资料知
 催化
催化 歧化反应过程分为两步,写出反应ⅱ的离子方程式。
歧化反应过程分为两步,写出反应ⅱ的离子方程式。ⅰ.
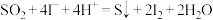
ⅱ.
(4)实验表明,
 的歧化反应速率⑥>③,则
的歧化反应速率⑥>③,则 催化
催化 歧化反应过程中
歧化反应过程中 的歧化反应速率快于实验③的原因
的歧化反应速率快于实验③的原因
您最近一年使用:0次
8 . 辉铜矿主要成分Cu2S,此外还含有少量SiO2、Fe2O3等杂质,软锰矿主要含有MnO2,以及少量SiO2、Fe2O3等杂质。研究人员开发综合利用这两种资源,用同槽酸浸湿法冶炼工艺,制备硫酸锰晶体和碱式碳酸铜。主要工艺流程如下:
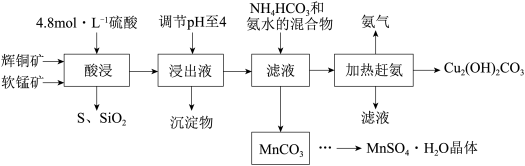
已知:
①MnO2有较强的氧化性,能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水溶液中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围(开始沉淀和完全沉淀的pH):
④MnSO4·H2O溶于1份冷水、0.6份沸水,不溶于乙醇。
(1)实验室配制240mL 4.8mol•L-1的稀硫酸,所需的玻璃仪器除玻璃棒、量筒、烧杯以外还需要___________ 。
(2)酸浸时,为了提高浸取率可采取的措施有___________ (任写一点)。
(3)酸浸时,得到浸出液中主要含有CuSO4、MnSO4等。写出该反应的化学方程式:___________ 。
(4)调节浸出液pH=4的作用是___________ 。
(5)写出流程中生成MnCO3的离子方程式___________ 。
(6)MnCO3先加稀硫酸溶解,在经过___________ 得到MnSO4·H2O晶体
(7)本工艺中可循环使用的物质是___________ (写化学式)。

已知:
①MnO2有较强的氧化性,能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水溶液中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围(开始沉淀和完全沉淀的pH):
| 金属离子 | Fe3+ | Mn2+ | Cu2+ |
| 开始沉淀pH值 | 1.5 | 8.3 | 4.4 |
| 完全沉淀pH值 | 3.2 | 9.8 | 6.4 |
(1)实验室配制240mL 4.8mol•L-1的稀硫酸,所需的玻璃仪器除玻璃棒、量筒、烧杯以外还需要
(2)酸浸时,为了提高浸取率可采取的措施有
(3)酸浸时,得到浸出液中主要含有CuSO4、MnSO4等。写出该反应的化学方程式:
(4)调节浸出液pH=4的作用是
(5)写出流程中生成MnCO3的离子方程式
(6)MnCO3先加稀硫酸溶解,在经过
(7)本工艺中可循环使用的物质是
您最近一年使用:0次
名校
解题方法
9 . I.某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”,进行了如下实验:2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O。
请回答:
(1)实验计时方法是从溶液混合开始计时,至___________ 时计时结束。
(2)V1=___________ ,V2=___________ ;
(3)设计实验Ⅰ.Ⅲ的目的是___________ 。
(4)利用实验Ⅲ中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=___________ 。
(5)有同学在实验中发现酸性高锰酸钾溶液和草酸溶液反应时,开始一段时间反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大。某同学认为是放热导致溶液温度升高所致,重做Ⅰ号实验,测定实验过程中不同时刻溶液的温度,结果温度没有明显变化。由此你得出的结论是:可能是是反应产物有___________ 作用。Ⅳ号实验是为验证你的猜测,实验中要加入的少量某种物质是___________ (填化学式)。
II.相同温度条件下,分别用3支试管按下列方式完成A、B、C三组实验:
上述实验能否说明“相同条件下,反应物浓度越大,反应速率越快”___________ (选填“能”或“不能”);简述你的理由:___________
| 编号 | 酸性KMnO4溶液(0.01mol·L-1) | H2C2O4溶液(0.1mol·L-1) | 水 | 某种物质 | 反应温度(℃) | 反应时间(min) |
| Ⅰ | 2mL | 2mL | 0 | 0 | 20 | 2.1 |
| Ⅱ | V1mL | 2mL | 1mL | 0 | 20 | 5.5 |
| Ⅲ | V2mL | 2mL | 0 | 0 | 50 | 0.5 |
| Ⅳ | 2mL | 2mL | 0 | 少量 | 20 | 0.2 |
(1)实验计时方法是从溶液混合开始计时,至
(2)V1=
(3)设计实验Ⅰ.Ⅲ的目的是
(4)利用实验Ⅲ中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=
(5)有同学在实验中发现酸性高锰酸钾溶液和草酸溶液反应时,开始一段时间反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大。某同学认为是放热导致溶液温度升高所致,重做Ⅰ号实验,测定实验过程中不同时刻溶液的温度,结果温度没有明显变化。由此你得出的结论是:可能是是反应产物有
II.相同温度条件下,分别用3支试管按下列方式完成A、B、C三组实验:
| 试管 | A | B | C |
| 加入试剂 | 4mL0.01mol/LKMnO4 1ml0.1moL/LH2SO4 2mL0.1mol/LH2C2O4 | 4mL0.02mol/LKMnO4 1ml0.1moL/LH2SO4 2mL0.1mol/LH2C2O4 | 4mL0.03mol/LKMnO4 1ml0.1moL/LH2SO4 2mL0.1mol/LH2C2O4 |
| 褪色时间 | 28秒 | 30秒 | 不褪色 |
您最近一年使用:0次
20-21高三下·浙江·阶段练习
10 . 合成氨工业是人工固氮的重要途径,氨气是工农业生产中的重要物质。请回答以下问题:
(1)下列说法不正确的是___________
A.实验室制备氨气时,可以用CaCl2固体干燥氨气
B.在浓氨水中加入生石灰可制备少量氨气
C.合成氨塔中,需要有热交换装置,便于能量的有效利用
D.合成氨工业中,可将氨气液化,并不断将液氨移去,利于提高NH3的产率
(2)氨是制取硝酸的重要原料。氨的催化氧化过程主要有以下两个反应:
I.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔHI
4NO(g)+6H2O(g) ΔHI
II.4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ΔHII
2N2(g)+6H2O(g) ΔHII
不同温度下氨氧化的平衡常数如下(p=0.1013Mpa):
①下列说法正确的是___________
A.ΔHI>0,ΔHII>0
B.如果对反应不加控制,氨和氧气反应的最终产物主要是N2
C.为使反应有利于朝生成更多的NO方向进行,不必关注热力学问题(平衡移动问题),需要关注动力学问题(反应速率问题)
D.在实际生产中,需采用高压氧化,以利于提高NO的产率
E.反应中需控制氨氧比、选择性催化剂的形状、气固相接触时间等
②在实际工业生产中,温度一般需要在750℃~850℃左右,其主要原因是___________
(3)已知可通过下列方法合成尿素:
第一步:2NH3(1)+CO2(g) H2NCOONH4(1) ΔH=-159.5kJ/mol
H2NCOONH4(1) ΔH=-159.5kJ/mol
第二步:H2NCOONH4(1) CO(NH2)2(1)+H2O(1) ΔH=+28.5kJ/mol
CO(NH2)2(1)+H2O(1) ΔH=+28.5kJ/mol
在体积为5L的密闭容器中加入1molCO2和4molNH3,在一定条件下反应进行到10min时,测得CO2和尿素的物质的量均为0.25mol,如图所示。
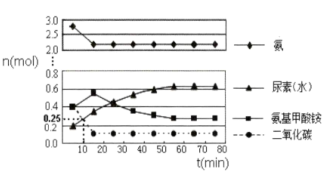
①若用单位时间内物质的量的变化来表示固体或纯液体的反应速率,则10min内第一步反应中生成H2NCOONH4(1)[氨基甲酸铵]的平均反应速率为___________
②反应进行15分钟后,随着时间的变化,尿素和氨基甲酸铵的物质的量变化比较明显,但氨气和二氧化碳的变化很小,其主要原因是___________ 。
(1)下列说法不正确的是
A.实验室制备氨气时,可以用CaCl2固体干燥氨气
B.在浓氨水中加入生石灰可制备少量氨气
C.合成氨塔中,需要有热交换装置,便于能量的有效利用
D.合成氨工业中,可将氨气液化,并不断将液氨移去,利于提高NH3的产率
(2)氨是制取硝酸的重要原料。氨的催化氧化过程主要有以下两个反应:
I.4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) ΔHI
4NO(g)+6H2O(g) ΔHIII.4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) ΔHII
2N2(g)+6H2O(g) ΔHII不同温度下氨氧化的平衡常数如下(p=0.1013Mpa):
| 温度(℃) | 300 | 500 | 700 | 900 | 1100 |
| 反应I(KI) | 6.3×1041 | 1.1×1026 | 2.1×1019 | 3.8×1015 | 3.4×1011 |
| 反应II(KII) | 7.3×1056 | 7.1×1034 | 2.6×1025 | 1.5×1020 | 6.7×1016 |
A.ΔHI>0,ΔHII>0
B.如果对反应不加控制,氨和氧气反应的最终产物主要是N2
C.为使反应有利于朝生成更多的NO方向进行,不必关注热力学问题(平衡移动问题),需要关注动力学问题(反应速率问题)
D.在实际生产中,需采用高压氧化,以利于提高NO的产率
E.反应中需控制氨氧比、选择性催化剂的形状、气固相接触时间等
②在实际工业生产中,温度一般需要在750℃~850℃左右,其主要原因是
(3)已知可通过下列方法合成尿素:
第一步:2NH3(1)+CO2(g)
 H2NCOONH4(1) ΔH=-159.5kJ/mol
H2NCOONH4(1) ΔH=-159.5kJ/mol第二步:H2NCOONH4(1)
 CO(NH2)2(1)+H2O(1) ΔH=+28.5kJ/mol
CO(NH2)2(1)+H2O(1) ΔH=+28.5kJ/mol在体积为5L的密闭容器中加入1molCO2和4molNH3,在一定条件下反应进行到10min时,测得CO2和尿素的物质的量均为0.25mol,如图所示。

①若用单位时间内物质的量的变化来表示固体或纯液体的反应速率,则10min内第一步反应中生成H2NCOONH4(1)[氨基甲酸铵]的平均反应速率为
②反应进行15分钟后,随着时间的变化,尿素和氨基甲酸铵的物质的量变化比较明显,但氨气和二氧化碳的变化很小,其主要原因是
您最近一年使用:0次



