2022高三·全国·专题练习
真题
名校
1 . 某兴趣小组设计实验探究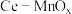 ,催化空气氧化
,催化空气氧化 的效率。回答下列问题:
的效率。回答下列问题:
步骤Ⅰ 制备
在通风橱中用下图装置制备 (加热及夹持装置省略),反应方程式:
(加热及夹持装置省略),反应方程式: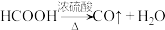

(1)装置A中盛放甲酸的仪器的名称是_______ 。
(2)从B、C、D中选择合适的装置收集 ,正确的接口连接顺序为a→_______→_______→_______→_______→h(每空填一个接口标号)。
,正确的接口连接顺序为a→_______→_______→_______→_______→h(每空填一个接口标号)。______
步骤Ⅱ 检验
将 通入新制银氨溶液中,有黑色沉淀生成。
通入新制银氨溶液中,有黑色沉淀生成。
(3)该反应的化学方程式为_______ 。
步骤Ⅲ 探究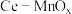 催化空气氧化
催化空气氧化 的效率
的效率
将一定量 与空气混合,得到
与空气混合,得到 体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至
体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至 ,按一定流速通入气体样品。(已知:
,按一定流速通入气体样品。(已知: 是白色固体,易吸水潮解:
是白色固体,易吸水潮解: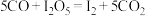 )
)
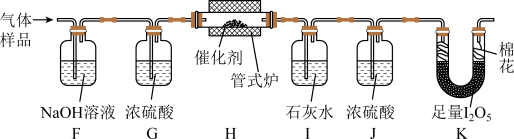
(4)通入 (已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了
(已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了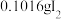 。
。
①能证明 被空气氧化的现象是
被空气氧化的现象是_______ ;
② 被催化氧化的百分率为
被催化氧化的百分率为_______ ;
③若未通入氮气,②的结果将_______ (填“偏大”“偏小”或“无影响”)。
(5)探究气体与催化剂接触时长对催化氧化效率的影响时,采用_______ 方法可以缩短接触时长。
(6)步骤Ⅲ装置存在的不足之处是_______ 。
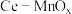 ,催化空气氧化
,催化空气氧化 的效率。回答下列问题:
的效率。回答下列问题:步骤Ⅰ 制备

在通风橱中用下图装置制备
 (加热及夹持装置省略),反应方程式:
(加热及夹持装置省略),反应方程式: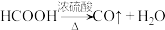

(1)装置A中盛放甲酸的仪器的名称是
(2)从B、C、D中选择合适的装置收集
 ,正确的接口连接顺序为a→_______→_______→_______→_______→h(每空填一个接口标号)。
,正确的接口连接顺序为a→_______→_______→_______→_______→h(每空填一个接口标号)。步骤Ⅱ 检验

将
 通入新制银氨溶液中,有黑色沉淀生成。
通入新制银氨溶液中,有黑色沉淀生成。(3)该反应的化学方程式为
步骤Ⅲ 探究
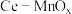 催化空气氧化
催化空气氧化 的效率
的效率将一定量
 与空气混合,得到
与空气混合,得到 体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至
体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至 ,按一定流速通入气体样品。(已知:
,按一定流速通入气体样品。(已知: 是白色固体,易吸水潮解:
是白色固体,易吸水潮解: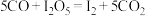 )
)
(4)通入
 (已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了
(已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了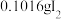 。
。①能证明
 被空气氧化的现象是
被空气氧化的现象是②
 被催化氧化的百分率为
被催化氧化的百分率为③若未通入氮气,②的结果将
(5)探究气体与催化剂接触时长对催化氧化效率的影响时,采用
(6)步骤Ⅲ装置存在的不足之处是
您最近半年使用:0次
2023-02-20更新
|
6401次组卷
|
15卷引用:安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试变式题(实验探究题)
(已下线)安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试变式题(实验探究题)(已下线)安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试举一反三(实验探究题)(已下线)专题16 化学实验综合题-2022年高考真题模拟题分项汇编2022年福建省高考真题化学试题(已下线)2022年福建省高考真题变式题(实验探究题)(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题突破卷13 化学实验基础(二)-2024年高考化学一轮复习考点通关卷(新教材新高考)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)山东省新泰市第一中学(弘文部)2023-2024学年高三上学期第二次月考化学试题福建省莆田第一中学2023-2024学年高一上学期期末考试化学试题宁夏回族自治区石嘴山市第三中学2023-2024学年高三上学期期末考试理综试题-高中化学天津市耀华中学2023-2024学年高三下学期开学验收考化学试卷
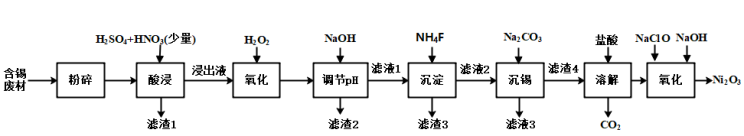
2 . 三氧化二镍(Ni2O3)是一种灰黑色、无气味、有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料生产NiCl2,继而生产Ni2O3,其工艺流程如下:
已知:①下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算)。
②25℃时,Ksp(NiCO3)= 1×10-6
回答下列问题:
(1)“酸浸”过程中,l mol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式:_______ 。
(2)“酸浸”后的酸性溶液中加入H2O2的目的是_______ 。
(3)“沉镍”前需加NaOH控制溶液pH的范围为_______ ;“滤渣1”的主要成分有_______ 。
(4)“氧化”时生成Ni2O3的离子方程式为_______ 。
(5)保持其他条件不变,在不同温度下对含镍废料进行“酸浸”,镍的浸出率随时间变化如图。“酸浸”的最佳温度与时间分别为_______ ℃、_______ min。

(6)“沉镍”过程中,若滤液中c(Ni2+)= 2.0 mol/L,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤1×10-5mol/L],则需要加入Na2CO3固体的质量最少为_______ 。(不考虑 水解,计算结果保留两位小数)
水解,计算结果保留两位小数)

已知:①下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算)。
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 3.0 | 6.7 |
| 沉淀完全的pH | 3.2 | 9.0 | 4.7 | 9.2 |
回答下列问题:
(1)“酸浸”过程中,l mol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式:
(2)“酸浸”后的酸性溶液中加入H2O2的目的是
(3)“沉镍”前需加NaOH控制溶液pH的范围为
(4)“氧化”时生成Ni2O3的离子方程式为
(5)保持其他条件不变,在不同温度下对含镍废料进行“酸浸”,镍的浸出率随时间变化如图。“酸浸”的最佳温度与时间分别为

(6)“沉镍”过程中,若滤液中c(Ni2+)= 2.0 mol/L,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤1×10-5mol/L],则需要加入Na2CO3固体的质量最少为
 水解,计算结果保留两位小数)
水解,计算结果保留两位小数)
您最近半年使用:0次
2022-01-22更新
|
158次组卷
|
2卷引用:安徽师范大学附属中学2021-2022学年高三下学期第八次综合测试理综化学试题
名校
解题方法
3 . 对Pd单原子催化剂(Pd/SVG)上H2还原NO的反应进行研究,发现Pd/SVG上NO被还原生成N2和NH3的路径机理如图所示:
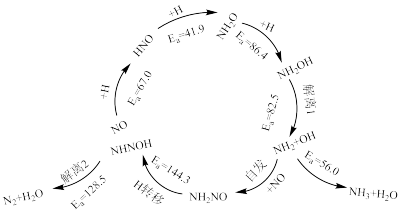
下列说法正确的是

下列说法正确的是
| A.Pd/SVG可以改变NO的平衡转化率 |
| B.NO被还原为N2的总反应为2NO+2H2=N2+2H2O |
| C.NO被还原为NH3的反应决速步为解离1反应 |
| D.Pd/SVG上H2还原NO过程中产物N2的形成更容易 |
您最近半年使用:0次
2021-09-04更新
|
915次组卷
|
3卷引用:安徽省蚌埠市2022届高三上学期第一次教学质量检查化学试题
安徽省蚌埠市2022届高三上学期第一次教学质量检查化学试题安徽省亳州市第二中学2021-2022学年高二上学期期中考试化学试题(已下线)第二单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)
名校
解题方法
4 . 下列过程中需要加快反应速率的是
| A.钢铁腐蚀 | B.工业炼钢 | C.食物腐烂 | D.塑料老化 |
您最近半年使用:0次
2021-02-08更新
|
121次组卷
|
25卷引用:2014-2015学年安徽省淮北师大附属实验中学高一下期中化学试卷
2014-2015学年安徽省淮北师大附属实验中学高一下期中化学试卷安徽省滁州市定远县西片三校2017-2018学年高二上学期期末考试化学试题(已下线)2010年新疆哈巴河县高级中学高二上学期第一次月考化学试题(已下线)2011-2012年广西北海合浦县教育局教研室高二上学期期中考试化学(理)试卷(已下线)2011-2012年山东济南外国语学校高二下学期期中考试文科化学试卷(已下线)2012-2013学年甘肃永昌一中高二上学期期中考试文科化学试卷(已下线)2013届山东省德州市某中学高三12月月考化学试卷(已下线)2012-2013学年浙江省宁海县正学中学高二下学期第一次阶段性测试化学试卷2014-2015河南省周口中英文学校高一下学期期中考试化学试卷2015-2016学年河南省三门峡市陕州中学高二上学期期中测试化学试卷2016-2017学年河北省武邑中学高二上入学考试化学试卷2016-2017学年河北省武邑中学高二上8.28周考化学卷2016-2017学年河北省武邑中学高二上9.21周考化学卷甘肃省武威第十八中学2017-2018学年高二上学期第二次月考化学试题【全国百强校】福建省厦门第一中学2017-2018学年高二下学期期中考试化学试题黑龙江省伊春市第二中学2017-2018学年高一下学期期末考试(文)化学试题黑龙江省伊春市第二中学2018-2019学年高二(理)上学期期中考试化学试题湖南省邵东县创新实验学校2018-2019学年高一下学期期中考试化学试题2016-2017学年上海市闵行区七宝中学高二(上)开学化学试卷福建省福州福清市2017-2018学年高二上学期期中考试化学(理)试题吉林省辽源市田家炳高级中学校2020-2021学年高二上学期期中考试化学试题黑龙江省八校2020-2021学年高二上学期摸底考试化学试题云南省玉溪第二中学2020-2021学年高二上学期期中质量检测化学试题新疆乌鲁木齐市第二十中学2020-2021学年高二上学期期末考试化学试题陕西省汉滨区五里高级中学2022-2023学年高二上学期期中考试化学试题
名校
解题方法
5 . 硫酸是中学最常见的三大强酸之一,某研究性学习小组探究外界条件对铁与硫酸反应速率的影响。
[实验设计]控制用同种铁块,初始使用硫酸体积均为1000mL,恒定实验温度在298K或313K(其余实验条件见表),设计如下对比试验。
(1)请完成以下实验设计表(表中不要留空格)。
[解释与结论]
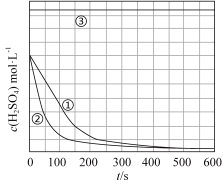
(2)实验①、②表明___________
请再提出一种加快该反应速率的方法___________
(3)实验③得出的结论是:当硫酸浓度为18.4 mol/L,________ ,原因是__________
[思考与交流]
(4)实验③,若t1时开始加热,在铁的表面逐渐产生气泡,当有大量气泡产生时,控制反应温度基本不变。甲同学将收集到的气体体积与时间的关系粗略地表示为图2。t1~t2时间段,反应生成的气体是_________ 。写出开始加热时发生反应的化学方程式:___ 。

[实验设计]控制用同种铁块,初始使用硫酸体积均为1000mL,恒定实验温度在298K或313K(其余实验条件见表),设计如下对比试验。
(1)请完成以下实验设计表(表中不要留空格)。
| 实验 编号 | 实验目的 | T/K | Fe/g | c(H2SO4)/ mol·L-1 |
| ① | 为以下实验作参考 | 298 | 10 | 1.0 |
| ② | 探究温度对反应速率的影响 | |||
| ③ | 298 | 10 | 18.4 |

[解释与结论]
(2)实验①、②表明
请再提出一种加快该反应速率的方法
(3)实验③得出的结论是:当硫酸浓度为18.4 mol/L,
[思考与交流]
(4)实验③,若t1时开始加热,在铁的表面逐渐产生气泡,当有大量气泡产生时,控制反应温度基本不变。甲同学将收集到的气体体积与时间的关系粗略地表示为图2。t1~t2时间段,反应生成的气体是

您最近半年使用:0次
6 . 化学反应速率与生产、生活密切相关,下列图片涉及的反应应该加快的是()
A.钢构大桥腐蚀 | B.兵马俑腐蚀 |
C.牛奶变质 | D.合成氨 |
您最近半年使用:0次
2019-12-13更新
|
119次组卷
|
2卷引用:安徽省宣城市七校(郎溪、旌德、广德、泾县、绩溪、宣城二中等)2019-2020学年高二上学期期中联考化学试题
名校
解题方法
7 . 某同学进行了硫代硫酸钠与硫酸反应的有关实验,实验过程的数据记录如下(见表格),请结合表中信息,回答有关问题:
(1)写出反应的离子方程式_____________________ 。
(2)根据你所掌握的知识判断,在上述实验中,反应速率最快的可能是______ (填实验序号)。
(3)在比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即需要控制好与实验有关的各项反应条件,其中:
①能说明温度对该反应速率影响的组合是__________ (填实验序号);
②A和B、A和C的组合比较,所研究的问题是________________________________ ;
③B和C组合比较,所研究的问题是________________________________________ 。
(4)教材中利用了出现黄色沉淀的快慢来比较反应速率的快慢,请你分析为何不采用排水法测量单位时间内气体体积的大小进行比较:_________________ 。
| 实验 序号 | 反应温 度/℃ | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | ||
| A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
| C | 20 | 10 | 0.1 | 5 | 0.1 | 5 |
| D | 40 | 10 | 0.1 | 10 | 0.1 | 0 |
(1)写出反应的离子方程式
(2)根据你所掌握的知识判断,在上述实验中,反应速率最快的可能是
(3)在比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即需要控制好与实验有关的各项反应条件,其中:
①能说明温度对该反应速率影响的组合是
②A和B、A和C的组合比较,所研究的问题是
③B和C组合比较,所研究的问题是
(4)教材中利用了出现黄色沉淀的快慢来比较反应速率的快慢,请你分析为何不采用排水法测量单位时间内气体体积的大小进行比较:
您最近半年使用:0次
2019-11-15更新
|
106次组卷
|
2卷引用:安徽省黄山市屯溪第一中学2019-2020学年高二上学期期中考试化学试题
名校
8 . O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。
据表中的递变规律,推测O3分别在条件①40℃、pH=3.0,②10℃、pH=5.0,③30℃、pH=7.0下,分解速率依次增大的顺序为
| T/℃ t/min pH | 3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
| A.①②③ | B.③②① | C.②①③ | D.③①② |
您最近半年使用:0次
2019-04-26更新
|
499次组卷
|
8卷引用:安徽省淮北市第一中学2019-2020学年高一下学期期中考试化学试题
安徽省淮北市第一中学2019-2020学年高一下学期期中考试化学试题【全国百强校】河南省郑州市第一中学2018-2019学年高一下学期期中考试化学试题鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第3节 化学反应的速率 课时2 浓度、温度、催化剂对化学反应速率的影响人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 第一节 化学反应速率 课时2 影响化学反应速率的因素选择性必修1(SJ)专题2第一单元课时2 影响化学反应速率的因素吉林省延边第二中学2021-2022学年高二上学期第一次阶段检测化学试题(已下线)第七章 化学反应速率与化学平衡 第40练 化学反应速率2.1.2影响化学反应速率的因素 课后
9 . 某同学进行了硫代硫酸钠与硫酸反应的有关实验,实验过程的数据记录如下(见表格),请结合表中信息,回答有关问题:
(1)根据你所掌握的知识判断,在上述实验中,反应速率最快的实验可能是__________ (填实验序号)。
(2)在比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即需要控制好与实验有关的各项反应条件。其中:
①能说明温度对该反应速率影响的组合是__________ (填实验序号);
②A和B、A和C的组合比较,所研究的问题是___________________________________________ ;
③B和C的组合比较,所研究的问题是___________________________________________ 。
(3)实验中利用了出现黄色沉淀的快慢来比较反应速率的快慢,请你分析为何不采用测量单位时间内产生气体体积的大小进行比较:___________________________________________ 。
| 实验序号 | 反应温度/ | 参加反应的物质 | ||||
 |  |  | ||||
 | 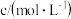 |  | 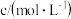 |  | ||
| A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
| C | 20 | 10 | 0.1 | 5 | 0.1 | 5 |
| D | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
(1)根据你所掌握的知识判断,在上述实验中,反应速率最快的实验可能是
(2)在比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即需要控制好与实验有关的各项反应条件。其中:
①能说明温度对该反应速率影响的组合是
②A和B、A和C的组合比较,所研究的问题是
③B和C的组合比较,所研究的问题是
(3)实验中利用了出现黄色沉淀的快慢来比较反应速率的快慢,请你分析为何不采用测量单位时间内产生气体体积的大小进行比较:
您最近半年使用:0次
2018-12-03更新
|
393次组卷
|
5卷引用:安徽省肥东县高级中学2020-2021学年高二上学期期中考试化学试题
安徽省肥东县高级中学2020-2021学年高二上学期期中考试化学试题高二人教版选修4 第二章 第二节 影响化学反应速率的因素山东省济宁第二中学2019-2020高二10月月考化学试题江西省靖安中学2019-2020学年高二上学期第一次月考化学试题(已下线)2.1.2 影响化学反应速率的因素(2)(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)
10 . 二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含CeCO3F)为原料制备CeO2的一种工艺流程如下:
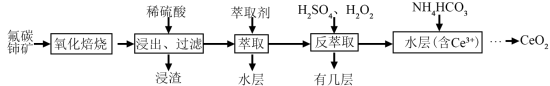
已知:i.Ce4+能与Fˉ结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
ⅱ.在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能
ⅲ.常温下,Ce2(CO3)3饱和溶液浓度为1.0×10-6mol·L-1。
回答下列问题:
(1)“氧化焙烧”过程中可以加快反应速率和提高原料利用率的方法是__________ 、__________ (写出2种即可)。
(2)写出“氧化焙烧”产物CeO2与稀H2SO4反应的离子方程式:__________ 。
(3)“萃取”时存在反应:Ce4++n(HA)2 Ce(H2n-4A2n)+4H+。D表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D=
Ce(H2n-4A2n)+4H+。D表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D= )。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(
)。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c( ),D随起始料液中c(
),D随起始料液中c( )增大而减小的原因是
)增大而减小的原因是_____________ 。
(4)浸渣经处理可得Ce(BF4)3,加入KCl溶液发生如下反应:
Ce(BF4)3(s)+ 3K+(aq) 3KBF4(s)+ Ce3+(aq)。
3KBF4(s)+ Ce3+(aq)。
若一定温度时,Ce(BF4)3、KBF4的Ksp分别为a、b,则该反应的平衡常数K=__________ (用a、b表示)。
(5)“反萃取”中加H2O2的主要反应离子方程式为__________ 。在“反萃取”后所得水层中加入1.0mol·L-1的NH4HCO3溶液,产生Ce2(CO3)3沉淀,当Ce3+沉淀完全时[c(Ce3+)=1×10-5mol·L-1],溶液中c( )约为
)约为__________ 。
(6)CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生着CeO2 CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。写出CeO2消除CO尾气的化学方程式:
CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。写出CeO2消除CO尾气的化学方程式:___________ 。

已知:i.Ce4+能与Fˉ结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
ⅱ.在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能
ⅲ.常温下,Ce2(CO3)3饱和溶液浓度为1.0×10-6mol·L-1。
回答下列问题:
(1)“氧化焙烧”过程中可以加快反应速率和提高原料利用率的方法是
(2)写出“氧化焙烧”产物CeO2与稀H2SO4反应的离子方程式:
(3)“萃取”时存在反应:Ce4++n(HA)2
 Ce(H2n-4A2n)+4H+。D表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D=
Ce(H2n-4A2n)+4H+。D表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D= )。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(
)。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c( ),D随起始料液中c(
),D随起始料液中c( )增大而减小的原因是
)增大而减小的原因是(4)浸渣经处理可得Ce(BF4)3,加入KCl溶液发生如下反应:
Ce(BF4)3(s)+ 3K+(aq)
 3KBF4(s)+ Ce3+(aq)。
3KBF4(s)+ Ce3+(aq)。若一定温度时,Ce(BF4)3、KBF4的Ksp分别为a、b,则该反应的平衡常数K=
(5)“反萃取”中加H2O2的主要反应离子方程式为
 )约为
)约为(6)CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生着CeO2
 CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。写出CeO2消除CO尾气的化学方程式:
CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。写出CeO2消除CO尾气的化学方程式:
您最近半年使用:0次
2018-03-26更新
|
566次组卷
|
2卷引用:安徽省合肥市2018年高三第二次教学质量检测理科综合化学试题



