名校
解题方法
1 . 下列过程中,通常需要增大化学反应速率的是
| A.工业合成氨 | B.钢铁的腐蚀 | C.食物腐败 | D.塑料老化 |
您最近半年使用:0次
名校
解题方法
2 . 肼( )及其衍生物的合成与利用具有重要意义。
)及其衍生物的合成与利用具有重要意义。
(1)“肼合成酶”以其中的 “配合物为催化中心,可将
“配合物为催化中心,可将 与
与 转化为肼,其反应历程如图所示。
转化为肼,其反应历程如图所示。
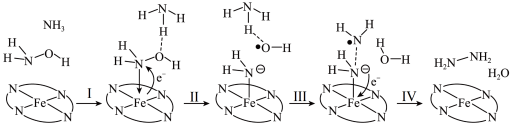
上图所示的反应步骤Ⅱ中Fe元素化合价的变化可描述为___________ 。
②将 替换为
替换为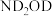 ,反应所得产物的化学式为
,反应所得产物的化学式为___________ 。
(2)在碱性条件下,水合肼( )在催化剂Rh(铑)g-
)在催化剂Rh(铑)g- 作用下发生如下分解反应:
作用下发生如下分解反应:
反应Ⅰ: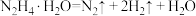
反应Ⅱ: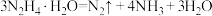
转化频率(TOF)能反映催化剂的性能。
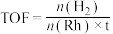 (t为反应时间),保持温度不变,相同时间内反应中不同
(t为反应时间),保持温度不变,相同时间内反应中不同 对应的TOF如图所示。
对应的TOF如图所示。
①催化剂载体g- 可由三聚氰胺(
可由三聚氰胺(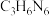 )在空气中焙烧得到。已知
)在空气中焙烧得到。已知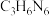 具有六元环结构,其结构简式可表示为
具有六元环结构,其结构简式可表示为___________ 。
②TOF随 变化的原因是
变化的原因是___________ 。
(3)相同条件下,测得 诱导肼、甲肼(
诱导肼、甲肼(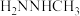 )和偏二甲肼[
)和偏二甲肼[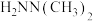 ]低温反应(均为吸热反应)产物与反应物能量差
]低温反应(均为吸热反应)产物与反应物能量差 、反应速率常数k值(k越大,反应越快)如下表。
、反应速率常数k值(k越大,反应越快)如下表。
①请补充上表所缺反应产物的结构简式___________ 。
②相较甲肼而言,肼、偏二甲肼与 的反应效果不佳的原因分别是
的反应效果不佳的原因分别是___________ 。
(4)液态肼也可以作为燃料电池,如图一种肼燃料电池,写成负极的电极反应___________ 。

 )及其衍生物的合成与利用具有重要意义。
)及其衍生物的合成与利用具有重要意义。(1)“肼合成酶”以其中的
 “配合物为催化中心,可将
“配合物为催化中心,可将 与
与 转化为肼,其反应历程如图所示。
转化为肼,其反应历程如图所示。
上图所示的反应步骤Ⅱ中Fe元素化合价的变化可描述为
②将
 替换为
替换为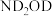 ,反应所得产物的化学式为
,反应所得产物的化学式为(2)在碱性条件下,水合肼(
 )在催化剂Rh(铑)g-
)在催化剂Rh(铑)g- 作用下发生如下分解反应:
作用下发生如下分解反应:反应Ⅰ:
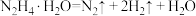
反应Ⅱ:
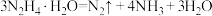
转化频率(TOF)能反映催化剂的性能。
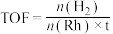 (t为反应时间),保持温度不变,相同时间内反应中不同
(t为反应时间),保持温度不变,相同时间内反应中不同 对应的TOF如图所示。
对应的TOF如图所示。
①催化剂载体g-
 可由三聚氰胺(
可由三聚氰胺(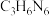 )在空气中焙烧得到。已知
)在空气中焙烧得到。已知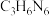 具有六元环结构,其结构简式可表示为
具有六元环结构,其结构简式可表示为②TOF随
 变化的原因是
变化的原因是(3)相同条件下,测得
 诱导肼、甲肼(
诱导肼、甲肼(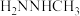 )和偏二甲肼[
)和偏二甲肼[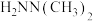 ]低温反应(均为吸热反应)产物与反应物能量差
]低温反应(均为吸热反应)产物与反应物能量差 、反应速率常数k值(k越大,反应越快)如下表。
、反应速率常数k值(k越大,反应越快)如下表。| 燃料 | 反应产物 |  | k值 |
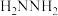 | 5.73 | 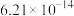 | |
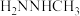 | 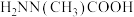 | 14.15 | 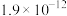 |
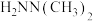 |  | 47.81 | - |
②相较甲肼而言,肼、偏二甲肼与
 的反应效果不佳的原因分别是
的反应效果不佳的原因分别是(4)液态肼也可以作为燃料电池,如图一种肼燃料电池,写成负极的电极反应

您最近半年使用:0次
名校
解题方法
3 . 含氮物质、含硫物质的过量排放会污染大气或水体,研究氮、硫及其化合物的性质及转化,对降低含氮、含硫物质的污染有着重大的意义。
(1)在一定条件下,浓度为5%的尿素[CO(NH2)2]吸收液可以脱除烟气中的NOx。不同吸收反应温度下,测得NOx的脱除率变化如图所示。
已知信息:尿素的分解温度是160℃。尿素水解:CO(NH2)2+H2O=CO2↑+2NH3↑,在低温水解速度慢。
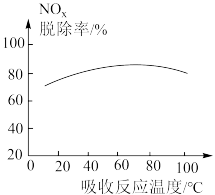
①当温度大于80℃时,NOx的脱除率随温度升高而降低的原因是______ 。
②写出在70~80℃条件下,尿素和烟气中NO2反应的化学方程式为______ 。
(2)ClO2可对烟气中NOx、SO2进行协同脱除,涉及的部分反应如下:
Ⅰ.ClO2+NO=NO2+ClO
Ⅱ.ClO+NO=Cl+NO2
Ⅲ.ClO2+SO2=ClO+SO3
Ⅳ.ClO+SO2=Cl+SO3
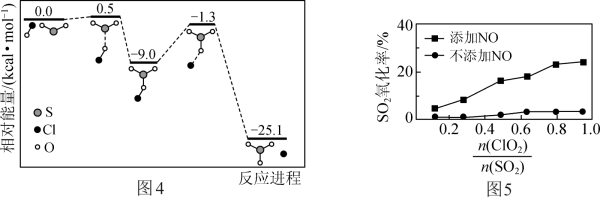
①反应Ⅳ的历程如图4所示。该历程中最大活化能E正=_____ kcal·mol-1。
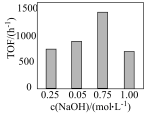
②保持其他条件不变,分别在不添加NO、添加NO两种情况下,控制模拟烟气中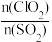 不同并反应相同时间,测得SO2氧化率随
不同并反应相同时间,测得SO2氧化率随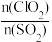 变化如图5所示。不添加NO时,SO2氧化率较低(不超过3%)的原因可能是
变化如图5所示。不添加NO时,SO2氧化率较低(不超过3%)的原因可能是______ 。添加NO时,SO2氧化率比不添加NO时高,其原因可能是______ 。
(1)在一定条件下,浓度为5%的尿素[CO(NH2)2]吸收液可以脱除烟气中的NOx。不同吸收反应温度下,测得NOx的脱除率变化如图所示。
已知信息:尿素的分解温度是160℃。尿素水解:CO(NH2)2+H2O=CO2↑+2NH3↑,在低温水解速度慢。

①当温度大于80℃时,NOx的脱除率随温度升高而降低的原因是
②写出在70~80℃条件下,尿素和烟气中NO2反应的化学方程式为
(2)ClO2可对烟气中NOx、SO2进行协同脱除,涉及的部分反应如下:
Ⅰ.ClO2+NO=NO2+ClO
Ⅱ.ClO+NO=Cl+NO2
Ⅲ.ClO2+SO2=ClO+SO3
Ⅳ.ClO+SO2=Cl+SO3
①反应Ⅳ的历程如图4所示。该历程中最大活化能E正=
②保持其他条件不变,分别在不添加NO、添加NO两种情况下,控制模拟烟气中
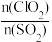 不同并反应相同时间,测得SO2氧化率随
不同并反应相同时间,测得SO2氧化率随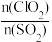 变化如图5所示。不添加NO时,SO2氧化率较低(不超过3%)的原因可能是
变化如图5所示。不添加NO时,SO2氧化率较低(不超过3%)的原因可能是
您最近半年使用:0次
名校
4 . 鱼浮灵是一种化学增氧剂,主要成分为过氧碳酸钠(2Na2CO3·3H2O2),分别在等体积双氧水中加入少量Na2CO3、NaCl和NaOH固体探究鱼浮灵增氧原理,实验结果如图所示。下列说法不正确 的是
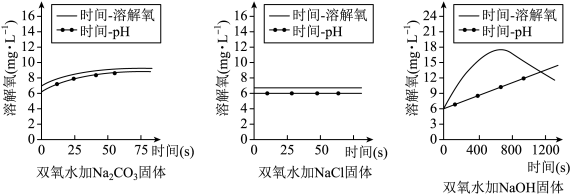

| A.Na2CO3对H2O2的分解有促进作用 | B.加入NaCl后溶液溶解氧变化不明显 |
| C.H2O2分解随pH增大而持续加快 | D.鱼浮灵使用时应根据pH控制投放量 |
您最近半年使用:0次
2022-06-22更新
|
290次组卷
|
5卷引用:江苏省苏州市工业园区三校20232024学年高二上学期10月联考化学试题
名校
解题方法
5 . I.某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”,进行了如下实验:2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O。
请回答:
(1)实验计时方法是从溶液混合开始计时,至___________ 时计时结束。
(2)V1=___________ ,V2=___________ ;
(3)设计实验Ⅰ.Ⅲ的目的是___________ 。
(4)利用实验Ⅲ中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=___________ 。
(5)有同学在实验中发现酸性高锰酸钾溶液和草酸溶液反应时,开始一段时间反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大。某同学认为是放热导致溶液温度升高所致,重做Ⅰ号实验,测定实验过程中不同时刻溶液的温度,结果温度没有明显变化。由此你得出的结论是:可能是是反应产物有___________ 作用。Ⅳ号实验是为验证你的猜测,实验中要加入的少量某种物质是___________ (填化学式)。
II.相同温度条件下,分别用3支试管按下列方式完成A、B、C三组实验:
上述实验能否说明“相同条件下,反应物浓度越大,反应速率越快”___________ (选填“能”或“不能”);简述你的理由:___________
| 编号 | 酸性KMnO4溶液(0.01mol·L-1) | H2C2O4溶液(0.1mol·L-1) | 水 | 某种物质 | 反应温度(℃) | 反应时间(min) |
| Ⅰ | 2mL | 2mL | 0 | 0 | 20 | 2.1 |
| Ⅱ | V1mL | 2mL | 1mL | 0 | 20 | 5.5 |
| Ⅲ | V2mL | 2mL | 0 | 0 | 50 | 0.5 |
| Ⅳ | 2mL | 2mL | 0 | 少量 | 20 | 0.2 |
(1)实验计时方法是从溶液混合开始计时,至
(2)V1=
(3)设计实验Ⅰ.Ⅲ的目的是
(4)利用实验Ⅲ中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=
(5)有同学在实验中发现酸性高锰酸钾溶液和草酸溶液反应时,开始一段时间反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大。某同学认为是放热导致溶液温度升高所致,重做Ⅰ号实验,测定实验过程中不同时刻溶液的温度,结果温度没有明显变化。由此你得出的结论是:可能是是反应产物有
II.相同温度条件下,分别用3支试管按下列方式完成A、B、C三组实验:
| 试管 | A | B | C |
| 加入试剂 | 4mL0.01mol/LKMnO4 1ml0.1moL/LH2SO4 2mL0.1mol/LH2C2O4 | 4mL0.02mol/LKMnO4 1ml0.1moL/LH2SO4 2mL0.1mol/LH2C2O4 | 4mL0.03mol/LKMnO4 1ml0.1moL/LH2SO4 2mL0.1mol/LH2C2O4 |
| 褪色时间 | 28秒 | 30秒 | 不褪色 |
您最近半年使用:0次
名校
解题方法
6 . 下列反应条件的改变对4Fe+3O2+xH2O=2Fe2O3·xH2O速率的影响不正确的是
| A.增大O2的浓度能加快生锈速率 | B.潮湿环境中铁生锈的速率更快 |
| C.升高温度能加快生锈速率 | D.干燥空气中铁生锈速率更快 |
您最近半年使用:0次
2020-11-02更新
|
257次组卷
|
3卷引用:江苏省徐州市沛县2020-2021学年高二上学期第一次学情调研化学(必修)试题
名校
解题方法
7 . 下列过程中,需要增大化学反应速率的是
| A.钢铁腐蚀 | B.食物腐败 | C.塑料老化 | D.工业合成氮 |
您最近半年使用:0次
2020-04-22更新
|
332次组卷
|
19卷引用:江苏省盐城市伍佑中学2020-2021学年高一下学期第一次阶段考试化学试题
江苏省盐城市伍佑中学2020-2021学年高一下学期第一次阶段考试化学试题江苏省镇江实验高级中学2020-2021学年高一下学期第一次月考化学试题(已下线)2010-2011学年江西省鄱阳县油墩街中学高一下学期期中考试化学试卷(已下线)2013-2014浙江省宁波市高一下学期期末考试化学试卷2014-2015学年广东省惠州市高一下学期期末考试化学文科试卷2015-2016学年青海省西宁四中高二上学期期末化学试卷2015-2016学年四川省广安二中高一下学期期中化学试卷2016-2017学年河北省武邑中学高二上入学考试化学试卷2016-2017学年河北省武邑中学高二上8.28周考化学卷2016-2017学年河北省武邑中学高二上9.21周考化学卷2016-2017学年天津市河东区高二上学期期中质检化学试卷湖北省天门市三校2016-2017学年高一下学期期中考试化学试题山西省怀仁县第八中学2016-2017学年高一(普通班)下学期期末考试化学试题福建省三明市第一中学2017-2018学年高二上学期期中考试(理)化学试题【全国百强校】福建省三明市第一中学2018-2019学年高二(理)上学期期中考试化学试题江西省上饶市鄱阳县第二中学2019-2020学年高二上学期期中考试化学试题河南省周口市陈州高级中学2019-2020学年高一下学期摸底考试化学试题山西省新绛县第二中学2019-2020学年高二上学期第一次考试化学试题北京景山学校2021-2022学年高一下学期期中考试化学试题
名校
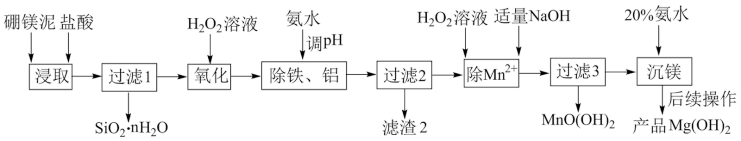
8 . 以硼镁泥(主要成分为MgSiO3、Fe2O3及少量Al2O3、FeO和MnO)为原料制备高纯Mg(OH)2的流程如下:
已知:
①常温下此体系中各氢氧化物开始沉淀与沉淀完全时的pH范围如下表所示:
②温度高于340℃时Mg(OH)2开始分解为MgO和H2O。
(1)“浸取”时,为提高镁的浸取率可行的措施为_______ 。
a.将硼镁泥制成浆料b.降低浸取温度c.用盐酸多次浸取
(2)“浸取”时,MgSiO3与盐酸反应的化学方程式为_______ 。
(3)“除铁、铝”时,需调节溶液pH范围为_______ 。
(4)“除Mn2+”时发生反应的离子方程式为_______ ;
过滤3所得滤渣中含有MnO(OH)2和_______ 。
(5)“沉镁”时,反应温度与Mg(OH)2的产率如图所示,当温度超过60℃,随温度再升高,Mg(OH)2产率反而降低,其原因可能是_______ 。


已知:
①常温下此体系中各氢氧化物开始沉淀与沉淀完全时的pH范围如下表所示:
| pH值 | Mg(OH)2 | Mn(OH)2 | MnO(OH)2 | Fe(OH)2 | Al(OH)3 | Fe(OH)3 |
| 开始沉淀时 | 9.3 | 7.1 | 7.8 | 7.6 | 3.7 | 2.3 |
| 沉淀完全时 | 10.8 | 10.8 | 9.8 | 9.6 | 4.7 | 3.7 |
(1)“浸取”时,为提高镁的浸取率可行的措施为
a.将硼镁泥制成浆料b.降低浸取温度c.用盐酸多次浸取
(2)“浸取”时,MgSiO3与盐酸反应的化学方程式为
(3)“除铁、铝”时,需调节溶液pH范围为
(4)“除Mn2+”时发生反应的离子方程式为
过滤3所得滤渣中含有MnO(OH)2和
(5)“沉镁”时,反应温度与Mg(OH)2的产率如图所示,当温度超过60℃,随温度再升高,Mg(OH)2产率反而降低,其原因可能是

您最近半年使用:0次
2017-03-22更新
|
1281次组卷
|
3卷引用:2017届江苏省苏锡常镇四市高三教学情况调研(一)化学试卷
2017届江苏省苏锡常镇四市高三教学情况调研(一)化学试卷江苏省泰州中学2018届高三10月月考化学试题(已下线)考点11 镁、铝及其重要化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)



