名校
1 . 下列过程中,化学反应速率减小对人类无益的是
| A.金属的腐蚀 | B.食物的腐败 | C.塑料的老化 | D.氨的合成 |
您最近半年使用:0次
2022-10-16更新
|
700次组卷
|
24卷引用:河南省项城三高2017-2018学年高一下学期第二次段考(B卷)化学试题
河南省项城三高2017-2018学年高一下学期第二次段考(B卷)化学试题河南省濮阳市元龙高级中学2021-2022学年高二下学期第一次质量检测化学试题(已下线)2012-2013学年河北省衡水市第十四中学高二下学期期末考试化学试卷(已下线)2018年9月3日 《每日一题》人教必修4-对化学反应速率的理解【校级联考】福建省闽侯二中五校教学联合体2017-2018学年高二上学期期中考试化学试题云南省玉溪市江川区第二中学2018-2019学年高一下学期开学考试化学试题吉林省吉林市第三中学2018-2019学年高一5月阶段测试化学试题吉林省辽源市田家炳高级中学2019-2020学年高二上学期期中考试化学试题北京师范大学珠海分校附属外国语学校2019-2020学年高一下学期期末考试化学试题辽宁省大连市普兰店第三十八中学2020-2021学年高二上学期第二次考试化学试题(人教版2019)必修第二册 第六章 化学反应与能量 第二节 化学反应的速率与限度甘肃省白银市靖远县第四中学2020-2021学年高一下学期期中考试化学(文)试题黑龙江省鹤岗市第一中学2021-2022学年高二上学期开学考试化学试题黑龙江省佳木斯市第一中学2021-2022 学年高二上学期期中考试化学试题人教2019版选择性必修一第二章 第一节 化学反应速率 课后习题北京市丰台区2021-2022学年高二上学期期中练习化学(B)试题北京市中国农业大学附属中学2021-2022学年高二上学期期中学业水平调研化学试题黑龙江省哈尔滨市第三中学2022-2023学年高二上学期第二次验收化学试题北京市顺义区杨镇第一中学2022-2023学年高二上学期期中检测化学试题天津市南开大学附属中学2022-2023学年高二上学期期中阶段检测化学试题黑龙江省虎林市高级中学2022-2023学年高二上学期期中考试化学试题北京市丰台区2022-2023学年高二上学期期末考试化学试题辽宁省辽东南协作校2023-2024学年高二上学期10月月考化学试题四川省自贡市第一中学校2023-2024学年高二上学期12月月考化学试题
名校
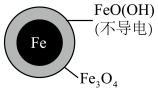
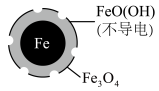
2 . 在pH=4.5时,利用原电池原理,用铁粉将废水中 无害化处理的实验如下表:
无害化处理的实验如下表:
下列说法正确的是
 无害化处理的实验如下表:
无害化处理的实验如下表:| 方案一 | 方案二 | |
| 初始条件 | pH=4.5 | pH=4.5,Fe2+ |
 去除率 去除率 | <50% | 接近100% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 |
|
|
A.该电池中Fe作负极,可被 完全氧化 完全氧化 |
B.正极的电极反应为: |
C.方案二的 去除率高,原因可能是Fe2+破坏了FeO(OH)层 去除率高,原因可能是Fe2+破坏了FeO(OH)层 |
D.改变铁粉粒径大小, 的去除速率不变 的去除速率不变 |
您最近半年使用:0次
2022-07-07更新
|
1461次组卷
|
6卷引用:河南省洛阳市宜阳县第一高级中学2022-2023学年高二上学期第五次能力达标测试化学试题
河南省洛阳市宜阳县第一高级中学2022-2023学年高二上学期第五次能力达标测试化学试题四川省成都市2021-2022学年高二下学期摸底考试化学试题(已下线)第14讲 铁的单质、氧化物和氢氧化物(讲义)-【帮课堂】2022-2023学年高一化学同步精品讲义(人教2019必修第一册 )(已下线)4.1.1 原电池的工作原理-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)四川省成都经济技术开发区实验中学校2022-2023学年高二下学期5月月考化学试题四川省成都市树德中学2022-2023学年高一下学期期末考试化学试题
名校
解题方法
3 . 下列过程中需要加快反应速率的是
| A.钢铁腐蚀 | B.工业炼钢 | C.食物腐烂 | D.塑料老化 |
您最近半年使用:0次
2021-02-08更新
|
121次组卷
|
25卷引用:2014-2015河南省周口中英文学校高一下学期期中考试化学试卷
2014-2015河南省周口中英文学校高一下学期期中考试化学试卷2015-2016学年河南省三门峡市陕州中学高二上学期期中测试化学试卷(已下线)2010年新疆哈巴河县高级中学高二上学期第一次月考化学试题(已下线)2011-2012年广西北海合浦县教育局教研室高二上学期期中考试化学(理)试卷(已下线)2011-2012年山东济南外国语学校高二下学期期中考试文科化学试卷(已下线)2012-2013学年甘肃永昌一中高二上学期期中考试文科化学试卷(已下线)2013届山东省德州市某中学高三12月月考化学试卷(已下线)2012-2013学年浙江省宁海县正学中学高二下学期第一次阶段性测试化学试卷2014-2015学年安徽省淮北师大附属实验中学高一下期中化学试卷2016-2017学年河北省武邑中学高二上入学考试化学试卷2016-2017学年河北省武邑中学高二上8.28周考化学卷2016-2017学年河北省武邑中学高二上9.21周考化学卷甘肃省武威第十八中学2017-2018学年高二上学期第二次月考化学试题安徽省滁州市定远县西片三校2017-2018学年高二上学期期末考试化学试题【全国百强校】福建省厦门第一中学2017-2018学年高二下学期期中考试化学试题黑龙江省伊春市第二中学2017-2018学年高一下学期期末考试(文)化学试题黑龙江省伊春市第二中学2018-2019学年高二(理)上学期期中考试化学试题湖南省邵东县创新实验学校2018-2019学年高一下学期期中考试化学试题2016-2017学年上海市闵行区七宝中学高二(上)开学化学试卷福建省福州福清市2017-2018学年高二上学期期中考试化学(理)试题吉林省辽源市田家炳高级中学校2020-2021学年高二上学期期中考试化学试题黑龙江省八校2020-2021学年高二上学期摸底考试化学试题云南省玉溪第二中学2020-2021学年高二上学期期中质量检测化学试题新疆乌鲁木齐市第二十中学2020-2021学年高二上学期期末考试化学试题陕西省汉滨区五里高级中学2022-2023学年高二上学期期中考试化学试题
解题方法
4 . 某研究性学习小组向一定量的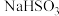 溶液(加入少量淀粉)中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝。为进一步研究有关因素对反应速率的影响,探究如下:
溶液(加入少量淀粉)中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝。为进一步研究有关因素对反应速率的影响,探究如下:
(1)查阅资料知: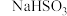 与过量KIO3反应分为两步进行,第一步反应的离子方程式为
与过量KIO3反应分为两步进行,第一步反应的离子方程式为 ,则第二步反应的离子方程式为
,则第二步反应的离子方程式为_______ ;分两步进行的反应,其反应速率主要由慢反应决定,所以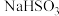 与过量KIO3反应中,慢反应是
与过量KIO3反应中,慢反应是_______ (填“第一步”或“第二步”)反应。
(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响记录如表:
实验①②是探究_______ 对反应速率的影响,表中t1_______ (填“>”、“=”或“<”)t2;实验②③是探究温度对反应速率的影响,表中a=_______ ,b=_______ 。
(3)将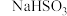 溶液与KIO3溶液在恒温条件下混合用速率检测仪检测出起始阶段反应速率逐渐增大。该小组对其原因提出假设,认为是生成的
溶液与KIO3溶液在恒温条件下混合用速率检测仪检测出起始阶段反应速率逐渐增大。该小组对其原因提出假设,认为是生成的 对反应起催化作用,故设计实验验证,试完成表中的内容。
对反应起催化作用,故设计实验验证,试完成表中的内容。
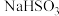 溶液(加入少量淀粉)中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝。为进一步研究有关因素对反应速率的影响,探究如下:
溶液(加入少量淀粉)中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝。为进一步研究有关因素对反应速率的影响,探究如下:(1)查阅资料知:
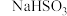 与过量KIO3反应分为两步进行,第一步反应的离子方程式为
与过量KIO3反应分为两步进行,第一步反应的离子方程式为 ,则第二步反应的离子方程式为
,则第二步反应的离子方程式为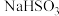 与过量KIO3反应中,慢反应是
与过量KIO3反应中,慢反应是(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响记录如表:
| 编号 | 0.01mol·L-1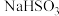 溶液/mL 溶液/mL | 0.01mol·L-1KIO3溶液/mL | H2O/mL | 反应温度/℃ | 液变蓝所用时间t/s |
| ① | 4.0 | 14.0 | 2.0 | 15 | t1 |
| ② | 6.0 | 14.0 | 0 | 15 | t2 |
| ③ | 6.0 | a | b | 25 | t3 |
(3)将
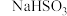 溶液与KIO3溶液在恒温条件下混合用速率检测仪检测出起始阶段反应速率逐渐增大。该小组对其原因提出假设,认为是生成的
溶液与KIO3溶液在恒温条件下混合用速率检测仪检测出起始阶段反应速率逐渐增大。该小组对其原因提出假设,认为是生成的 对反应起催化作用,故设计实验验证,试完成表中的内容。
对反应起催化作用,故设计实验验证,试完成表中的内容。| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
Ⅰ.在烧杯甲中将一定量的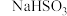 溶液与KIO3溶液混合,用速率检测仪测定起始时的反应速率v(甲) 溶液与KIO3溶液混合,用速率检测仪测定起始时的反应速率v(甲)Ⅱ.在烧杯乙中先加入少量 | 若v(甲) 若以(甲) |
您最近半年使用:0次
5 . 硫代硫酸钠与稀硫酸发生反应: (未配平)。在4只小烧杯中分别加入
(未配平)。在4只小烧杯中分别加入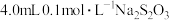 溶液与
溶液与 的稀硫酸。改变下表所示的条件:
的稀硫酸。改变下表所示的条件:
下列说法不正确的是
 (未配平)。在4只小烧杯中分别加入
(未配平)。在4只小烧杯中分别加入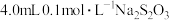 溶液与
溶液与 的稀硫酸。改变下表所示的条件:
的稀硫酸。改变下表所示的条件:| 小烧杯编号 | 小烧杯中新加入的物质 | 温度/℃ |
| i | 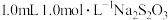 溶液 溶液 | 20 |
| ii | 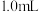 蒸馏水 蒸馏水 | 20 |
| iii | 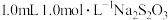 溶液 溶液 | 50 |
| iv | 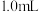 蒸馏水 蒸馏水 | 50 |
| A.i与ii对比可探究浓度对反应速率的影响 |
| B.i与iii对比可探究温度对反应速率的影响 |
C.生成沉淀的速率大小: |
| D.增大浓度、升高温度,反应速率增大 |
您最近半年使用:0次
解题方法
6 . 某小组进行实验:向硫酸酸化的过氧化氢溶液中加入碘化钾、淀粉和硫代硫酸钠的混合溶液,一段时间后溶液变蓝。查阅资料知体系中存在两个主要反应:
反应i:H2O2(aq)+2I-(aq)+2H+(aq)=I2(aq)+2H2O(l)△H1=-247.5kJ·mol-1
反应ii:I2(aq)+2S2O (aq)=2I-(aq)+S4O
(aq)=2I-(aq)+S4O (aq)△H2=-1021.6kJ·mol-1
(aq)△H2=-1021.6kJ·mol-1
(1)H2O2与S2O 反应的热化学方程式为
反应的热化学方程式为___ 。
(2)下列实验方案可证实上述反应过程。
将实验方案补充完整(所用试剂浓度均为0.01mol·L-1)。
①向酸化的H2O2溶液中加入___ 溶液,溶液几秒后变为蓝色。
②向①中蓝色溶液中加入___ 溶液,溶液立即褪色。
(3)探究c(H+)对反应速率的影响,实验方案如表所示。(所用试剂除H2O以外,浓度均为0.01mol·L-1)
①将实验b补充完整,X=___ 、Q=___ 。
②对比实验a和实验b,t1___ (填“>”或“<”)t2。
③结合(2)中现象解释溶液混合后一段时间才变蓝的原因:___ 。
④利用实验a的数据,计算t1时间内H2O2与S2O 反应的平均反应速率(用H2O2浓度的变化表示),
反应的平均反应速率(用H2O2浓度的变化表示),___ mol·L-1·s-1。
反应i:H2O2(aq)+2I-(aq)+2H+(aq)=I2(aq)+2H2O(l)△H1=-247.5kJ·mol-1
反应ii:I2(aq)+2S2O
 (aq)=2I-(aq)+S4O
(aq)=2I-(aq)+S4O (aq)△H2=-1021.6kJ·mol-1
(aq)△H2=-1021.6kJ·mol-1(1)H2O2与S2O
 反应的热化学方程式为
反应的热化学方程式为(2)下列实验方案可证实上述反应过程。
将实验方案补充完整(所用试剂浓度均为0.01mol·L-1)。
①向酸化的H2O2溶液中加入
②向①中蓝色溶液中加入
(3)探究c(H+)对反应速率的影响,实验方案如表所示。(所用试剂除H2O以外,浓度均为0.01mol·L-1)
实验序号 | a | b | |
试剂 | H2O2/mL | 4.5 | X |
| H2SO4/mL | 4.5 | 2 | |
| Na2S2O3/mL | 8 | Y | |
| KI(含淀粉)/mL | 3 | Z | |
| H2O/mL | 0 | Q | |
| 将上述溶液迅速混合现象 | 溶液变蓝所需时间为t1秒 | 溶液变蓝所需时间为t2秒 | |
②对比实验a和实验b,t1
③结合(2)中现象解释溶液混合后一段时间才变蓝的原因:
④利用实验a的数据,计算t1时间内H2O2与S2O
 反应的平均反应速率(用H2O2浓度的变化表示),
反应的平均反应速率(用H2O2浓度的变化表示),
您最近半年使用:0次
2020-11-06更新
|
109次组卷
|
3卷引用:河南省豫南九校2020-2021学年高二上学期第二次联考化学试题
7 . 下列说法正确的是
| A.胃舒平的主要成分有Al(OH)3,服药期间不宜同时饮用可乐 |
| B.室温中的抗氧化剂加快了食物的氧化变质 |
| C.纯碱属于碱,水溶液显碱性,可以用于除去餐具上的油污 |
| D.高纯硅制成的太阳能电池属于化学电源 |
您最近半年使用:0次
8 . 利用下列实验所选择的装置或仪器(夹持装置已略去)不能达到实验目的的是
A.利用图中装置制备并收集乙酸乙酯 |
B.利用图中装置探究SO2的氧化性和漂白性 |
C.利用图中装置从苯和溴苯的混合溶液中分离出溴苯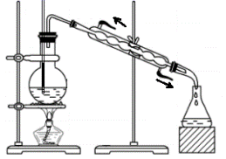 |
D.利用图中装置探究温度对反应速率的影响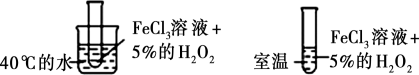 |
您最近半年使用:0次
名校
解题方法
9 . 下列过程中,需要增大化学反应速率的是
| A.钢铁腐蚀 | B.食物腐败 | C.塑料老化 | D.工业合成氮 |
您最近半年使用:0次
2020-04-22更新
|
332次组卷
|
19卷引用:河南省周口市陈州高级中学2019-2020学年高一下学期摸底考试化学试题
河南省周口市陈州高级中学2019-2020学年高一下学期摸底考试化学试题(已下线)2010-2011学年江西省鄱阳县油墩街中学高一下学期期中考试化学试卷(已下线)2013-2014浙江省宁波市高一下学期期末考试化学试卷2014-2015学年广东省惠州市高一下学期期末考试化学文科试卷2015-2016学年青海省西宁四中高二上学期期末化学试卷2015-2016学年四川省广安二中高一下学期期中化学试卷2016-2017学年河北省武邑中学高二上入学考试化学试卷2016-2017学年河北省武邑中学高二上8.28周考化学卷2016-2017学年河北省武邑中学高二上9.21周考化学卷2016-2017学年天津市河东区高二上学期期中质检化学试卷湖北省天门市三校2016-2017学年高一下学期期中考试化学试题山西省怀仁县第八中学2016-2017学年高一(普通班)下学期期末考试化学试题福建省三明市第一中学2017-2018学年高二上学期期中考试(理)化学试题【全国百强校】福建省三明市第一中学2018-2019学年高二(理)上学期期中考试化学试题江西省上饶市鄱阳县第二中学2019-2020学年高二上学期期中考试化学试题山西省新绛县第二中学2019-2020学年高二上学期第一次考试化学试题江苏省盐城市伍佑中学2020-2021学年高一下学期第一次阶段考试化学试题江苏省镇江实验高级中学2020-2021学年高一下学期第一次月考化学试题北京景山学校2021-2022学年高一下学期期中考试化学试题
名校
10 . (某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)
(1)通过实验A、B,可探究出浓度的改变对反应速率的影响,其中V1=____ ,T1=___ ;通过实验___ 可探究出温度变化对化学反应速率的影响。
(2)C组实验中溶液褪色时间t1____ (填“>”或“<”)8s,C组实验的反应速率v(KMnO4) = ______ 。(用含有t1的式子表示)
(3)写出相应反应的离子方程式_____ 。
| 实验序号 | 实验温度/K | 参加反应的物质 | 溶液颜色褪至无色时所需时间/s | ||||
| KMnO4溶液(含硫酸) | H2C2O4溶液 | H2O | |||||
| V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | |||
| A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | 6 |
| B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
| C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t1 |
(1)通过实验A、B,可探究出浓度的改变对反应速率的影响,其中V1=
(2)C组实验中溶液褪色时间t1
(3)写出相应反应的离子方程式
您最近半年使用:0次
2019-10-11更新
|
128次组卷
|
2卷引用:河南省中原名校2021-2022学年高二上学期第一次联考化学试题