名校
解题方法
1 . 我国某科研团队研究了氧化铈( )表面空间受阻路易斯酸碱对(FLPs)和氮(N)掺杂的协同作用,促进了光吸收、
)表面空间受阻路易斯酸碱对(FLPs)和氮(N)掺杂的协同作用,促进了光吸收、 成键活化,提高了光催化还原
成键活化,提高了光催化还原 制
制 的产率和选择性。反应历程如图所示。已知:*代表吸附在催化剂表面的物种,+代表起始或终态物质;自由能与相对能量相当。下列叙述错误的是
的产率和选择性。反应历程如图所示。已知:*代表吸附在催化剂表面的物种,+代表起始或终态物质;自由能与相对能量相当。下列叙述错误的是
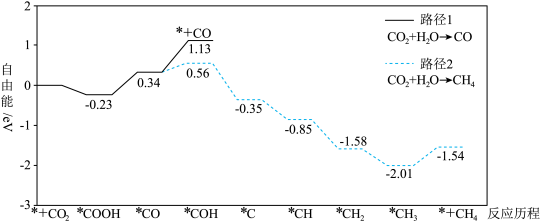
 )表面空间受阻路易斯酸碱对(FLPs)和氮(N)掺杂的协同作用,促进了光吸收、
)表面空间受阻路易斯酸碱对(FLPs)和氮(N)掺杂的协同作用,促进了光吸收、 成键活化,提高了光催化还原
成键活化,提高了光催化还原 制
制 的产率和选择性。反应历程如图所示。已知:*代表吸附在催化剂表面的物种,+代表起始或终态物质;自由能与相对能量相当。下列叙述错误的是
的产率和选择性。反应历程如图所示。已知:*代表吸附在催化剂表面的物种,+代表起始或终态物质;自由能与相对能量相当。下列叙述错误的是
| A.*COH→*C是路径2的决速步 | B.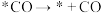 过程中自由能升高 过程中自由能升高 |
C.CO为光催化还原 制 制 的副产物 的副产物 | D.同等条件下,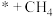 比 比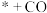 稳定 稳定 |
您最近半年使用:0次
2024-02-05更新
|
104次组卷
|
3卷引用:湖南省张家界市2023-2024学年高三上学期期末联考化学试题
2023高三·全国·专题练习
解题方法
2 . 已知2SO2(g)+O2(g) 2SO3(g) ΔH<0的实验数据如下表:
2SO3(g) ΔH<0的实验数据如下表:
(1)应选择的温度是___________ ,理由是___________ 。
(2)应采用的压强是___________ ,理由是___________ 。
(3)生产中通入过量空气的目的是___________ 。
 2SO3(g) ΔH<0的实验数据如下表:
2SO3(g) ΔH<0的实验数据如下表:| 温度 | 不同压强下SO2的转化率(%) | ||||
| 1×105 Pa | 5×105 Pa | 1×106 Pa | 5×106 Pa | 1×107 Pa | |
| 450 ℃ | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550 ℃ | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
(2)应采用的压强是
(3)生产中通入过量空气的目的是
您最近半年使用:0次
3 . 在下列过程中,需要加快化学反应速率的是
| A.钢铁腐蚀 | B.工业合成氨 | C.牛奶变质 | D.塑料用品老化 |
您最近半年使用:0次
2023高三·全国·专题练习
4 . 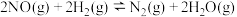 的反应速率表达式为
的反应速率表达式为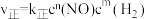 (
( 为正反应速率常数,只与温度有关。
为正反应速率常数,只与温度有关。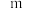 和
和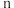 为反应级数,取最简正整数)。
为反应级数,取最简正整数)。
为了探究一定温度下 NO、 的浓度对反应速率的影响,测得实验数据如下:
的浓度对反应速率的影响,测得实验数据如下:
(1)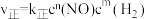 中,m=
中,m=_______ ,n=_______ 。
(2)经研究,有人提出上述反应分两步进行: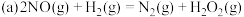 ;
; 。
。
化学总反应由较慢的一步反应决定。
上述反应中,(a)反应较慢,(a)正反应活化能_______ (填“大于”“小于”或“等于”)(b)正反应活化能。
(3)1889年,瑞典化学家阿伦尼乌斯根据实验结果,提出了温度与反应速率常数关系的经验公式: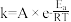 [
[ 为反应速率常数,
为反应速率常数, 为比例常数,
为比例常数,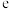 为自然对数的底数,
为自然对数的底数,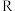 为气体摩尔常数,
为气体摩尔常数, 为开尔文温度,
为开尔文温度, 为活化能
为活化能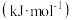 ]。
]。
①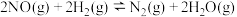 反应达到平衡后,升高温度,正反应速率常数增大的倍数
反应达到平衡后,升高温度,正反应速率常数增大的倍数_______ (填“大于”“小于”或“等于”)逆反应速率常数增大的倍数。
②由此判断下列说法中正确的是_______ (填序号,K正、K逆为正、逆速率常数)。
A.其他条件不变,升高温度,K正增大,K逆变小
B.其他条件不变,使用催化剂,K正、K逆同倍数增大
C.其他条件不变,增大反应物浓度K正增大,K逆不变
D.其他条件不变,减小压强,K正、K逆都变小
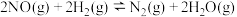 的反应速率表达式为
的反应速率表达式为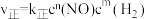 (
( 为正反应速率常数,只与温度有关。
为正反应速率常数,只与温度有关。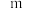 和
和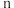 为反应级数,取最简正整数)。
为反应级数,取最简正整数)。为了探究一定温度下 NO、
 的浓度对反应速率的影响,测得实验数据如下:
的浓度对反应速率的影响,测得实验数据如下:| 序号 | 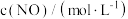 |  | 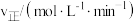 |
| I | 0.10 | 0.10 | 0.414 |
| II | 0.10 | 0.20 | 0.828 |
| III | 0.30 | 0.10 | 3.726 |
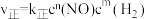 中,m=
中,m=(2)经研究,有人提出上述反应分两步进行:
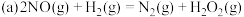 ;
; 。
。化学总反应由较慢的一步反应决定。
上述反应中,(a)反应较慢,(a)正反应活化能
(3)1889年,瑞典化学家阿伦尼乌斯根据实验结果,提出了温度与反应速率常数关系的经验公式:
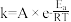 [
[ 为反应速率常数,
为反应速率常数, 为比例常数,
为比例常数,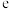 为自然对数的底数,
为自然对数的底数,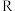 为气体摩尔常数,
为气体摩尔常数, 为开尔文温度,
为开尔文温度, 为活化能
为活化能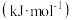 ]。
]。①
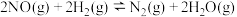 反应达到平衡后,升高温度,正反应速率常数增大的倍数
反应达到平衡后,升高温度,正反应速率常数增大的倍数②由此判断下列说法中正确的是
A.其他条件不变,升高温度,K正增大,K逆变小
B.其他条件不变,使用催化剂,K正、K逆同倍数增大
C.其他条件不变,增大反应物浓度K正增大,K逆不变
D.其他条件不变,减小压强,K正、K逆都变小
您最近半年使用:0次
5 . 某储氢合金(M)的储氢机理简述如下:合金吸附H2→氢气解离成氢原子→形成含氢固溶体MHx( 相)→形成氢化物MHy(
相)→形成氢化物MHy( 相)。已知:
相)。已知: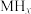 (
( 相)与MHy(
相)与MHy( 相)之间可建立平衡:
相)之间可建立平衡:

请回答下列问题:
(1)上述平衡中化学计量数k=________ (用含x、y的代数式表示)。
(2)t℃时,向体积恒定的密闭容器中加入一定量的储氢合金(M),随充入H2量的改变,固相中氢原子与金属原子个数比(H/M)与容器中H2的平衡压强p的变化关系如图所示。
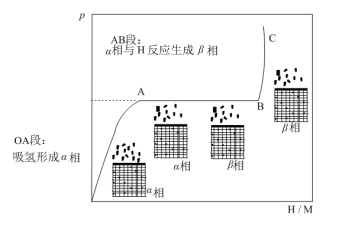
①在________ 温________ 压强下有利于该储氢合金(M)储存H2(填“低”或“高”)。
②若6g该储氢合金(M)在10 s内吸收的H2体积为24 mL,吸氢平均速率v=________ mL/(g∙s)。
③关于该储氢过程的说法错误的是________ 。
a.OA段:其他条件不变时,适当升温能提升形成 相的速率
相的速率
b.AB段:由于H2的平衡压强p未改变,故AB段过程中无H2充入
c.BC段:提升H2压力能大幅提高 相中氢原子物质的量
相中氢原子物质的量
(3)实验表明,H2中常含有O2、CO2、 、H2O等杂质,必须经过净化处理才能被合金储存,原因是
、H2O等杂质,必须经过净化处理才能被合金储存,原因是___________ 。
(4)有资料显示,储氢合金表面氢化物的形成会阻碍储氢合金吸附新的氢气分子,若把储氢合金制成纳米颗粒,单位时间内储氢效率会大幅度提高,可能的原因是________________ 。
(5)某镁系储氢合金的晶体结构如图所示:
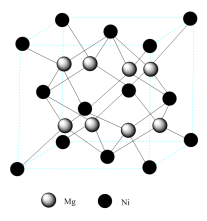
该储氢合金的化学式为________ 。若储氢后每个Mg原子都能结合2个氢原子,则该储氢合金的储氢容量为________ mL/g(储氢容量用每克合金结合标准状况下的氢气体积来表示,结果保留到整数)。
 相)→形成氢化物MHy(
相)→形成氢化物MHy( 相)。已知:
相)。已知: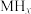 (
( 相)与MHy(
相)与MHy( 相)之间可建立平衡:
相)之间可建立平衡:
请回答下列问题:
(1)上述平衡中化学计量数k=
(2)t℃时,向体积恒定的密闭容器中加入一定量的储氢合金(M),随充入H2量的改变,固相中氢原子与金属原子个数比(H/M)与容器中H2的平衡压强p的变化关系如图所示。

①在
②若6g该储氢合金(M)在10 s内吸收的H2体积为24 mL,吸氢平均速率v=
③关于该储氢过程的说法错误的是
a.OA段:其他条件不变时,适当升温能提升形成
 相的速率
相的速率b.AB段:由于H2的平衡压强p未改变,故AB段过程中无H2充入
c.BC段:提升H2压力能大幅提高
 相中氢原子物质的量
相中氢原子物质的量(3)实验表明,H2中常含有O2、CO2、
 、H2O等杂质,必须经过净化处理才能被合金储存,原因是
、H2O等杂质,必须经过净化处理才能被合金储存,原因是(4)有资料显示,储氢合金表面氢化物的形成会阻碍储氢合金吸附新的氢气分子,若把储氢合金制成纳米颗粒,单位时间内储氢效率会大幅度提高,可能的原因是
(5)某镁系储氢合金的晶体结构如图所示:

该储氢合金的化学式为
您最近半年使用:0次
真题
名校
6 . 某兴趣小组设计实验探究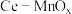 ,催化空气氧化
,催化空气氧化 的效率。回答下列问题:
的效率。回答下列问题:
步骤Ⅰ 制备
在通风橱中用下图装置制备 (加热及夹持装置省略),反应方程式:
(加热及夹持装置省略),反应方程式: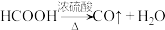

(1)装置A中盛放甲酸的仪器的名称是_______ 。
(2)从B、C、D中选择合适的装置收集 ,正确的接口连接顺序为a→_______→_______→_______→_______→h(每空填一个接口标号)。
,正确的接口连接顺序为a→_______→_______→_______→_______→h(每空填一个接口标号)。______
步骤Ⅱ 检验
将 通入新制银氨溶液中,有黑色沉淀生成。
通入新制银氨溶液中,有黑色沉淀生成。
(3)该反应的化学方程式为_______ 。
步骤Ⅲ 探究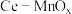 催化空气氧化
催化空气氧化 的效率
的效率
将一定量 与空气混合,得到
与空气混合,得到 体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至
体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至 ,按一定流速通入气体样品。(已知:
,按一定流速通入气体样品。(已知: 是白色固体,易吸水潮解:
是白色固体,易吸水潮解: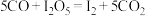 )
)
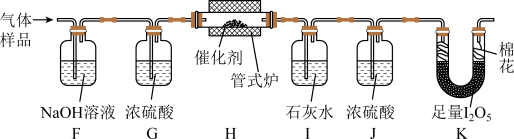
(4)通入 (已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了
(已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了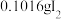 。
。
①能证明 被空气氧化的现象是
被空气氧化的现象是_______ ;
② 被催化氧化的百分率为
被催化氧化的百分率为_______ ;
③若未通入氮气,②的结果将_______ (填“偏大”“偏小”或“无影响”)。
(5)探究气体与催化剂接触时长对催化氧化效率的影响时,采用_______ 方法可以缩短接触时长。
(6)步骤Ⅲ装置存在的不足之处是_______ 。
 ,催化空气氧化
,催化空气氧化 的效率。回答下列问题:
的效率。回答下列问题:步骤Ⅰ 制备

在通风橱中用下图装置制备
 (加热及夹持装置省略),反应方程式:
(加热及夹持装置省略),反应方程式: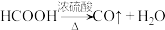

(1)装置A中盛放甲酸的仪器的名称是
(2)从B、C、D中选择合适的装置收集
 ,正确的接口连接顺序为a→_______→_______→_______→_______→h(每空填一个接口标号)。
,正确的接口连接顺序为a→_______→_______→_______→_______→h(每空填一个接口标号)。步骤Ⅱ 检验

将
 通入新制银氨溶液中,有黑色沉淀生成。
通入新制银氨溶液中,有黑色沉淀生成。(3)该反应的化学方程式为
步骤Ⅲ 探究
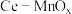 催化空气氧化
催化空气氧化 的效率
的效率将一定量
 与空气混合,得到
与空气混合,得到 体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至
体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至 ,按一定流速通入气体样品。(已知:
,按一定流速通入气体样品。(已知: 是白色固体,易吸水潮解:
是白色固体,易吸水潮解: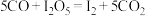 )
)
(4)通入
 (已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了
(已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了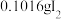 。
。①能证明
 被空气氧化的现象是
被空气氧化的现象是②
 被催化氧化的百分率为
被催化氧化的百分率为③若未通入氮气,②的结果将
(5)探究气体与催化剂接触时长对催化氧化效率的影响时,采用
(6)步骤Ⅲ装置存在的不足之处是
您最近半年使用:0次
2023-02-20更新
|
6403次组卷
|
15卷引用:2022年福建省高考真题化学试题
2022年福建省高考真题化学试题(已下线)专题16 化学实验综合题-2022年高考真题模拟题分项汇编(已下线)2022年福建省高考真题变式题(实验探究题)(已下线)安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试变式题(实验探究题)(已下线)安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试举一反三(实验探究题)(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题突破卷13 化学实验基础(二)-2024年高考化学一轮复习考点通关卷(新教材新高考)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)山东省新泰市第一中学(弘文部)2023-2024学年高三上学期第二次月考化学试题福建省莆田第一中学2023-2024学年高一上学期期末考试化学试题宁夏回族自治区石嘴山市第三中学2023-2024学年高三上学期期末考试理综试题-高中化学天津市耀华中学2023-2024学年高三下学期开学验收考化学试卷
名校
解题方法
7 . 利用下列实验装置进行的实验或操作不能达到相应目的是
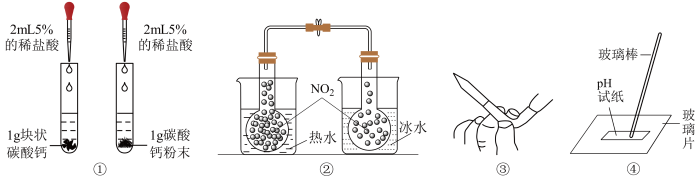

| A.①探究反应物的接触面积对反应速率的影响 |
| B.②探究温度对平衡的影响 |
| C.③除去碱式滴定管中的气泡 |
| D.④测漂白精溶液的pH |
您最近半年使用:0次
2023-02-02更新
|
195次组卷
|
2卷引用:四川省成都石室中学2022—2023学年高二上学期期中考试化学试题
解题方法
8 . Mn2O3是一种重要的化工产品。以菱锰矿(主要成分为MnCO3,还含有少量Fe3O4、FeO、CoO、Al2O3)为原料制备Mn2O3的工艺流程如下图所示。
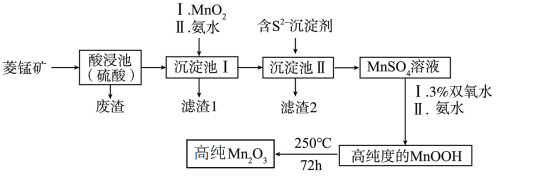
已知:25℃时,相关物质的Ksp见下表。氢氧化氧锰(MnOOH)难溶于水和碱性溶液。
回答下列问题:
(1)为了提高酸浸速率,可采取的措施为_______ (任写2条即可)。
(2)向“沉淀池I”中加入MnO2的作用是_______ ;在“沉淀池I”中,滴加氨水调节溶液的pH,使溶液中铝、铁元素完全沉淀,则理论上pH的最小值为_______ (当溶液中某离子浓度小于1.0×10-5mol·L-1时,可认为该离子沉淀完全)。
(3)“滤渣2”的主要成分是_______ (填化学式)。
(4)请写出MnSO4转化为MnOOH的离子方程式_______ 。
(5)经过滤、洗涤、干燥等步骤可得高纯MnOOH。其中洗涤的具体操作为_______ 。
(6)甲苯(用C7H8表示)是一种挥发性的大气污染物。Mn2O3可用作甲苯热催化氧化消除技术的催化剂。其装置及反应机理如图所示,下列说法中错误的是_______。


已知:25℃时,相关物质的Ksp见下表。氢氧化氧锰(MnOOH)难溶于水和碱性溶液。
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 | Co(OH)2 |
| Ksp | 1×10-16.3 | 1×10-38.6 | 1×10-32.3 | 1×10-12.7 | 1.09×10-15 |
(1)为了提高酸浸速率,可采取的措施为
(2)向“沉淀池I”中加入MnO2的作用是
(3)“滤渣2”的主要成分是
(4)请写出MnSO4转化为MnOOH的离子方程式
(5)经过滤、洗涤、干燥等步骤可得高纯MnOOH。其中洗涤的具体操作为
(6)甲苯(用C7H8表示)是一种挥发性的大气污染物。Mn2O3可用作甲苯热催化氧化消除技术的催化剂。其装置及反应机理如图所示,下列说法中错误的是_______。

| A.反应Ⅱ的方程式为C7H8+36MnO2=7CO2+4H2O+18Mn2O3 |
| B.反应Ⅰ中Mn元素的化合价升高 |
| C.反应Ⅱ中O-H键的形成会吸收能量 |
| D.Mn2O3作催化剂可降低总反应C7H8(g)+9O2(g)=7CO2(g)+4H2O(g)的焓变 |
您最近半年使用:0次
2023-01-12更新
|
163次组卷
|
2卷引用:湖北省部分重点中学2023届高三上学期第二次联考化学试题
9 . 废弃物回收再利用是环境保护的重要课题。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)、锌灰(主要成分为Zn、ZnO,杂质为Fe及其氧化物)回收Cu并制备ZnO,其部分实验过程如下图所示:
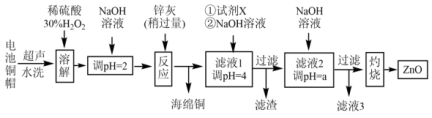
(1)铜帽溶解前需剪碎,其目的是_______ ,写出“溶解”过程中主要化学方程式_______ ,此过程不能加热的原因是_______ 。
(2)“反应”步骤为确定锌灰用量,以碘量法测定溶液中Cu2+含量:向含Cu2+待测液中加入过量KI溶液,再用Na2S2O3标准溶液滴定生成的 至终点,滴定原理如下:2Cu2++4I-=2CuI(白色)↓+I2;
至终点,滴定原理如下:2Cu2++4I-=2CuI(白色)↓+I2; 。
。
①滴定选用的指示剂为_______ ,滴定终点的现象是_______ 。
②若待测液中H2O2没有除尽,所测Cu2+含量将_______ (填“偏高”、“偏低”或“不变”)。
(3)已知:①滤液1中主要含有的金属离子有Zn2+、Fe2+;
②pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-;
③几种金属离子生成氧氧化物沉淀pH见下表。
利用滤液1制取ZnO,试剂X为_______ (填序号A.30% H2O2;B.1.0 mol/LHNO3),a的范围是_______ 。

(1)铜帽溶解前需剪碎,其目的是
(2)“反应”步骤为确定锌灰用量,以碘量法测定溶液中Cu2+含量:向含Cu2+待测液中加入过量KI溶液,再用Na2S2O3标准溶液滴定生成的
 至终点,滴定原理如下:2Cu2++4I-=2CuI(白色)↓+I2;
至终点,滴定原理如下:2Cu2++4I-=2CuI(白色)↓+I2; 。
。①滴定选用的指示剂为
②若待测液中H2O2没有除尽,所测Cu2+含量将
(3)已知:①滤液1中主要含有的金属离子有Zn2+、Fe2+;
②pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-;
③几种金属离子生成氧氧化物沉淀pH见下表。
| 开始沉淀pH | 沉淀完全pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
您最近半年使用:0次
10 . 铍是原子能、火箭、导弹、航空以及冶金工业中不可缺少的宝贵材料。以绿柱石[Be3Al2(SiO3)6]为原料制备两性金属铍的工艺如图:

回答下列问题:
(1)绿柱石写成氧化物的形式为___________ 。
(2)750℃烧结时,Na3FeF6仅与绿柱石中BeO作用生成易溶于水的Na2BeF4,滤渣的主要成分是Fe2O3和___________ 。
(3)“水浸”时“产物压碎磨细”的目的是___________ ,为检验“过滤1”的滤液中是否含有Na+,可选用的方法是___________ (填方法名称)。
(4)“沉氟”的化学方程式为___________ 。
(5)镍坩埚作阴极、石墨作阳极,350~400℃电解NaCl-BeCl2熔融混合物得到金属铍,阳极反应式为___________ ;不能用该电解槽电解熔融氯化铍制金属铍的原因可能是___________ 。

回答下列问题:
(1)绿柱石写成氧化物的形式为
(2)750℃烧结时,Na3FeF6仅与绿柱石中BeO作用生成易溶于水的Na2BeF4,滤渣的主要成分是Fe2O3和
(3)“水浸”时“产物压碎磨细”的目的是
(4)“沉氟”的化学方程式为
(5)镍坩埚作阴极、石墨作阳极,350~400℃电解NaCl-BeCl2熔融混合物得到金属铍,阳极反应式为
您最近半年使用:0次



