1 . 在下列过程中,需要加快化学反应速率的是
| A.钢铁腐蚀 | B.工业合成氨 | C.牛奶变质 | D.塑料用品老化 |
您最近一年使用:0次
2 . 某储氢合金(M)的储氢机理简述如下:合金吸附H2→氢气解离成氢原子→形成含氢固溶体MHx( 相)→形成氢化物MHy(
相)→形成氢化物MHy( 相)。已知:
相)。已知: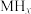 (
( 相)与MHy(
相)与MHy( 相)之间可建立平衡:
相)之间可建立平衡:

请回答下列问题:
(1)上述平衡中化学计量数k=________ (用含x、y的代数式表示)。
(2)t℃时,向体积恒定的密闭容器中加入一定量的储氢合金(M),随充入H2量的改变,固相中氢原子与金属原子个数比(H/M)与容器中H2的平衡压强p的变化关系如图所示。
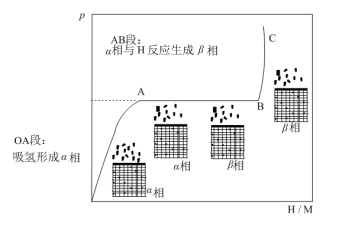
①在________ 温________ 压强下有利于该储氢合金(M)储存H2(填“低”或“高”)。
②若6g该储氢合金(M)在10 s内吸收的H2体积为24 mL,吸氢平均速率v=________ mL/(g∙s)。
③关于该储氢过程的说法错误的是________ 。
a.OA段:其他条件不变时,适当升温能提升形成 相的速率
相的速率
b.AB段:由于H2的平衡压强p未改变,故AB段过程中无H2充入
c.BC段:提升H2压力能大幅提高 相中氢原子物质的量
相中氢原子物质的量
(3)实验表明,H2中常含有O2、CO2、 、H2O等杂质,必须经过净化处理才能被合金储存,原因是
、H2O等杂质,必须经过净化处理才能被合金储存,原因是___________ 。
(4)有资料显示,储氢合金表面氢化物的形成会阻碍储氢合金吸附新的氢气分子,若把储氢合金制成纳米颗粒,单位时间内储氢效率会大幅度提高,可能的原因是________________ 。
(5)某镁系储氢合金的晶体结构如图所示:
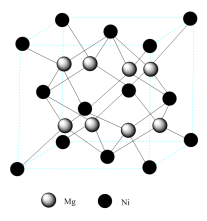
该储氢合金的化学式为________ 。若储氢后每个Mg原子都能结合2个氢原子,则该储氢合金的储氢容量为________ mL/g(储氢容量用每克合金结合标准状况下的氢气体积来表示,结果保留到整数)。
 相)→形成氢化物MHy(
相)→形成氢化物MHy( 相)。已知:
相)。已知: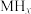 (
( 相)与MHy(
相)与MHy( 相)之间可建立平衡:
相)之间可建立平衡:
请回答下列问题:
(1)上述平衡中化学计量数k=
(2)t℃时,向体积恒定的密闭容器中加入一定量的储氢合金(M),随充入H2量的改变,固相中氢原子与金属原子个数比(H/M)与容器中H2的平衡压强p的变化关系如图所示。

①在
②若6g该储氢合金(M)在10 s内吸收的H2体积为24 mL,吸氢平均速率v=
③关于该储氢过程的说法错误的是
a.OA段:其他条件不变时,适当升温能提升形成
 相的速率
相的速率b.AB段:由于H2的平衡压强p未改变,故AB段过程中无H2充入
c.BC段:提升H2压力能大幅提高
 相中氢原子物质的量
相中氢原子物质的量(3)实验表明,H2中常含有O2、CO2、
 、H2O等杂质,必须经过净化处理才能被合金储存,原因是
、H2O等杂质,必须经过净化处理才能被合金储存,原因是(4)有资料显示,储氢合金表面氢化物的形成会阻碍储氢合金吸附新的氢气分子,若把储氢合金制成纳米颗粒,单位时间内储氢效率会大幅度提高,可能的原因是
(5)某镁系储氢合金的晶体结构如图所示:

该储氢合金的化学式为
您最近一年使用:0次
真题
名校
3 . 某兴趣小组设计实验探究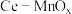 ,催化空气氧化
,催化空气氧化 的效率。回答下列问题:
的效率。回答下列问题:
步骤Ⅰ 制备
在通风橱中用下图装置制备 (加热及夹持装置省略),反应方程式:
(加热及夹持装置省略),反应方程式: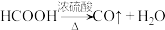

(1)装置A中盛放甲酸的仪器的名称是_______ 。
(2)从B、C、D中选择合适的装置收集 ,正确的接口连接顺序为a→_______→_______→_______→_______→h(每空填一个接口标号)。
,正确的接口连接顺序为a→_______→_______→_______→_______→h(每空填一个接口标号)。______
步骤Ⅱ 检验
将 通入新制银氨溶液中,有黑色沉淀生成。
通入新制银氨溶液中,有黑色沉淀生成。
(3)该反应的化学方程式为_______ 。
步骤Ⅲ 探究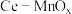 催化空气氧化
催化空气氧化 的效率
的效率
将一定量 与空气混合,得到
与空气混合,得到 体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至
体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至 ,按一定流速通入气体样品。(已知:
,按一定流速通入气体样品。(已知: 是白色固体,易吸水潮解:
是白色固体,易吸水潮解: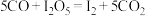 )
)
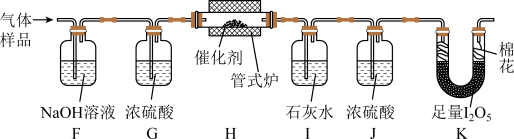
(4)通入 (已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了
(已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了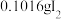 。
。
①能证明 被空气氧化的现象是
被空气氧化的现象是_______ ;
② 被催化氧化的百分率为
被催化氧化的百分率为_______ ;
③若未通入氮气,②的结果将_______ (填“偏大”“偏小”或“无影响”)。
(5)探究气体与催化剂接触时长对催化氧化效率的影响时,采用_______ 方法可以缩短接触时长。
(6)步骤Ⅲ装置存在的不足之处是_______ 。
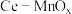 ,催化空气氧化
,催化空气氧化 的效率。回答下列问题:
的效率。回答下列问题:步骤Ⅰ 制备

在通风橱中用下图装置制备
 (加热及夹持装置省略),反应方程式:
(加热及夹持装置省略),反应方程式: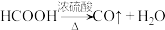

(1)装置A中盛放甲酸的仪器的名称是
(2)从B、C、D中选择合适的装置收集
 ,正确的接口连接顺序为a→_______→_______→_______→_______→h(每空填一个接口标号)。
,正确的接口连接顺序为a→_______→_______→_______→_______→h(每空填一个接口标号)。步骤Ⅱ 检验

将
 通入新制银氨溶液中,有黑色沉淀生成。
通入新制银氨溶液中,有黑色沉淀生成。(3)该反应的化学方程式为
步骤Ⅲ 探究
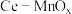 催化空气氧化
催化空气氧化 的效率
的效率将一定量
 与空气混合,得到
与空气混合,得到 体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至
体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至 ,按一定流速通入气体样品。(已知:
,按一定流速通入气体样品。(已知: 是白色固体,易吸水潮解:
是白色固体,易吸水潮解: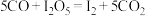 )
)
(4)通入
 (已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了
(已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了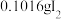 。
。①能证明
 被空气氧化的现象是
被空气氧化的现象是②
 被催化氧化的百分率为
被催化氧化的百分率为③若未通入氮气,②的结果将
(5)探究气体与催化剂接触时长对催化氧化效率的影响时,采用
(6)步骤Ⅲ装置存在的不足之处是
您最近一年使用:0次
2023-02-20更新
|
6639次组卷
|
15卷引用:2022年福建省高考真题化学试题
2022年福建省高考真题化学试题(已下线)专题16 化学实验综合题-2022年高考真题模拟题分项汇编(已下线)2022年福建省高考真题变式题(实验探究题)(已下线)安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试变式题(实验探究题)(已下线)安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试举一反三(实验探究题)(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题突破卷13 化学实验基础(二)-2024年高考化学一轮复习考点通关卷(新教材新高考)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)山东省新泰市第一中学(弘文部)2023-2024学年高三上学期第二次月考化学试题福建省莆田第一中学2023-2024学年高一上学期期末考试化学试题宁夏回族自治区石嘴山市第三中学2023-2024学年高三上学期期末考试理综试题-高中化学天津市耀华中学2023-2024学年高三下学期开学验收考化学试卷
名校
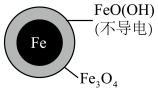
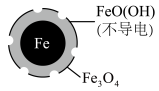
4 . 在pH=4.5时,利用原电池原理,用铁粉将废水中 无害化处理的实验如下表:
无害化处理的实验如下表:
下列说法正确的是
 无害化处理的实验如下表:
无害化处理的实验如下表:| 方案一 | 方案二 | |
| 初始条件 | pH=4.5 | pH=4.5,Fe2+ |
 去除率 去除率 | <50% | 接近100% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 |
|
|
A.该电池中Fe作负极,可被 完全氧化 完全氧化 |
B.正极的电极反应为: |
C.方案二的 去除率高,原因可能是Fe2+破坏了FeO(OH)层 去除率高,原因可能是Fe2+破坏了FeO(OH)层 |
D.改变铁粉粒径大小, 的去除速率不变 的去除速率不变 |
您最近一年使用:0次
2022-07-07更新
|
1497次组卷
|
6卷引用:四川省成都市2021-2022学年高二下学期摸底考试化学试题
四川省成都市2021-2022学年高二下学期摸底考试化学试题(已下线)第14讲 铁的单质、氧化物和氢氧化物(讲义)-【帮课堂】2022-2023学年高一化学同步精品讲义(人教2019必修第一册 )(已下线)4.1.1 原电池的工作原理-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)河南省洛阳市宜阳县第一高级中学2022-2023学年高二上学期第五次能力达标测试化学试题四川省成都经济技术开发区实验中学校2022-2023学年高二下学期5月月考化学试题四川省成都市树德中学2022-2023学年高一下学期期末考试化学试题
名校
解题方法
5 . 磷灰石的主要成分是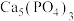 ,用磷灰石制备FePO4的流程如下:
,用磷灰石制备FePO4的流程如下:

下列说法错误的是
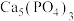 ,用磷灰石制备FePO4的流程如下:
,用磷灰石制备FePO4的流程如下:
下列说法错误的是
| A.用H3PO4溶液、H2SO4溶液分步浸取磷灰石比只用H2SO4溶液好 |
| B.用酸对磷灰石进行酸浸时,可用玻璃棒不断地搅拌使HF快速挥发 |
| C.用加热、矿石粉碎、搅拌、适当提高酸的浓度等方法来提高酸浸的效率 |
| D.加入“FeSO4,H2O2,调节pH”的过程中,加入H2O2的目的是氧化Fe2+ |
您最近一年使用:0次
名校
6 . 鱼浮灵是一种化学增氧剂,主要成分为过氧碳酸钠(2Na2CO3·3H2O2),分别在等体积双氧水中加入少量Na2CO3、NaCl和NaOH固体探究鱼浮灵增氧原理,实验结果如图所示。下列说法不正确 的是
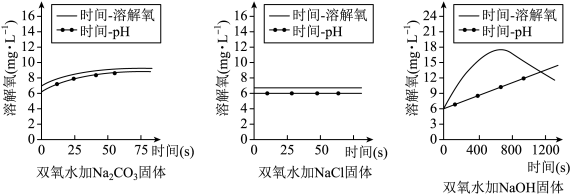

| A.Na2CO3对H2O2的分解有促进作用 | B.加入NaCl后溶液溶解氧变化不明显 |
| C.H2O2分解随pH增大而持续加快 | D.鱼浮灵使用时应根据pH控制投放量 |
您最近一年使用:0次
2022-06-22更新
|
296次组卷
|
5卷引用:浙江省宁波效实中学2021-2022学年高一下学期期中考试化学(选考)试题
7 . 金属钼(Mo)、镍(Ni)是重要的战略金属,广泛应用在钢铁、化工等领域,辉银矿的主要 ,还含有Ni、V、Fe等金属元素,处理辉钼矿有火法和湿法两种工艺。下图是用NaClO溶液(pH>9)湿法浸取辉钼矿制备仲钼酸铵[
,还含有Ni、V、Fe等金属元素,处理辉钼矿有火法和湿法两种工艺。下图是用NaClO溶液(pH>9)湿法浸取辉钼矿制备仲钼酸铵[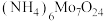 ]的工艺流程(已知:次氯酸钠溶液化学性质不稳定,常温下缓慢分解成NaCl,
]的工艺流程(已知:次氯酸钠溶液化学性质不稳定,常温下缓慢分解成NaCl, 和
和 )。
)。
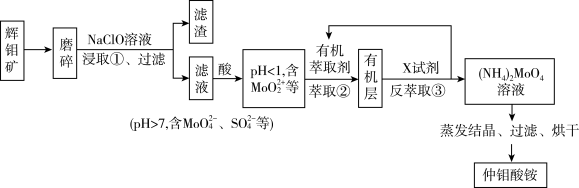
请回答下列问题:
(1)传统的火法工艺是在空气中灼烧辉铝矿得到 和
和 ,和上述湿法工艺相比这种方法最大的缺陷是
,和上述湿法工艺相比这种方法最大的缺陷是_______ 。
(2)浸取辉钼矿之前要先将辉钼矿磨碎,目的是_______ 。
(3)步骤①中 溶于NaClO溶液,发生反应的离子方程式为
溶于NaClO溶液,发生反应的离子方程式为_______ 。
(4)步骤②由于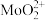 易溶于有机萃取剂,可以发生草取。步骤③反萃取时使用的X试剂为
易溶于有机萃取剂,可以发生草取。步骤③反萃取时使用的X试剂为_______ ,步骤②③的作用为_______ 。
(5)某科研小组研究温度对步骤①中浸取率的影响。实验条件为NaClO)的浓度为130g/L,汉取液pH=9。反应时间1.5h温度控制为采用冷水浴冷却和不冷却两种,实验结果见下表:
出现上表实验结果的原因为_______ 。
(6)碳钢在空气中容易被腐蚀,加入钼酸盐有利于缓蚀,其缓蚀原理是在钢铁表面形成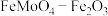 保护膜。密闭式循环冷却水系统中的碳铜管道缓蚀,除需加入钼酸盐外还需加入
保护膜。密闭式循环冷却水系统中的碳铜管道缓蚀,除需加入钼酸盐外还需加入 ,则
,则 的作用是
的作用是_______ 。
 ,还含有Ni、V、Fe等金属元素,处理辉钼矿有火法和湿法两种工艺。下图是用NaClO溶液(pH>9)湿法浸取辉钼矿制备仲钼酸铵[
,还含有Ni、V、Fe等金属元素,处理辉钼矿有火法和湿法两种工艺。下图是用NaClO溶液(pH>9)湿法浸取辉钼矿制备仲钼酸铵[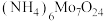 ]的工艺流程(已知:次氯酸钠溶液化学性质不稳定,常温下缓慢分解成NaCl,
]的工艺流程(已知:次氯酸钠溶液化学性质不稳定,常温下缓慢分解成NaCl, 和
和 )。
)。
请回答下列问题:
(1)传统的火法工艺是在空气中灼烧辉铝矿得到
 和
和 ,和上述湿法工艺相比这种方法最大的缺陷是
,和上述湿法工艺相比这种方法最大的缺陷是(2)浸取辉钼矿之前要先将辉钼矿磨碎,目的是
(3)步骤①中
 溶于NaClO溶液,发生反应的离子方程式为
溶于NaClO溶液,发生反应的离子方程式为(4)步骤②由于
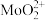 易溶于有机萃取剂,可以发生草取。步骤③反萃取时使用的X试剂为
易溶于有机萃取剂,可以发生草取。步骤③反萃取时使用的X试剂为(5)某科研小组研究温度对步骤①中浸取率的影响。实验条件为NaClO)的浓度为130g/L,汉取液pH=9。反应时间1.5h温度控制为采用冷水浴冷却和不冷却两种,实验结果见下表:
| 反应条性 | 反应现象和结果 |
| 冷水浴 | 反应温度保持30℃左右,Mo元素的浸取率为83.3%。 |
| 不冷却 | 温度上升很快,最高为60℃左右,有大量的气泡产生,Mo元素的浸取率为7.8%。 |
(6)碳钢在空气中容易被腐蚀,加入钼酸盐有利于缓蚀,其缓蚀原理是在钢铁表面形成
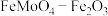 保护膜。密闭式循环冷却水系统中的碳铜管道缓蚀,除需加入钼酸盐外还需加入
保护膜。密闭式循环冷却水系统中的碳铜管道缓蚀,除需加入钼酸盐外还需加入 ,则
,则 的作用是
的作用是
您最近一年使用:0次
名校
解题方法
8 . MTP是一类重要的药物中间体,可以由TOME经环化后合成。其反应式如下所示:
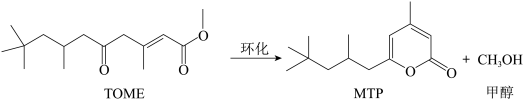
为了提高TOME的转化率,反应进行时需及时从溶液体系中移出部分甲醇。TOME的转化率随反应时间的变化如图所示。设TOME的初始浓度为a mol/L,反应过程中的液体体积变化忽略不计,发生的其他副反应忽略不计。

已知:转化率= ,也可以用百分数表示。下列说法错误的是
,也可以用百分数表示。下列说法错误的是

为了提高TOME的转化率,反应进行时需及时从溶液体系中移出部分甲醇。TOME的转化率随反应时间的变化如图所示。设TOME的初始浓度为a mol/L,反应过程中的液体体积变化忽略不计,发生的其他副反应忽略不计。

已知:转化率=
 ,也可以用百分数表示。下列说法错误的是
,也可以用百分数表示。下列说法错误的是| A.X、Y两点消耗反应物TOME的速率v正(X)<v正(Y) |
| B.X、Z两点该化学反应的瞬时速率大小为v(X)>v(Z) |
C.210℃时,0~150 min之间用MTP表示该化学反应的速率为 |
D.若Z点处于化学平衡,则平衡时溶液体系中甲醇的百分含量为 |
您最近一年使用:0次
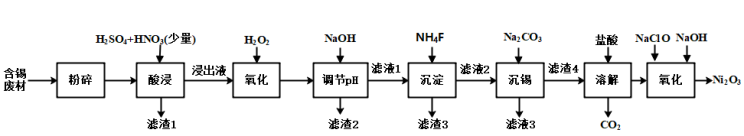
9 . 三氧化二镍(Ni2O3)是一种灰黑色、无气味、有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料生产NiCl2,继而生产Ni2O3,其工艺流程如下:
已知:①下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算)。
②25℃时,Ksp(NiCO3)= 1×10-6
回答下列问题:
(1)“酸浸”过程中,l mol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式:_______ 。
(2)“酸浸”后的酸性溶液中加入H2O2的目的是_______ 。
(3)“沉镍”前需加NaOH控制溶液pH的范围为_______ ;“滤渣1”的主要成分有_______ 。
(4)“氧化”时生成Ni2O3的离子方程式为_______ 。
(5)保持其他条件不变,在不同温度下对含镍废料进行“酸浸”,镍的浸出率随时间变化如图。“酸浸”的最佳温度与时间分别为_______ ℃、_______ min。

(6)“沉镍”过程中,若滤液中c(Ni2+)= 2.0 mol/L,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤1×10-5mol/L],则需要加入Na2CO3固体的质量最少为_______ 。(不考虑 水解,计算结果保留两位小数)
水解,计算结果保留两位小数)

已知:①下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算)。
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 3.0 | 6.7 |
| 沉淀完全的pH | 3.2 | 9.0 | 4.7 | 9.2 |
回答下列问题:
(1)“酸浸”过程中,l mol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式:
(2)“酸浸”后的酸性溶液中加入H2O2的目的是
(3)“沉镍”前需加NaOH控制溶液pH的范围为
(4)“氧化”时生成Ni2O3的离子方程式为
(5)保持其他条件不变,在不同温度下对含镍废料进行“酸浸”,镍的浸出率随时间变化如图。“酸浸”的最佳温度与时间分别为

(6)“沉镍”过程中,若滤液中c(Ni2+)= 2.0 mol/L,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤1×10-5mol/L],则需要加入Na2CO3固体的质量最少为
 水解,计算结果保留两位小数)
水解,计算结果保留两位小数)
您最近一年使用:0次
2022-01-22更新
|
158次组卷
|
2卷引用: 山西省太原市2021-2022学年高三上学期期末考试化学试题
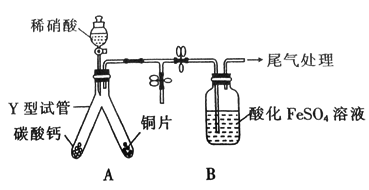
10 . 为探究铜与稀硝酸反应的产物及影响反应速率的主要因素,进行如下实验。实验一探究铜和稀硝酸反应的产物。实验装置如图,气密性已检查。
已知: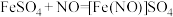 ,该反应较缓慢,待生成一定量
,该反应较缓慢,待生成一定量 时突显明显棕色。
时突显明显棕色。
(1)实验开始时先将 形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,该实验操作的目的是
形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,该实验操作的目的是_______ 。
(2)铜片和稀硝酸反应的化学方程式为_______ 。
(3)本实验 生成的气体中,若有
生成的气体中,若有 ,
, 的实验现象为
的实验现象为_______ ;
实验二:探究铜和稀硝酸反应速率先慢后快的原因
经过实验一,测得硝酸的浓度 ,只有
,只有 生成。当铜片与
生成。当铜片与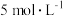 硝酸反应时,开始时反应非常缓慢,一段时间后反应速率明显加快。为探究此反应的反应速率先慢后快的原因,进行如下探究:
硝酸反应时,开始时反应非常缓慢,一段时间后反应速率明显加快。为探究此反应的反应速率先慢后快的原因,进行如下探究:
探究一:研究反应过程的温度变化对反应速率的影响,实验所得曲线和现象记录如图表。
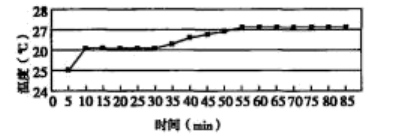
(4)从上述图表分析可得到的结论是_______ 。
探究二:研究化学反应产物对反应速率的影响
设计了如表实验,利用图中装置测定溶液突显明显棕色的时间。
(5)请将表中实验1的实验条件填写完整①_______ ②_______ ③_______
(6)通过实验发现实验1、2、3的反应速率并无明显变化,为达到实验目的还需要继续进行的实验是_______ 。

已知:
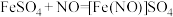 ,该反应较缓慢,待生成一定量
,该反应较缓慢,待生成一定量 时突显明显棕色。
时突显明显棕色。(1)实验开始时先将
 形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,该实验操作的目的是
形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,该实验操作的目的是(2)铜片和稀硝酸反应的化学方程式为
(3)本实验
 生成的气体中,若有
生成的气体中,若有 ,
, 的实验现象为
的实验现象为实验二:探究铜和稀硝酸反应速率先慢后快的原因
经过实验一,测得硝酸的浓度
 ,只有
,只有 生成。当铜片与
生成。当铜片与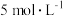 硝酸反应时,开始时反应非常缓慢,一段时间后反应速率明显加快。为探究此反应的反应速率先慢后快的原因,进行如下探究:
硝酸反应时,开始时反应非常缓慢,一段时间后反应速率明显加快。为探究此反应的反应速率先慢后快的原因,进行如下探究:探究一:研究反应过程的温度变化对反应速率的影响,实验所得曲线和现象记录如图表。
时间/ | 现象 |
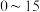 | 铜表面出现气泡,但速度很慢 |
| 25 | 溶液有很浅的蓝色,气泡生成速度加快 |
| 30 | 气泡生成速度较快,均匀冒出 |
| 45 | 洗气瓶中可见少量淡棕色的物质 |
| 50 | 溶液中蓝色明显变深,洗气瓶中突显明显棕色 |

(4)从上述图表分析可得到的结论是
探究二:研究化学反应产物对反应速率的影响
设计了如表实验,利用图中装置测定溶液突显明显棕色的时间。
| 序号 | 温度 | 铜片/ | 硝酸/ | 硝酸铜/ |
| 1 |  | ① | ② | ③ |
| 2 |  | 5 | 20 | 0.5 |
| 3 |  | 5 | 20 | 1.0 |
(6)通过实验发现实验1、2、3的反应速率并无明显变化,为达到实验目的还需要继续进行的实验是
您最近一年使用:0次